您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-04 11:58
在新药的研发过程中,根据化合物分子的结构特征快速推断其类药性(类药性,即赋予一个化合物良好的吸收、分布、代谢、排泄和安全性性质。),将大大的提高药物研发速度,而影响药物类药性的内在因素就是药物理化性质以及其生物学性质,而影响药物理化性质与生物学性质的内在因素就是药物分子最基本的结构特征,即化学中常说的结构决定性质。
在药物的研发过程中,制剂人一来更多的去关注药物在与环境相互作用,比如溶解度,即药物分子与水分子的相互作用,溶质分子与水分子通过氢键作用力、范德华力等相结合形成药物溶液;渗透性,即药物分子与磷脂双分子层的相互作用,通常使用LogP来表示;稳定性,即药物分子与环境中的其他物质的相互作用,比如光、氧气、热、水、辅料中的杂质以及甲醛等,进而改变药物的结构,影响其安全性和有效性。制剂人二来也会关注的就是药物与体内生物大分子的相互作用,比如蛋白质,研究药物跨膜转运机理。
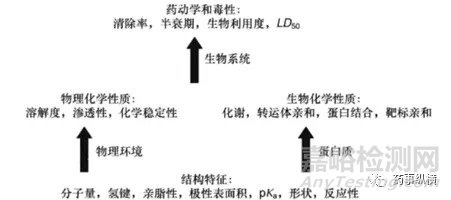
可是,经过探本溯源,你会发现无论是药物的溶解性,渗透性,稳定性还是与蛋白的结合性都与其结构有着根本性的关联,也就是化合物的结构决定了其基本特征,基本特征决定了其物理化学和生物化学性质,后者最终决定了它的药动学和毒性。
那么,一个具体化合物我们需要关注其哪些结构特征呢?下面一一道来。
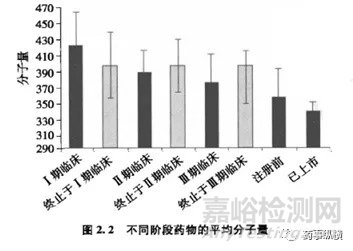
a.化合物分子量MW:分子量与分子的大小有关。当分子增大时,需要在水中形成一个更大的空腔,以使得化合物溶剂化,从而溶解度会下降。分子量增加会降低化合物在肠上皮细胞表面的浓度,从而减少吸收。增大分子体积也阻止了被动扩散通过双层膜紧密排列的脂肪侧链。所以Lipinski规则,(即五规则,氢键供体>5(包括OH和NH数目的总和);分子量>500;IogP>5;氢键受体>10(包括O和N数目的总和),满足两条以上将表明该药物分子吸收性或者渗透性很差,影响药物最终在体内的生物利用度。)将化合物的分子量建议在500以下。据有关研究发现,小分子量的药物更有可能进入三期临床,获得上市批件。
b.亲脂性:药物分子的亲脂性是研究药物在极性溶剂和非极性溶剂的分配情况。一般情况下,使用正辛醇作为非极性介质,而使用缓冲溶液作为极性相。亲脂性的大小通常使用LogP或者LogD来表示。
LogP:在化合物的所有分子均以中性形式存在的pH条件下,其在一种有机相(例如辛醇)和一种水相(例如缓冲液)中分配系数的对数即为LogP。
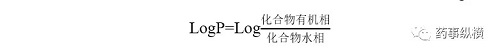
LogD:某一特定的pH(x)下,化合物部分以离子形式存在,部分以中性分子形式存在;此pH下的化合物在一种有机相(例如辛醇)和一种水相(例如缓冲液)中分配系数的对数即为LogD。
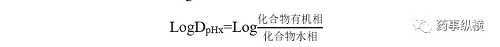
一般来说,20%的药物是酸性药物,75%的药物是碱性或者酸碱两性药物,只有5%的药物是中性药物。对酸碱性药物来说,在不同pH条件下,发生不同程度的电离,改变药物的存在形式(分子型or离子型),进而影响药物在极性以及非极性介质中的分配情况。一般来说,人体胃肠道是一个pH呈现梯度变化的一个环境,pH值逐步增加。对于碱性药物随着胃肠道pH值的不断增加,离子形式减少,分子形式增加,药物亲脂性增加,亲水性降低,即LogP增加。对于酸性药物胃随着肠道pH值的不断增加,离子形式增加,分子形式减少,药物亲脂性减少,亲水性增加,即LogP减少。
LogP或者LogD值的测定所带给我们哪些启示。当然对于中性药物,无法发生电子,不同pH条件下,LogP与LogD是一致的;而对于更多的酸碱两性药物,LogD的测定可能更加反应其在人体内真实的分配情况,进而影响其吸收。

c.氢键:氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(O F N等)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,称为氢键。计算氢键数目的最简单的方法就是数数化合物中形成氢键的原子个数,Lipinski规则中就提出了去数数化合物中氢键受体与氢键供体的数目,然后去推断化合物的相关性质。显然,化合物中氢键受体与氢键供体的数目越多,越易于与水通过氢键作用,增加化合物的水溶性,提高其溶解度。
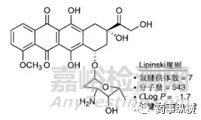
上图按照Lipinski规则分别计算了阿霉素结构特征,正如规则中相关结构特征所预期的那样,阿霉素的口服生物利用度奇差。
d.极性表面积:除了咱们上面说到的Lipinski规则,Verber规则在通过结构快速判定化合物的性质上也常常拿来使用,其认为分子的柔性,极性比表面积和氢键数目是决定口服生物利用度的重要因素。对于大鼠,良好的生物利用度的Veber规则如下:
1 ≤10个可旋转化学键
2 ≤140极性表面积,或者≤12个氢键总数(受体加供体)
其中,极性表面积,即化合物内极性分子的总表面积,多为氧原子及氮原子,也包括与其相连的氢原子。在药物化学的应用中,极性表面积是评价药物在细胞内的可运输性质的描述指标。这一参数的大小与药物在人体内的小肠吸收量、Caco-2单层可透性及血脑屏障的穿透性有明显关联。一例子是当一分子的极性表面积大于1.4平方纳米时,其在细胞的穿透性就会变差。一种需穿越血脑屏障并作用于中枢神经系统的感受体上的药物,其极性表面积就不能大于0.6平方纳米。
e.活性官能团;给我们一个新的化合物,除了关注氢键,分子量等一般性质,活性官能团将决定其稳定性。比如说,如果化合物物种存在伯胺或者仲胺,我们就需要格外关注处方中是否存在还原糖(乳糖)或者含有辅料在制备生产过程中是否引入醛类物质,这样极有可能存在原辅料相容性问题。比如化合物中含有酰胺或者酯基,这个时候我们就要格外注意化合物的水解问题,当然这个反应有的时候也能给我们带来益处,比如前药。
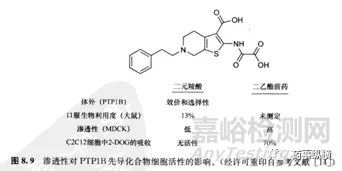
上图中的PTP1B先导化合物是一个二元羧酸,它在体外酶试验中表现出效价和选择性。合成的二乙酯前药的渗透性和细胞试验活性均大幅度改善。
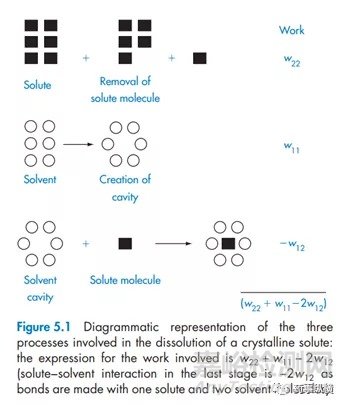
总结:创新药物的历史之久,耗费人力物力之巨大,万不可揣着糊涂装糊涂。当我们试着去解释溶解度的时候,不妨从分子的结构去做个基本的推断;在实际的研发过程当我们遇到一些问题,比如稳定性问题,不妨从化合物活性基团去推断可能发生了哪些反应,哪些物质会催发这个反应;当我们发现药物溶出难,溶出慢的时候,想着去增溶,也不妨从药物溶解的机理去对症下药,药物是因为晶体问题致使药物分子难以脱离晶体引发的熔化热太高,还是药物溶剂化太差导致的溶解热太低了,而不是三七二十一,一顿操作猛如虎。还是结构决定性质的观点,还是以始为终的思考逻辑,还是不积跬步无以至千里的精耕细作。革命尚未成功,吾辈还需努力!
参考文献:
1. 类药性质:概念、结构设计与方法:从ADME到安全性优化
2. Martin物理药剂学与药学
3.固体口服制剂的研发-药学理论与实践
4.生物药剂学在药物研发中的应用
5.药物生物利用度
6.Physicochemical Principles of Pharmacy

来源:药事纵横


