您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-23 08:56
1、 概述
用于各种药物剂型的活性药物成分(API)需要达到一定的纯度要求,符合相关的质量标准;工艺研发流程中的中间体亦需要具有一定纯度,严格控制影响下一步反应或者影响下一步目标产物或终产品纯化的杂质的含量(impurity or purity)。在长期稳定性实验,加速稳定性实验以及API强制降解试验中,分析方法不仅需要能够对API原有组分做到有效分离,对于实验处理后样品同样需要具有有效分离各组分的能力亦即impurity indicating(stability indicating)。
两种分析方法一般选择HPLC进行开发,impurity分析方法要求API中已有杂质做到有效分离(Resolution> 1.5),主成分的色谱峰峰形对称;stability indicating分析方法除此之外,与之最大不同在于,能够对各种条件(长期稳定性,加速稳定性,强制降解以及制剂过程中)下可能产生的相关杂质实现有效分离,其开发难点在于各种条件下所产生的impurity profile有所不同,从而导致在分析方法开发的时候,可能出现顾此失彼的状况。
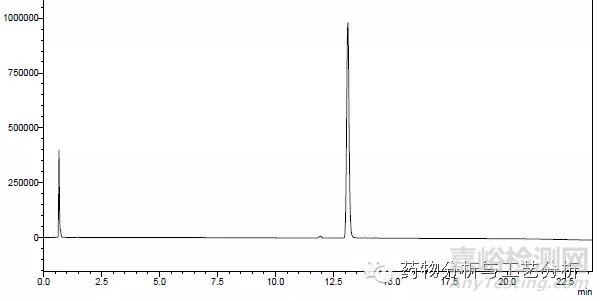
Figure 1 impurity or purity方法典型图谱
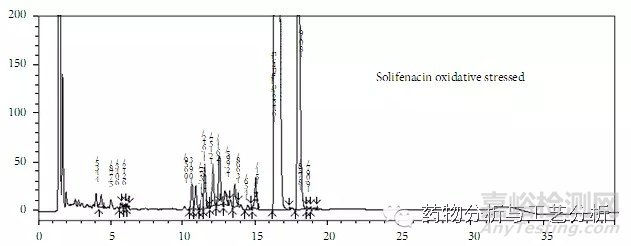
Figure 2 stability indicating方法典型图谱
2、Impurity or purity
Impurity or purity方法区别与IPC方法,前者分析样品纯度较高,有关杂质极性与保留能力分布范围较窄,相应的对于色谱柱以及流动相选择特异性比较强,对梯度斜率变化不十分敏感,分析方法运行时间一般比后者短。
2.1 Isocratic or gradient
对于纯度检测,HPLC操作模式可选isocratic或者gradient模式(其他操作条件一致情况下,isocratic模式下,检测器响应值要比gradient模式小,达到同等检测限,isocratic模式需要的样品浓度较大),两种模式的选择需要根据分析方法运行总时间,有关杂质与主成分极性,保留能力相关性综合考虑。
无论isocratic还是gradient模式,均需要优先对容量因子K进行选择,以合适的色谱峰宽作为标准,K优先控制在5-10为宜(方法运行时间可控,样品浓度不至于太大,以免对于一些化合物出现样品超载,导致色谱峰形变异或方法线性范围较窄的情形发生)。方法开发时,对于K的控制,可以先选定一个有机相比例以及固定梯度斜率,得到起始的容量因子K1,之后依据Snyder规则(lgK= lgKw - Sψ)调整起始有机相比例得到容量因子K2(5-10),之后再根据样品的impurity profile调整梯度斜率,使各杂质分离度达到相关要求并再次微调有机相起始比例即可,如需进一步优化,可以渐近法循环调整。

Figure 3 容量因子K调整流程
2.2 色谱柱
一般地,对于非有机酸/碱类样品,全多孔硅胶基质/有机与无机杂化基质,封端(避免裸露硅羟基引起色谱峰拖尾)C8色谱柱以及C18色谱柱即可满足需求;对于有机酸/碱类样品,C8,C18色谱柱一般不存在容量因子K的问题,问题在于样品的载样量以及色谱峰的峰形一般较差(拖尾);Shield RP色谱柱作为极性基团内嵌色谱柱,虽然能够一定程度上改善色谱峰的峰形(如图4a,图4b),但与RP色谱柱的内嵌极性基团是什么以及样品呈现酸(碱)性有关。
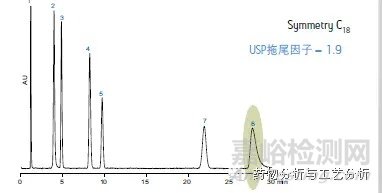
Figure 4a Shield RP色谱柱对拖尾因子的改善作用
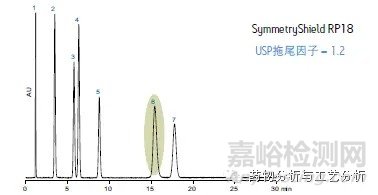
Figure 4b Shield RP色谱柱对拖尾因子的改善作用
纵然可以通过增加有机相的起始比例(对于Gradient)以及增大梯度斜率的方式,减小拖尾因子,但是样品的载样量依然没有得到改善,且容量因子会变小,方法对于杂质的分辨能力也随之降低。
能够同时增加样品载样量以及改善色谱峰峰形的有效方法是使用离液离子(氯化铵、磷酸盐、硼酸盐等)并调节pH,或者使用离子对试剂(在使用该方法时,需要注意色谱柱需要使用全封端色谱柱尽可能避免使用gradient模式)。
2.3 流动相
有机相一般选择背景吸收弱的试剂,乙腈与甲醇二者极性差别只有0.6,而前者则可作为氢键的受体,后者则可作为氢键的给体,二者在选择性上具有较强的互补作用,但甲醇相比乙腈,黏度较大造成系统背压较高。
流动相添加剂大致有五类可供选择:酸性添加剂,碱性添加剂,离液离子,缓冲盐以及离子对添加剂。以减小背景吸收,降低检测限作为出发点的话,酸性添加剂优先选择磷酸以及盐酸(截止吸收≤195 nm);以与MSD兼容角度出发,优先选择TFA以及FA(截止吸收210 nm左右)。碱性添加剂一般选择氨水、二乙基铵或三乙基铵;离液离子一般选择氯化铵、磷酸盐、硼酸盐等;缓冲盐一般选择甲酸铵与乙酸铵;离子对试剂一般选择己烷磺酸钠盐、庚烷磺酸钠盐,十二烷基硫酸钠盐以及季铵盐等。值得注意的是在使用缓冲盐以及离子对试剂的时候,需要注意其纯度,需是HPLC级别,否则在有机相比例线性增加的时候,会有过多未知干扰峰出现(在使用离子对试剂的时候,尽量使用Isocratic模式,避免使用Gradient模式)。
2.4 拖尾因子
导致色谱峰拖尾的原因比较多,大致有:溶剂效应会引起色谱峰拖尾,色谱柱柱效下降引起色谱峰拖尾,流动相以及pH不合适引起色谱峰拖尾等。一般地,容量因子K在5-10的范围内的色谱峰拖尾,可排除溶剂效应的原因,如果新色谱柱亦拖尾,则大多是由于流动相以及pH选择不合适,未能有效避开样品pKa±2的区间。此时,需要对流动相的pH做出调整。
此外,需要区分真的拖尾以及未知杂质峰压在主峰尾巴上的情况,一般地,非酸/碱性样品,不大会出现色谱峰拖尾较大的情况。此时可对峰纯度进行检测,对比多种吸收波长下的色谱峰形状或通过进一步降低梯度斜率以及与MSD联用,做出判断。
3 、Stability indicating or impurity indicating
Stability indicating(impurity indicating)方法与impurity(purity)方法的最大区别在于前者不仅要求对已然存在的组分能够有效分离,而且要求能够对多种条件下可能产生的杂质与已有组分做到有效保留并分离。这就要求分析方法的有效色谱峰容量(Res.>1.5)尽可能大,需要对样品的分子结构具有足够的了解,如下图分子结构(图5a,图5b,图5c)。
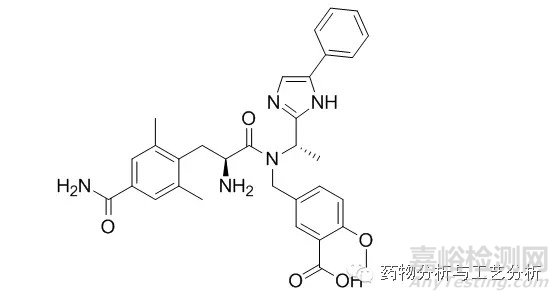
Figure 5a 两性化合物
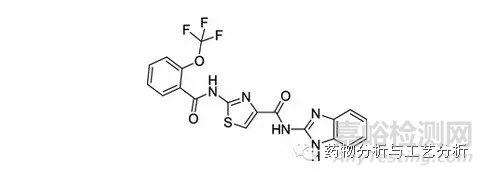
Figure 5b 碱性化合物
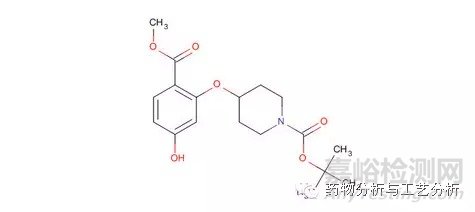
Figure 5c 酸性化合物
如上图5a所示分子结构为一两性化合物,图5b所示分子结构为一碱性化合物,图5c所示分子结构为一酸性化合物。在各种实验条件下,图5a结构酰胺键可能发生水解,形成一个含有两羧基的两性化合物片段以及一个含有两个二级胺的两性化合物片段(图5b以及图5c所示分子结构类似,均可能有极性更大的片段分子产生),二者的保留均会前移,甚至可能保留不住。
如上述讨论情况,就需要对样品的分子结构具有一定的了解,在方法开发之初,就预留出足够的色谱峰容量,对各种实验条件下产生的相关杂质尽可能做到有效保留。
4、 结论
Impurity(purity)方法的目的是对生产的中间体以及终产品进行质量控制,而Stability indicating(impurity indicating)方法则是对各种实验条件以及长期稳定性实验过程中所产生的相关杂质进行检测,其产生的impurity profile直接反应化合物的稳定性,其数据可以直接用于后期制剂研发过程。

来源:药物分析与工艺分析


