您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-09 08:52
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
君实生物PCSK9单抗启动III期临床。君实生物PCSK9靶向单抗药物JS002登记启动一项III期研究,用于治疗原发性高胆固醇血症和混合型高脂血症。目前全球已上市2个PCSK9单抗,分别是安进的依洛尤单抗(Repatha)和赛诺菲/再生元的阿利西尤单抗(Praluent),且两款药物均已在国内获批。国内有7家企业布局PCSK9靶点的新药已进入临床阶段,其中以信达、君实进展最快已进入III期临床。
国内药讯
1.恒瑞医药恒格列净申报上市。恒瑞医药1类新药脯氨酸恒格列净片上市申请获CDE受理。这是首个在国内申报上市的国产SGLT-2抑制剂。脯氨酸恒格列净片适用于治疗2型糖尿病,该药与厄贝沙坦联合用药拟适用于治疗合并高血压的2型糖尿病肾病的适应症正处于开发阶段。全球目前共有8款SGLT-2抑制剂获批上市,其中,卡格列净(强生)、达格列净(阿斯利康)、恩格列净(勃林格殷格翰/礼来)和艾格列净(默沙东)已全部在中国获批上市。
2.科济生物CAR-T疗法获FDA孤儿药资格。FDA授予科济生物自体CAR-T细胞疗法CLDN18.2 CAR-T(CT041)孤儿药资格,用于治疗胃腺癌和食管胃结合部腺癌。CT041是科济生物自主研发的一款人源化抗CLDN 18.2自体CAR-T细胞注射液,拟开发用于治疗CLDN18.2表达阳性、既往经系统治疗后出现进展或复发的晚期胃腺癌/食管胃结合部腺癌、胰腺癌等适应症。目前,CT041已在中美两国获批进入临床试验,将在北京大学肿瘤医院、梅奥诊所等多家临床机构进行Ⅰb期临床试验。
3.复宏汉霖新冠中和抗体获FDA批准临床。复宏汉霖新冠病毒中和抗体HLX70的新药临床试验申请获FDA批准。HLX70是一款靶向新冠病毒SARS-CoV-2表面S蛋白S1亚基上受体结合域(RBD)的全人源单抗,是典型的IgG1 Kappa免疫球蛋白,拟用于COVID-19、COVID-19伴发的急性呼吸窘迫综合征或多重器官衰竭等适应症。除HLX70外,复宏汉霖也在加速推进另一款针对COVID-19的ACE2-Fc受体融合蛋白HLX71的临床前研究。
4.罗氏Tecentriq新适应症申请拟纳入优先审评。罗氏阿替利珠单抗注射液(Tecentriq)第3项适应症上市申请获CDE纳入拟优先审评公示名单,用于检测评估为≥50%肿瘤细胞PD-L1染色阳性(TC≥50%)或肿瘤浸润PD-L1阳性免疫细胞(IC)覆盖≥10%的肿瘤面积(IC≥10%)的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非小细胞肺癌(NSCLC)患者的一线治疗。目前Tecentriq在中国已获批联合化疗一线治疗广泛期小细胞肺癌,其联合贝伐珠单抗一线治疗肝癌的第2项上市申请正处于“在审评”阶段。
5.百济神州与BioAtla公司修订合作协议。百济神州与专注开发条件性激活生物制剂(CAB)蛋白质疗法的BioAtla公司宣布修订针对新型条件性激活CTLA-4抑制剂BA3071达成的全球开发和商业化协议。根据修订条款,百济神州将拥有BA3071的全球独家授权,并将全权负责其在全球范围内的临床开发和商业化,以及有权获得产品未来销售的全部利润。除原协议规定的预付款外,BioAtla公司还将有资格获得近期开发和药政里程碑付款以及经修订增加的全球销售分级特许使用费。经修订协议的其他条款尚未披露。
国际药讯
1.FDA批准间皮瘤免疫组合疗法。FDA批准百时美施贵宝(BMS)Opdivo(nivolumab)与Yervoy(ipilimumab)联用,一线治疗无法通过手术切除的恶性胸膜间皮瘤(MPM)成人患者。这是16年来首个获批用于间皮瘤的药物疗法,也是FDA批准的第二个间皮瘤系统疗法。在一项临床试验中,605例先前未经治疗且肿瘤不可切除的MPM患者接受这一组合疗法的治疗,与化疗相比,这一组合疗法显著改善了患者的总生存期(中位生存期:18.1个月vs14.1个月)。
2.辉瑞/BioNTech新冠疫苗向EMA递交滚动审查申请。欧洲药品管理局(EMA)受理了辉瑞与BioNTech合作开发的新冠疫苗BNT162b2提交的滚动审查申请。来自Ⅰ/Ⅱ期临床的积极数据表明,BNT162b2能够诱导受试者产生剂量水平依赖性免疫原性;能诱导T细胞识别新冠病毒刺突蛋白的更多表位,并且可同时诱导高幅度CD4+和CD8+T细胞应答;而且所有年龄组的BNT162b2耐受性良好,出现的不良事件为轻中度。
3.达格列净获FDA突破性疗法认定。阿斯利康宣布FDA授予其重磅SGLT2抑制剂达格列净(Farxiga)突破性疗法认定,用于慢性肾病(CKD)患者,无论他们是否患有2型糖尿病。在一项达格列净治疗慢性肾病的Ⅲ期临床DAPA-CKD中,达格列净将由肾功能显著下降(定义为肾小球过滤率持续下降超过50%)、终末期肾病、肾死亡和心血管死亡指标构成的复合终点风险降低了39%(ARR=5.3%,p<0.0001);与安慰剂相比,将全因死亡风险也减少31%(ARR=2.1%,p=0.0035)。
4.Alnylam创新RNAi疗法Ⅲ期结果积极。Alnylam公司在研RNAi疗法lumasiran在治疗1型原发性高草酸尿症(PH1)儿科(3-72个月)患者的Ⅲ期临床ILLUMINATE-B中获积极顶线结果。lumasiran治疗第6个月时使所有3种体重类别(<10kg、10-20kg和≥20kg)患者尿液中的草酸盐/肌酐比值与基线相比具有临床意义的降低;Lumasiran在次要终点(包括尿液和血浆草酸盐的其他指标)均显示积极结果;无与lumasiran相关的严重不良事件,安全性和耐受性特征与ILLUMINATE-A研究一致。完整结果将于ASN 2020年会上公布。
5.安进KRAS G12C抑制剂治疗NSCLC达II期终点。安进KRAS G12C抑制剂sotorasib(AMG 510)用于治疗晚期非小细胞肺癌(NSCLC)的II期CodeBreaK 100临床获积极结果。Sotorasib的客观应答率与先前报道的 I 期临床(960mg/日剂量组治疗晚期NSCLC)数据一致,到达主要终点。在数据截止时,有超过一半的应答患者仍在接受治疗且持续应答。安全性与耐受性与既往研究结果一致。这项潜在性II期注册性临床研究数据将于2021年的世界肺癌大会上公布。
6.CureVac新冠疫苗启动Ⅱa期临床。CureVac公司宣布其mRNA新冠疫苗CVnCoV在Ⅱa期临床中首名志愿者已接受了疫苗的注射。该项研究将在秘鲁和巴拿马招募690名健康志愿者,分两个年龄组(18-60岁、61岁及以上),评估间隔28天接受2针疫苗的安全性、反应原性以及体液免疫反应,以确定该疫苗的使用剂量。试验预期将于2020年第四季度获得初步的结果。
7.辉瑞DMD基因疗法获FDA快速通道资格。辉瑞拟用于治疗杜氏肌营养不良症(DMD)的在研基因疗法PF-06939926获FDA授予快速通道资格。PF-06939926将由人类肌肉特异性启动子控制的“迷你”抗肌萎缩蛋白(mini-dystrophin)转基因装在腺相关病毒9(AAV9)载体中。AAV9病毒载体具有向肌肉组织靶向递送转基因的能力。这款在研疗法已经被FDA授予孤儿药资格和罕见儿科疾病药物认定。
医药热点
1.2020年诺贝尔生理学或医学奖揭晓。2020年诺贝尔生理学或医学奖5日揭晓获奖名单。今年的生理医学奖颁给了美国病毒学家Harvey J Alter、Michael Houghton和Charles M Rice。获奖原因为“对丙型肝炎病毒的发现”。诺奖官网指出,血源性肝炎是一种主要的全球健康问题,会导致世界各地的人罹患肝硬化和肝癌。Harvey J. Alter、Michael Houghton和Charles M. Rice对丙型肝炎病毒的发现是目前对抗病毒性疾病的一项里程碑式的成就。
2.2位女科学家凭借CRISPR-CAS9基因编辑斩获2020诺贝尔化学奖。瑞典皇家科学院7日宣布,将2020年诺贝尔化学奖授予德国马克斯·普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士,以表彰她们在基因编辑领域的贡献。两位获奖者发现了 “CRISPR/Cas9基因编辑技术”。这一技术对生命科学研究产生了突破性影响,有助于研发新的癌症疗法,并可能使治愈遗传性疾病成为现实。
3.进京人员需核验近14日行程获绿码。按照北京市现有防疫政策,进(返)京人员需通过“健康宝”核验近14日行程才会获得“绿码”。首都之窗7日发布进(返)京人员“健康宝”核验提示,提醒相关市民通过‘国家政务服务平台’小程序,按要求填写手机号码和短信验证码以及14天到访地,完成14天内行程信息申报与核验,根据实际情况即可获得相应的健康状态。
4.12省份先行试点门诊费用跨省直接结算。国家医保局发布《关于推进门诊费用跨省直接结算试点工作的通知》,在北京、天津、河北、上海、江苏、浙江、安徽、重庆、四川、贵州、云南、西藏12个省(区、市)开展试点工作。2020年底前,总结先行试点地区可复制可推广的试点经验,依托国家医保局 “国家异地就医管理系统”,扩大门诊费用跨省直接结算试点范围,探索全国统一的门诊费用跨省直接结算制度体系、运行机制和实现路径。
股市资讯
【复星医药】1)公司控股子公司Hengenix Biotech,Inc.收到美国FDA关于同意抗S1全人源单克隆中和抗体HLX70用于治疗新型冠状病毒肺炎和新型冠状病毒引起的急性呼吸窘迫综合征或多重器官衰竭进行临床试验的函,拟于近期条件具备后于美国开展该新药的I期临床试验;2)公司控股子公司朝晖药业收到国家药监局颁发的关于奋乃静片的《药品补充申请批准通知书》,该药品通过仿制药质量与疗效一致性评价,主要用于精神分裂症及严重的恶心和呕吐的治疗。
【康泰生物】公司全资子公司北京民海生物科技有限公司获得乌兹别克斯坦共和国颁发的23 价肺炎球菌多糖疫苗的药品注册证。
【普利制药】公司于近日收到加拿大卫生部签发的硝普钠注射液批准通知,产品是一种血管扩张剂,主要用于高血压危象中立即降低成人和儿科患者的血压、手术期间控制血压以减少出血和治疗急性充血性心力衰竭。
审评动向
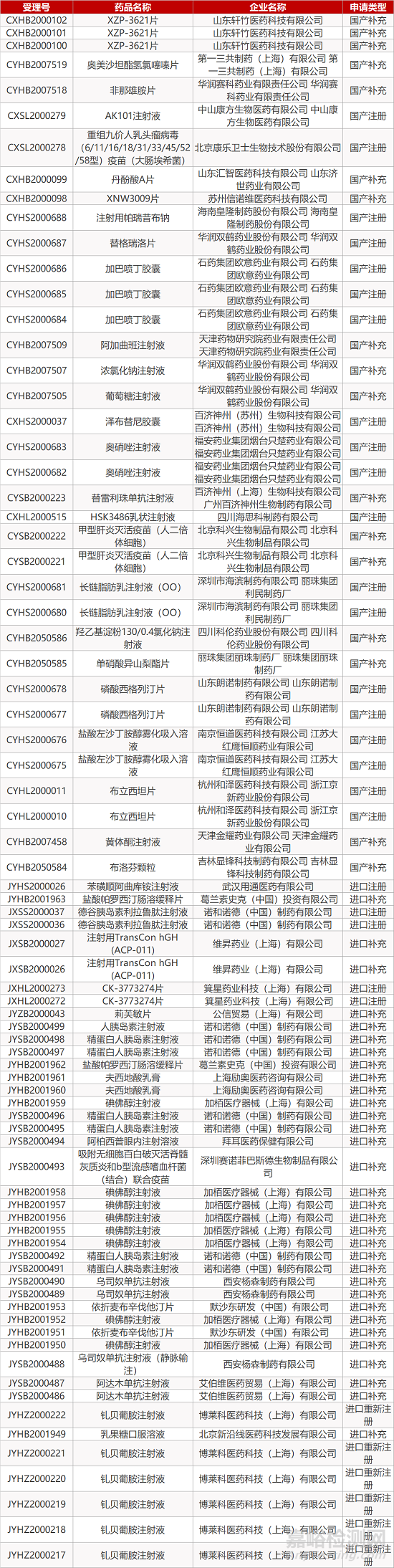
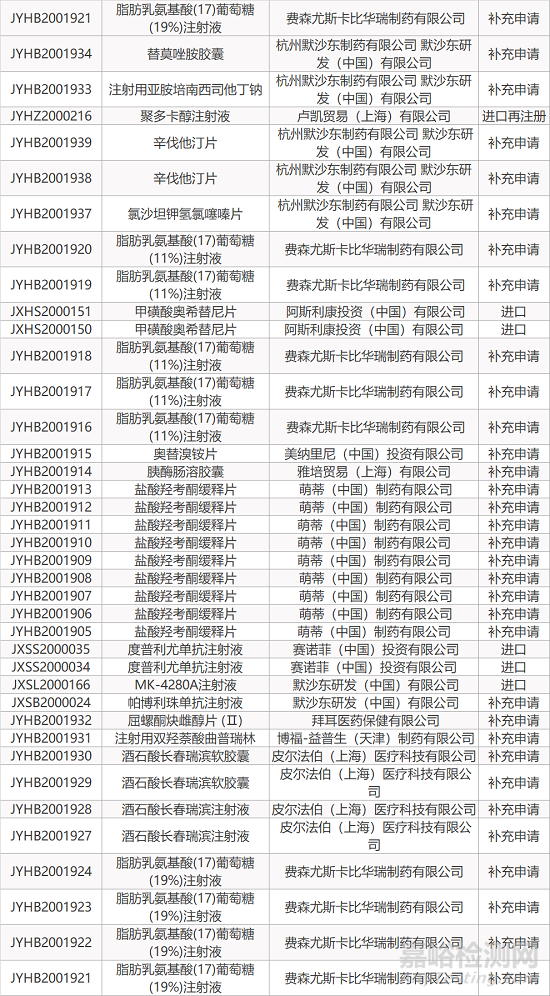
1. CDE最新受理情况(10月08日)
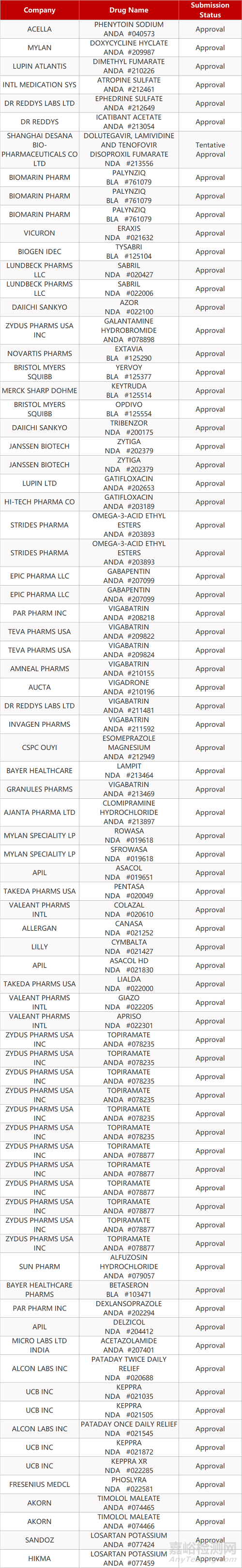
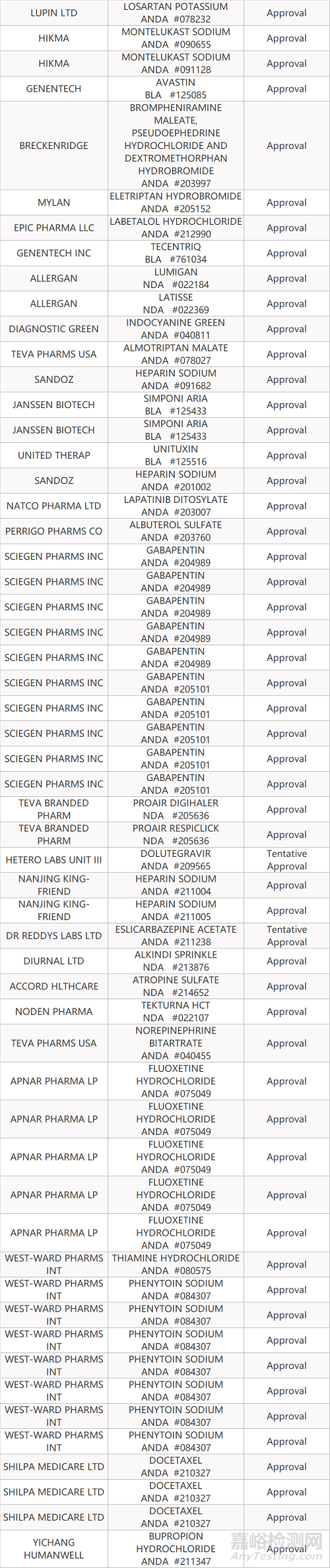
2. FDA最新获批情况(北美10月06日)
- The End -

来源:药研发


