您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-26 13:09
抗体-药物偶联物(Antibody-Drug Conjugate,ADC)是一类将单克隆抗体(monoclonal Antibody, mAb)与小分子细胞毒性药物(Drug)通过化学键(连接子,linker)共价结合的生物治疗药。ADC通过高特异性的单克隆抗体瞄准肿瘤细胞表面的抗原,之后通过内吞作用进入细胞,在溶酶体的作用下释放对于细胞具有高活性的小分子肿瘤细胞毒性药物,从而直接杀伤肿瘤细胞或诱导肿瘤细胞的凋亡。目前已推向市场或在研的ADC药物中所使用的细胞毒性药物主要包括微管蛋白抑制剂(例如DM1,DM4,MMAE,MMAF等)和DNA损伤剂(例如阿霉素,卡奇霉素,PBD等)。这些小分子细胞毒性药物产生细胞毒性的剂量比常规化疗药低1000倍左右,因此并不适合直接作为肿瘤治疗药物。而ADC药物通过将这些强毒性小分子与能“精确制导”肿瘤细胞的单抗偶联,就能将“火力”尽量集中在肿瘤细胞内,降低对非肿瘤细胞的“误伤”。
不同类别的ADC药物由于偶联位点和连接子的化学类型各有区别,其药物-抗体比率(drug-to-antibodyratio ,DAR)有差别。而同一类ADC由于体内的代谢与解偶联(catabolism anddeconjugation)作用,每个药物分子之间的DAR值也不同,一般分布在0到8之间,均值通常为4,即ADC药物是非均一性的混合物。因ADC在结构上的特殊性和复杂性,与传统小分子药物和单抗药物相比,评估ADC药物的PK就需要独特且更加复杂的生物分析检测方案。ADC的PK分析通常要检测其三个关键成分:总抗体(total antibody),总ADC,以及游离的小分子细胞毒性药物(free drug;含/不含linker)。对于ADC包含抗体的部分(包括ADC以及总抗体),研究者通常使用配体结合试验(Ligand-bindingassay,LBA)进行定量分析,并依此评估ADC的有效性和靶向毒性。而对于ADC的安全性和稳定性评估,即此类药物在体内循环中对于非肿瘤细胞的潜在毒性,则需对生物基质样品中游离的小分子细胞毒性药物进行定量分析。
稳定性是ADC游离小分子细胞毒性药物生物分析方法面对的第一个挑战。为了保证生物基质样品检测的可靠性和完整性,研究者除了要考虑小分子可能在较高温度、不同pH条件、或在基质中酶解而产生的不稳定性,也要考察在一定浓度的母药(即ADC)或含linker的小分子存在的条件下,在基质样品中不含linker的游离小分子的“稳定性”。而这后一种情况若存在不稳定性,则通常表现为游离小分子(不含linker)的浓度随时间增长或温度升高而升高,与小分子由于自身的不稳定性所导致的浓度下降刚好相反。这种导致小分子浓度升高的“不稳定性”与ADC连接子的性质相关。ADC连接子主要可分为可裂解和不可裂解两类,而可裂解连接子主要包括对酶敏感、对酸不稳定或对谷胱甘肽不稳定这三种。因此,研究者可以根据连接子和小分子本身的性质提出应对的稳定性解决方案。例如:是否在样品中添加缓冲试剂以控制pH或抑酶剂,在哪个阶段添加(临床采样、第一次化冻或是样品提取后),样品提取时是否可置于室温或是必须浸于湿冰浴中等。这些稳定性考察实验包括且不限于全血稳定性、实验台(样品前处理)稳定性、储存稳定性、冻融稳定性和样品提取后的稳定性。
ADC游离小分子细胞毒性药物在生物基质中浓度通常比较低,这是生物分析方法面对的另一个挑战。例如在一项对8种MMAE ADC的PK研究中,在单次静脉注射2.4 mg/kg的剂量之后,血浆中游离MMAE的浓度Cmax均比其相应的ADC及总抗体的浓度低至少100倍,仅为不到10 ng/mL [DOI: 10.1080/19420862.2019.1699768]。这就意味着这类小分子基质样品的定量下限需要低至几百甚至几十pg/mL。生物基质样品中游离的小分子细胞毒性药物的提取,一般可采用蛋白沉淀(proteinprecipitation, PPT)、液-液萃取(liquid-liquidextraction, LLE)、固相萃取(solid phaseextraction, SPE)等小分子生物分析常用的前处理方法。在基质样品量有限、以及通过前处理进行浓缩的倍数仅能做有限调整的情况下,用于定量检测的仪器的灵敏度就至关重要。液相色谱-质谱联用技术(LC-MS/MS)由于具有高选择性和高灵敏度的特性,是分析检测生物基质样品中痕量游离小分子细胞毒性药物的首选方式。值得一提的是,LC-MS/MS并不仅限于游离的小分子细胞毒性药物的定量分析。当采用了合适的、具有针对性的样品前处理方法后,LC-MS/MS既可以用于定量生物样品中游离的细胞毒性药物,亦可同时对偶联在抗体上的小分子(antibody-bounddrug)进行定量分析;并且,在合适的免疫捕获及酶解或化学水解处理之后,还能根据特征肽段对包含抗体的大分子部分进行定量分析。例如,Pandey et al. [DOI: 10.1021/acs.analchem.9b04419]对血浆样品先进行蛋白沉淀并离心,之后分离上清(supernatant)和蛋白沉淀部分(protein layer)。上清在经过了吹干、复溶和过滤等操作后,所得样品溶液进行LC-MS/MS分析,即可获得非偶联小分子及其葡萄糖醛酸代谢产物的血浆浓度。与此同时,研究者对蛋白沉淀部分进行2小时、100℃的酸化水解处理,从而释放偶联在抗体上的小分子,之后新添加沉淀剂对水解样品进行提取,取其上清吹干、复溶和过滤之后,所得样品溶液亦使用LC-MS/MS定量分析,可得偶联小分子的血浆浓度。在另一篇文献中,Faria et al. [DOI: 10.3390/antib8010011]使用LBA或SPE进行样品前处理,从而可用LC-MS/MS分别测定人血浆中(1)ADC总量(用酶解所得的小分子总量表示)和相应的抗体总量(用酶解所得的特征肽段总量表示),(2)小分子去乙酰化的ADC总量以及相应的抗体总量(样品前处理方法同(1)),以及(3)非偶联的小分子及其去乙酰化产物。
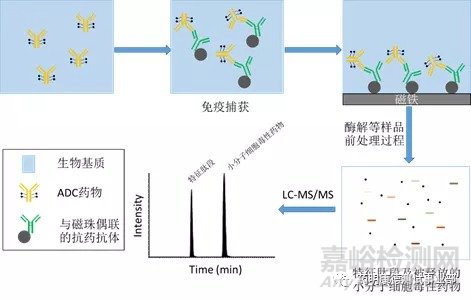
Fig. LBA-LC-MS/MS同时测定ADC总量和抗体总量示例
在药物研发过程中,生物分析对于大分子的药代动力学(PK)、药效动力学(PD)和安全性评价也是非常重要的,因此分为以下三个部分详述。
1. ADC 药代动力学(PK)的生物分析
药明康德大分子生物分析实验室采用ELISA平台来检测大分子药物药代动力学。主要方法是双抗夹心法ELISA,即用抗ID(idiotype)试剂来捕获抗体药物,用HRP标记的抗人IgG 或抗Fc抗体进行定量检测(显色信号值)。对于ADC药物的PK检测,我们实验室采用不同的捕获抗体和检测抗体组合,来分别检测ADC的不同组分(总抗体和抗体结合药物)。下图展示了常规大分子生物药和ADC药物的PK检测方法:
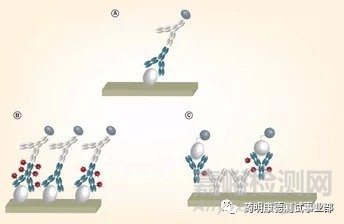
A. 常规ELISA方法:捕获试剂:抗ID(idiotype)试剂,检测试剂:标记的抗人IgG 或抗Fc抗体
B. 检测ADC总抗体:捕获试剂:抗ID(idiotype)试剂,检测试剂:标记的抗Fc抗体或者抗ID(idiotype)试剂
C. 检测ADC抗体药物复合物:捕获试剂:抗小分子药物抗体,检测试剂:标记的抗Fc抗体或者抗ID(idiotype)试剂。
ADC药代动力学PK检测的挑战:
1)与常规大分子抗体药物PK检测相比,ADC的PK ELISA检测难以获得特异性的捕获和检测试剂,多用到重组抗原、抗ID抗体或抗人IgG 抗体。但是即使采用了多种分析方法,ADC在体内的生物转化,仍会影响DAR的变化,进一步导致了不同PK采样时间点ADC混合物的动态变化。由于ADC混合物的动态变化,ELISA定量检测所用的参考标准品可能不能完全反映样品中的被检测物的水平。
2)ADC药物有其特殊性,比如ADC药物结构和工艺较为复杂,其连接分子类型、连接部位、抗体与小分子结合造成的聚合、裂解等都为ADC的药代动力学和毒理研究带来挑战。另外,不同的检测方法和试剂也会对结果带来预想外的结果。
近几年来,药明康德生物分析实验室开展了多项ADC检测服务项目。在实践工作过程中,我们积累了不少有益的经验。在为ADC项目制定生物分析策略时,我们首先对ADC的结构、体内转化产物等做尽可能充分的了解,研究每个ADC药物的具体特征和可能发生的聚合、裂解等,制定相应的策略来优化检测手段,例如采用对应于ADC的不同组分的捕获试剂和检测试剂,减少由于ADC药物聚合或裂解所导致影响检测结果的情况。
2. ADC的免疫原性抗药抗体(ADA)分析
和其他生物大分子药物一样,ADC在人体内也可能会导致免疫原性,产生相应的抗药抗体(ADA),造成对PK,PD和安全性影响。药明康德大分子生物分析实验室对ADA的分析方法主要是MSD平台的桥联(Bridging Assay)法。捕获试剂为Biotin标记的大分子药物,检测试剂为地高辛(DIG)或钌标记的大分子药物。
ADC的ADA分析流程与生物大分子药物的ADA分析相同,包括1)筛选阈值(screening cutpoint),2)确证阈值(confirmatorycut point),以及3)鉴定ADA滴度(Titer)。
1) 筛选阈值为筛选试验的响应水平,响应值高于该阈值的样品被认为是潜在阳性样品,响应值低于该阈值的样品为阴性样品。
2) 由于筛选阈值允许5%的假阳性率,以上筛选试验筛选出的潜在阳性样品有可能是非特异性的。因此需要检测药物的特异性,即从潜在阳性样品中鉴定出阳性样品。特异性确证试验通常是一个竞争性抑制试验,通过检测不加入和加入研究药物样品时的信号值变化来进行评估。
3) 对于高于确证阈值(阳性样本),需要鉴定ADA的效价。将阳性样本稀释成一系列浓度,当稀释后样品信号值大于或等于滴度阈值(titer cutpoint)时,此稀释倍数即为ADA的效价。
针对ADC上不同表位的产生的的ADA ,抗原表位可以是在抗体部分,偶联臂,或小分子药物部分,也可以是复合物。根据FDA对抗药抗体检测指南的说明,抗体-药物偶联物(ADC)是抗体与小分子药物偶联的复合物,它们代表了经典的半抗原载体分子。因此,免疫原性测定应分析对ADC治疗性蛋白质产品所有成分的反应,包括抗体,连接药物和可能由结合产生的新表位。所以针对ADC的ADA检测,需要开发能检测这一系列抗体的方法,并且需要不同的阳性抗体作为阳性对照(PC)。
目前对于不同表位的分析实验有两种方式来鉴别:1)竞争性方法:将样品和两种标记的ADC,与未标记的过量的ADC中的抗体孵育一段时间,如果未标记的抗体孵育后样品的响应水平的下降百分比高于方法验证中的阈值,则表明抗药抗体来自ADC中的抗体。将样品和两种标记的ADC与未标记的过量的连接臂-小分子药物同样的孵育,可以鉴别出来自于连接臂-小分子药物的抗体。2)检测方法:将样品和Biotin标记的ADC药物与钌标记的抗体孵育,如果钌标记的抗体孵育样品的响应高于方法验证中的筛选阈值,则表示ADA检测信号值是由抗体产生的,同样将样品和Biotin标记的ADC药物与钌标记的连接臂-小分子药物孵育,可以鉴别出来自于连接臂-小分子药物产生的抗体。
ADC分析项目,主要是采用竞争法来鉴别针对ADC药物上不同表位的ADA。在多个ADC药物抗药抗体分析的项目中,我们都成功开发出敏感度好的方法有效地鉴别出了是否有针对单抗和针对抗体药物复合物的抗药抗体ADA的存在。
3. ADC药物的中和抗体(Nab)分析
对于抗药抗体(ADA)阳性的样本,通常需要分析中和抗体(Nab)。中和抗体是抗药抗体中的一类抗体,能够通过直接与药物作用结合位点结合,或者通过空间位阻的作用,使药物失去与其靶点结合的能力,从而封闭、中和药物的治疗活性。中和抗体的产生通常与血药浓度降低,药效降低,副作用的出现有着很强的关联性,因此对机体在使用生物药后产生的中和抗体检测是免疫原性检测中关键的一个部分。
目前针对免疫原性分析的相关法规中推荐1)cell-basedanalysis: 使用基于细胞的体外功能性试验来进行中和抗体(Nab)的评价,或2)non-cell-basedanalysis: 对于某些生物药物根据其作用机理可以选择竞争性配体结合试验(LBA)来进行中和抗体(Nab)的评价。监管机构(FDA)更推荐使用cell-based,它更接近反映体内的真实情况,难点是需要找到合适的细胞系,更长时间的开发、优化和验证,变异大,基质效应明显,干扰大。在难以获得相关细胞系,或者基质干扰无法解决,cell assay 的信号弱等情况下,可以选择non-cell-basedanalysis,该方法简单,快速,而且更稳健,灵敏度更高(可能)。与ADA分析不同的是,Nab分析的阳性抗体需要有明显的中和活性(单抗和多抗都可以)。

来源:药明康德


