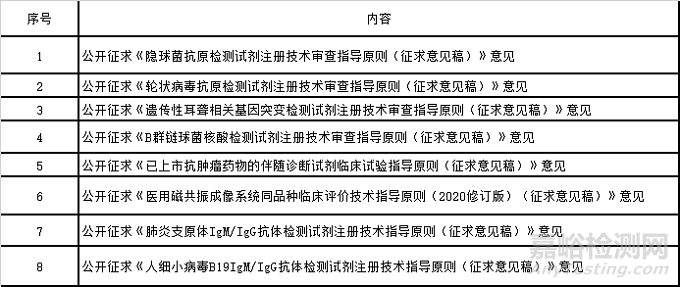
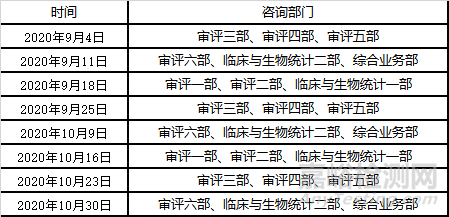
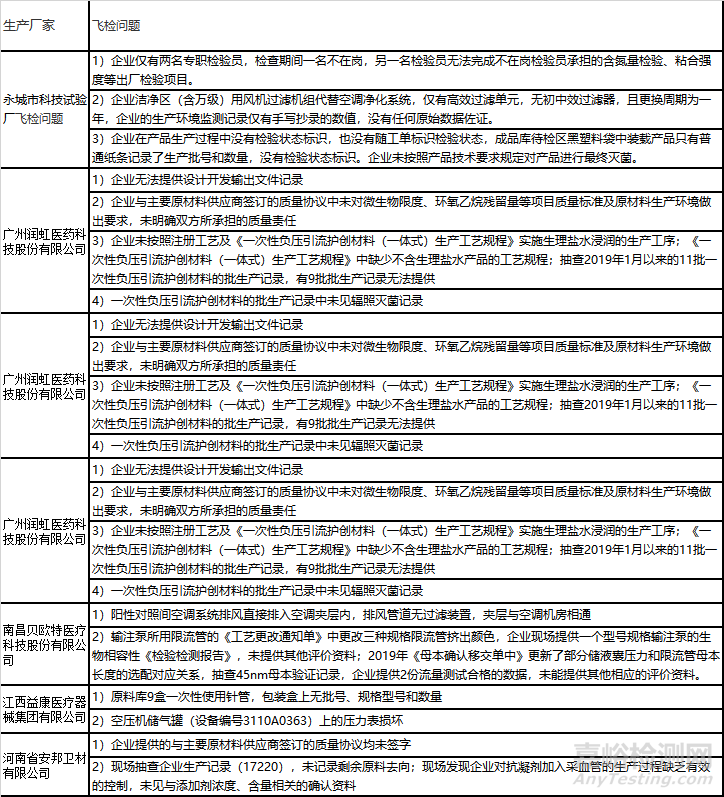
法规跟踪
1)审评中心8月共发布或技术指导原则(征求意见稿)8篇,详见以下信息:
标准信息
1)全国医用电器标准化技术委员会医用超声设备分技术委员会(SAC/TC10/SC)对以下三项行业标准征求意见:
1)超声经颅多普勒血流分析仪
2)医用超声耦合剂
3)超声仿组织体模的技术要求
2)中检院发布关于《医用普通摄影数字化X射线影像探测器》等9项标准征求意见的通知
1)射线血液辐照设备
2)医用动态数字化X射线影像探测器
3)医用普通摄影数字化X射线影像探测器
4)X射线计算机体层摄影设备的体型特异性剂量估算值(SSDE)计算方法
5)骨接合植入物 金属股骨颈固定钉
6)手术植入物 有源植入式医疗器械 第5部分:循环支持器械
7)手术植入物 有源植入式医疗器械 第3部分:植入式神经刺激器
8)外科植入物 运动医学植入物 缝线拉伸试验方法
9)外科植入物涂层 第3部分:贻贝粘蛋白涂层通用要求
3)江苏/上海/四川发布通知,2020年监督抽查项目开启,对“中签”的企业和产品进行临床试验监督检查
4)国家药监局召开医疗器械唯一标识系统试点工作推进会,对医疗器械唯一标识系统试点工作进展和成效做出总结,并研究部署下一阶段工作内容,具体内容如下:
摘要:
注册人/备案人实施唯一标识的流程
1)注册人/备案人按照《规则》和相关标准,结合企业实际情况选择发码机构。
2)注册人/备案人按照发码机构的标准创建产品标识,并确定该产品生产标识的组成。
3)《规则》10月1日正式实施,申请医疗器械注册、注册变更或者办理备案的,注册人/备案人应当在注册/备案管理系统中提交产品标识。
4)注册人/备案人根据发码机构标准选择适当的数据载体,对医疗器械最小销售单元和更高级别的包装或医疗器械产品上赋予医疗器械唯一标识数据载体。
5)注册人/备案人在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。
6)产品标识及数据相关信息变化时,注册人/备案人及时更新医疗器械唯一标识数据库。
工作动态
1)关于2020年9月~10月医疗器械注册受理前技术问题咨询工作安排
2)FDA推进环氧乙烷灭菌相关改革工作简述
摘要:
医疗器械的灭菌方法多种多样,包括湿热法、干热法、辐照法、环氧乙烷灭菌法等。环氧乙烷灭菌是器械制造商为保证医疗器械安全而广泛采用的一种方法。资料表明美国大约50%的无菌医疗器械采用环氧乙烷灭菌。对于一些产品来说,例如材质为特殊聚合物,含有多层包装、含有难灭菌组件的产品,环氧乙烷灭菌具有不可替代性。
大多数无菌医疗器械上市之前,美国食品药品监督管理局(FDA)会对提交的材料进行审查以评估灭菌相关资料是否符合FDA的法规和要求,以及是否符合FDA认可的国际标准。环氧乙烷灭菌相关的两个标准(ANSI AAMI ISO 11135和ANSI AAMI ISO 10993.7)阐述了如何开发、验证和控制灭菌过程,以及控制环氧乙烷相关残留物的可接受水平等内容。
原文链接:https://www.cmde.org.cn/CL0033/21508.html
3)骨科植入医疗器械产品的生物学评价资料应如何提交
摘要:
申请人应参照GB/T 16886.1的要求进行生物学评价。对于需进行生物学试验的,应提交相应的生物学试验报告,生物学试验应针对申报产品开展。若提交原材料的生物学试验报告,应论证从原材料到终产品的加工工序过程没有对产品引入新的生物学风险。关于生物学评价相关规定,请参考《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械[2007]345号)。
4)婴儿培养箱中皮肤温度探头配合使用的一次性固定粘贴片是否可以和主机作为同一注册单元申报
摘要:
次性固定粘贴片为无源耗材, 根据《医疗器械注册单元划分指导原则》要求:与有源医疗器械配合/组合使用的无源类耗材原则上与该有源医疗器械划分为不同的注册单元。
5)医疗器械不良事件检索方式及案例解析
摘要:
目前很多国家已建立了医疗器械不良事件监测系统,对于已收集到的不良事件也会定期公布,供公众检索。本文汇总了中国NMPA、美国FDA、英国MHRA、澳大利亚TGA、加拿大Health Canada、日本PMDA、德国BfArM等国家的医疗器械不良事件检索方式,并提供了对于已检索到的医疗器械不良事件进行汇总分析的方法,以期为行业内进行医疗器械不良事件监测的人员提供参考。
原文链接:https://www.cmde.org.cn/CL0033/21451.html
6)申请体外诊断设备注册变更时,什么情况下需要补充网络安全注册检验/委托检验
摘要:
依据《医疗器械网络安全注册技术审查指导原则》,注册申请人应在产品技术要求性能指标中明确数据接口、用户访问控制的要求。指导原则发布之前批准的产品如未体现该指标,在申请注册变更时若涉及网络安全内容,应在产品技术要求中补充网络安全的性能指标,并在有资质的检验机构对补充项目进行注册检验或委托检验,申报资料中应同时提交网络安全描述文档。
7)血液透析器产品的清除率试验条件应如何设计
摘要:
根据YY 0053规定,透析器产品的清除率试验中,血液和透析液流速应覆盖生产企业规定的范围。试验一般选择透析液流速的最低和最高点,分别对应企业规定的血液流速的最低流速,及每增加100ml/min的血液流速,直至企业规定的最高血液流速。
8)医疗器械设计和开发输入要求和应用浅析
摘要:
医疗器械是用于促进和保护公众健康的产品,安全性有效性直接关系到使用者的身体健康和生命安全,其设计和开发、生产管理、质量控制等过程具有专业性和特殊性。为保证医疗器械生产企业持续、稳定地提供符合临床需求和质量合格的产品,产品研制、生产相关过程需要在质量管理体系控制下有效运行。质量源于设计,设计和开发过程在监管法规和质量管理体系标准中均作为产品实现重要环节进行了要求,输入为产品的设计和开发提供了基础和依据,决定了产品结构组成、生产工艺、性能评价体系等内容的输出,设计和开发输入不仅影响产品研制和生产,在产品全生命周期管理和推动产业高质量发展中同样具有重要作用。本文结合医疗器械设计和开发输入相关标准和法规要求,对设计和开发输入在医疗器械产品性能评价中的应用进行探讨。
原文链接:https://www.cmde.org.cn/CL0033/21443.html
9)软性亲水接触镜为离子型或非离子型,应提交哪些资料
摘要:如制造商宣称软性亲水接触镜为离子/非离子型,应依据GB/T 11417.1-2012中给出的离子型、非离子型的定义进行判定。首先需明确产品配方中各单体的性质,如离子型、非离子型等,其次计算离子型单体的含量(用摩尔分数表示),最后依据GB/T 11417.1-2012的相关要求做出结论,并在产品技术要求附录中明确软性亲水接触镜为离子型或非离子型。
10)体外诊断试剂临床试验中对比结果不一致的样本,其确认结果能否纳入一致性统计
摘要:体外诊断试剂临床试验过程中,为了控制试验偏倚,针对考核试剂与对比试剂的一致性统计分析,应采用样本揭盲前的检测结果。针对不一致样本的复测结果或第三方确认结果,如在临床试验揭盲以后纳入统计分析会引入偏倚,因此,不建议将此部分结果纳入统计分析。但考核试剂复测结果和第三方复核试剂检测结果可结合该样本对应病例的临床诊断信息,用于进一步分析考核试剂与对比试剂检测结果不一致的原因。
11)通过戊二醛浸泡进行消毒、灭菌的医疗器械,其残留毒性如何评价
摘要:
关于戊二醛残留的限值和残留的测试目前没有公认的标准和方法,根据GB/T 16886.1-2011中4.3b)规定,总体生物学评价应考虑预期的添加剂、工艺污染物和残留物,如果对生物学试验的医疗器械样品按照制造商规定的方法进行了戊二醛消毒、灭菌,且符合生物相容性要求,则认为其残留毒性是可接受的。
12)上海药监局发布了《上海市第二类创新医疗器械特别审查申报资料编写指南(试行)》的通告
摘要:
海药监局发布了《上海市第二类创新医疗器械特别审查申报资料编写指南(试行)》的通告,对申报资料内容、申报资料格式及其他申报资料相关要求作出具体规定,具体内容如下:
申报资料内容目录
(一)第二类创新医疗器械特别审查申请表
(二)申请人资质证明文件
(三)产品管理类别
(四)概述
(五)产品知识产权情况及证明文件
(六)产品研发过程及结果综述
(七)产品技术文件,至少应当包括:
(八)产品创新的证明性文件
(九)产品风险分析资料
(十)产品说明书(样稿)
(十一)其他证明产品符合《上海市第二类创新医疗器械特别审查程序》第三条的资料
(十二) 所提交资料真实性的自我保证声明
质量公告
1)8月份产品召回信息
2)飞行检查情况的通告
产品信息
1)国家药监局关于批准注册102个医疗器械产品公告
2020年7月,国家药品监督管理局共批准注册医疗器械产品102个。其中,境内第三类医疗器械产品73个,进口第三类医疗器械产品11个,进口第二类医疗器械产品17个,港澳台医疗器械产品1个。
经过查询,上海欣吉特生物科技有限公司的牛心包人工心脏瓣膜(外科瓣)已批准注册。
2)创新医疗器械特别审查申请审查结果公示
8月审评中心共发布创新审查结果2批,涉及5个产品。
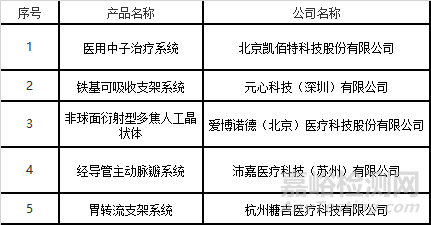
3)临床试验默式许可
4)医疗器械优先审批申请审核结果公示