您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-22 09:36
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
诺华将启动羟氯喹治疗COVID-19 III期临床试验。4月20日,诺华宣布将在美国启动羟氯喹治疗COVID-19的大型III期临床试验。该研究拟招募440例COVID-19住院患者,患者在标准护理的背景上分别接受羟氯喹、羟氯喹+阿奇霉素或安慰剂的治疗。这项临床试验是对之前诺华承诺在羟氯喹证明对COVID-19有效后将捐赠1.3亿片的补充。另外,诺华表示,如果羟氯喹被批准用于COVID-19的治疗,诺华将提供其知识产权以支持该药的广泛使用。
1. 国产新冠疫苗PiCoVacc动物试验数据公开。4月19日,中国医学科学院在BioRxiv上公开一款在研COVID-19灭活疫苗PiCoVacc的动物试验数据。恒河猴接种3ug、6ug剂量PiCoVacc进行免疫,模拟人的接种情况。在接种7天后,恒河猴体内产生高滴度(10e3)的中和性抗体。攻毒后,3ug和6ug两个接种组均可将肺组织中病毒载量控制到基线以下,6ug接种组可将直肠中病毒载量控制到检测临界值(基线)以下。而且两个剂量接种组的恒河猴均无ADE(抗体依赖增强,Antibody-Dependent Enhancement)效应,也没有造成T细胞激活和细胞因子释放。
2. 华北制药奥拉西坦片即将获批。华北制药3类仿制药奥拉西坦片的上市申请审评状态已变更为"在审批",预计近期获批上市。奥拉西坦(oxiracetam)属于脑代谢改善剂,适用于轻中度血管性痴呆、老年性痴呆以及脑外伤等引起的记忆与智能障碍。该药原料药由意大利史克比切姆公司开发,其胶囊剂(健郎星)、注射剂(倍清星)已获批进口中国。据悉,目前全球范围内只有亚洲有奥拉西坦销售。根据PDB数据,2019年全国样本医院奥拉西坦销售额为12.80亿元。
3. 再鼎医药尼拉帕利补充新药申请获优先审评资格。再鼎医药宣布,国家药监局已授予则乐®(尼拉帕利)的补充新药申请优先审评资格,用于对一线含铂化疗完全或部分缓解的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者的维持治疗。则乐®是一种高效、选择性的每日一次口服小分子聚(ADP-核糖)PARP 1/2抑制剂,已于2019年12月获国家药监局批准用于维持治疗复发性卵管癌患者。
4. 百济神州PD-1新适应症上市申请获受理。百济神州宣布CDE已受理其PD-1抗体百泽安®(替雷利珠单抗注射液)联合两项化疗方案用于一线治疗晚期鳞状非小细胞肺癌(NSCLC)的新适应症上市申请。在一项Ⅲ期临床中,患者接受百泽安®联合紫杉醇与卡铂、百泽安®联合白蛋白紫杉醇(ABRAXANE®)与卡铂,或紫杉醇与卡铂的治疗,经IRC评估,百泽安®联合化疗均显著提高患者的PFS,达主要终点。两组百泽安®治疗组的安全性数据与各组已知风险相符,未出现新的安全警示。详细数据将于学术会议上公布。
5. 基石药业PD-L1抗体获批一项新临床。基石药业PD-L1抗体CS1001获CDE批准一项新的临床试验,适应症为联合甲苯磺酸多纳非尼用于晚期实体瘤的治疗。CS1001是基石药业产品管线中的核心产品,基石药业正在探索CS1001单药以及联合其它药物的治疗潜力,CS1001有望于今年下半年在中国提交新药上市申请。多纳非尼是泽璟制药开发的一款多靶点、多激酶抑制剂类小分子抗肿瘤药物。
6. 恒瑞与CG达成合作许可协议。恒瑞医药与韩国Crystal Genomics公司(CG公司)就其PD-1注射用卡瑞利珠单抗达成合作协议。根据协议,CG公司获得卡瑞利珠单抗用于所有人类疾病在韩国独家开发和商业化权益;恒瑞将获150万美元的首付款,可能不超过150万美元的研发里程碑款,以及累计不超过8425万美元的产品年销售程碑款和销售提成(10%-12%)。CG公司将承担卡瑞利珠单抗在韩国境内的临床开发费用(包括恒瑞正在进行的国际多中心研究)。
7. 艾力斯医药科创板IPO申请获受理。艾力斯医药科创板上市申请获上海证券交易所受理,拟募集资金15.03亿元,用于推进研发项目的临床开发。艾力斯创立于2004年3月,专注于肿瘤小分子靶向创新药研发,目前已有2款已上市药品(兰索拉唑肠溶胶囊、阿利沙坦酯(信立坦)),以及围绕非小细胞肺癌驱动基因靶点构建的10余个在研项目(其甲磺酸艾氟替尼临床进展最快)。此外,艾力斯针对KRASG12C、RET、EGFR20外显子插入突变、c-MET等靶点的新药项目尚处于临床前研究阶段,该公司计划于2021年~2022年间陆续提交新药临床申请。
1. Alexion启动补体C5抗体治疗COVID-19的III期研究。Alexion公司宣布启动一项全球III期研究,评估其补体C5单抗Ultomiris(ravulizumab-cwvz)治疗因为严重肺炎或急性呼吸窘迫综合征住院的重症成人COVID-19患者的疗效。该研究拟招募270例患者,按照2:1随机分组,分别接受Ultomiris和最佳支持治疗,研究的主要终点是29天存活率,次要终点包括机械通气时间、吸氧治疗时间、ICU停留时间、住院时间、安全性等。
2. PD-1组合疗法肾细胞癌III期试验达终点。4月20日,百时美施贵宝和Exelixis公司联合宣布,其PD-1抑制剂Opdivo(nivolumab)联合酪氨酸激酶抑制剂Cabometyx(cabozantinib)相比舒尼替尼(sunitinib),在治疗晚期或转移性肾细胞癌初治患者的关键性Ⅲ期试验CheckMate-9ER中,达到了无进展生存期的主要研究终点,以及总生存期和客观缓解率的次要研究终点。详细数据将在未来的科学会议上公布。
3. 创新食欲素受体拮抗剂关键性III期临床结果积极。Idorsia公司双重食欲素受体拮抗剂daridorexant在治疗失眠成人患者(39.1%≥65岁)的首项关键性III期临床中获积极顶线结果。25 mg和50 mg daridorexant均显著改善睡眠起始和睡眠维持参数。Daridorexant还显著改善主观总睡眠时间(根据患者每天在家记录的日记)。在接受治疗后第1个月和第3个月,结果始终具有一致的统计学显著性差异;daridorexant治疗改善了患者的日间表现。
4. 精神分裂症突破性药物SEP-363856关键性研究成功。住友制药旗下Sunovion公司评估TAAR1激动剂SEP-363856治疗精神分裂症的4周关键研究SEP361-201成果发表于《新英格兰医学杂志》上。结果显示,与安慰剂组相比,SEP-363856每日一次弹性剂量(50-75mg)治疗组阳性和阴性症状量表(PANSS)总评分(-17.2 vs -9.7;p=0.001)有统计学意义的改善;SEP-363856治疗组在严重程度量表(CGI-S)也表现出改善(p<0.001)。临床中,SEP-363856的耐受性良好,SEP-363856组和安慰剂组的总停药率具有可比性。两组的锥体外系症状发生率以及血脂、糖化血红蛋白和催乳素水平的变化相似。
1. 湖北累计采集43万毫升康复者血浆。湖北省新型冠状病毒肺炎疫情防控指挥部在例行新闻发布会上介绍,自疫情发生后,湖北省积极开展新冠肺炎患者血液核酸检测,努力推进康复者恢复期血浆采集和治疗工作。目前,湖北累计采集1627人次新冠肺炎康复者血液,累计向临床提供红细胞21.4万单位、血小板1.1万个治疗量,为600例名重症患者提供43万毫升血浆,并为科研单位的疫苗研制提供了有力保障。
2. 世卫组织专家:无证据表明有抗体可免疫。在4月17日的世卫组织每日新闻发布会上,WHO新冠病毒疾病(COVID-19)技术负责人Maria van Kerkhove博士表示,尚无证据表明抗体检测可显示个体已免疫或可免于再次感染。目前,世卫组织正在开展一项名为“SOLIDARITY II”全球抗体检测研究。全球科学家们也正努力通过实验,并在现实环境中追踪康复患者是否二次感染,来了解感染康复能带来什么样的保护效应。
3. 复旦肿瘤医院患者5年总生存率与欧美相当。4月16日,复旦大学附属肿瘤医院发布一份恶性肿瘤患者的10年随访生存报告。该报告分析了在该院确诊并住院治疗的20余万例恶性肿瘤患者的整体生存情况,显示2008年~2017年患者的3年和5年总生存率分别为77.4%和71%,与欧美顶级肿瘤中心治疗的恶性肿瘤患者相当。其中在该医院首诊乳腺癌患者5年总生存率达90%以上。据悉,这是国内首个病例超过20万的单中心、大规模、多病种的恶性肿瘤长期随访生存报告。
4. 知识产权局推出4项涉及制药的保护政策。国家知识产权局推出2020—2021年贯彻落实《关于强化知识产权保护的意见》推进计划。该计划包含八大部分133项目内容,其中涉及制药的4个项目内容为:8.建立药品专利纠纷早期解决机制 (10月底前完成) 、13.推动出台中医药传统知识保护条例(持续推进)、41.建立按年度公开发布假冒药品执法相关数据的制度(7月底前完成)、50.开展打击假冒药品执法行动,从重打击假冒药品和生物制品等相关产品。加强执法国际合作,与相关国家交换相应执法信息 (持续推进) 。
【易明医药】全资子公司四川维奥制药于近日获得国家药品监督管理局核准签发的化学药品“米格列醇片(50mg)”的《药品补充申请批件》,通过该品种仿制药质量和疗效一致性评价。
【国药一致】2019年度实现营收520.46亿元(+20.69%);归母净利润12.71亿元(+5.00%);扣非归母净利润12.27亿元(+4.32%)。Wind一致增速-年报-Q4增速为5.00%-5.00%-8.94%,扣非为5.00%-4.32% -4.94%。公司计划于5月15日召开股东大会。
【泰格医药】公司近日与鸿运华宁生物医药签署了《战略合作协议》,双方将本着优势互补、精诚合作的原则,在创新医药产品的临床研究和开发过程中进行全方位长期合作,实现互利共赢。
1. CDE最新受理情况(4月21日)
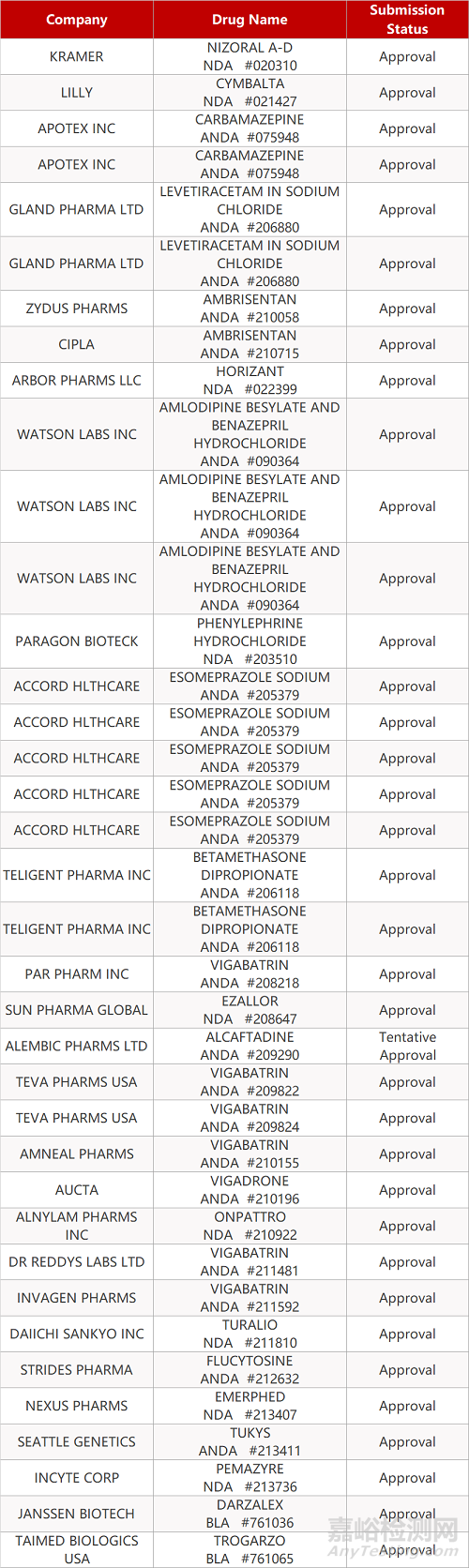
2. FDA最新获批情况(北美4月20日)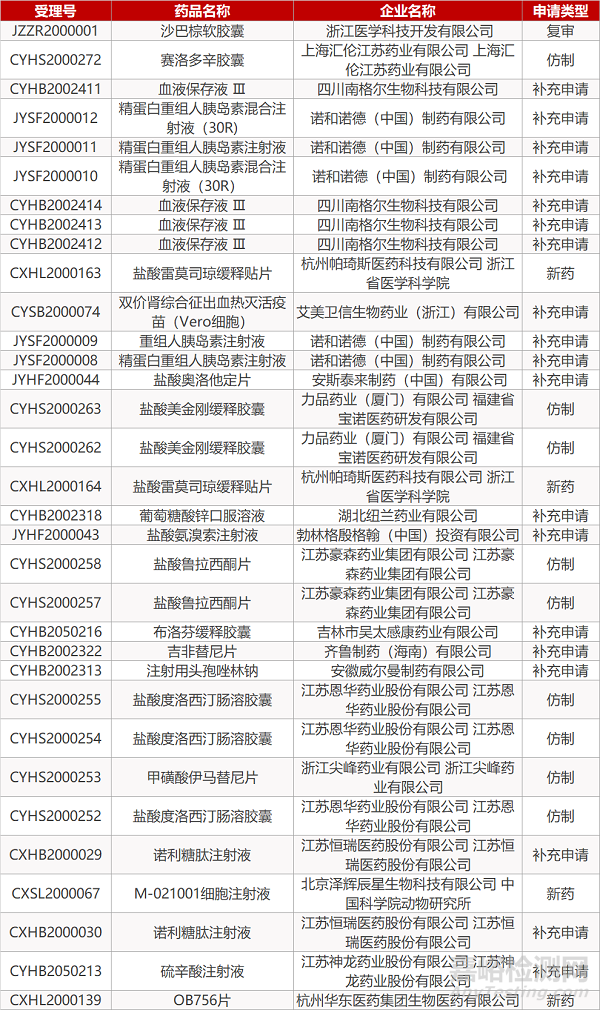
- The End -

来源:药研发


