您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-27 10:30
医疗器械生物学评价的意义
医疗器械生物相容性的主要内容
根据国际标准化组织(International Standards Organization,ISO)会议的解释,
医疗器械生物学评价的意义
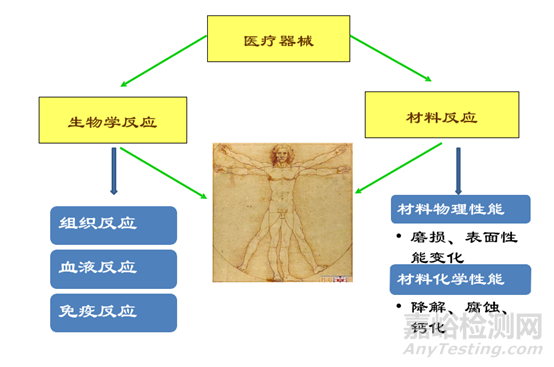
医疗器械生物相容性评价的重要性
与人体接触或植入体内的医疗器械其风险性较大,需 要进行生物学评价。医疗器械与人体接触或植入体内后对 宿主人体的影响是一个非常复杂的过程,主要发生三种反应:
生物学反应导致的临床结果
皮内刺激 — 局部组织发生炎症反应,皮下部位红肿、疼痛、瘙痒、水泡、溃烂及色素沉积等
遗传毒性 — 在致突变物作用下,生物体的染色体数目及结构 变化,可能引起某种遗传病症或健康缺陷。
生殖毒性 — 某些物质对雌性和雄性生殖系统,从生殖细胞 形成到胚胎细胞发育各过程所致的损害,影响繁殖能力,甚 至累及后代。
血栓栓塞 — 导致血管腔闭塞,形成心梗、脑梗、肺动脉栓塞等疾病。
肿瘤 — 长期植入后的慢性炎症反应存在引发肿瘤的风险
医疗器械生物学评价相关规章及标准
国家食品药品监督管理总局 2014年第43号《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》
《医疗器械生物学评价和审查指南》(国食药监械[2007]345号)
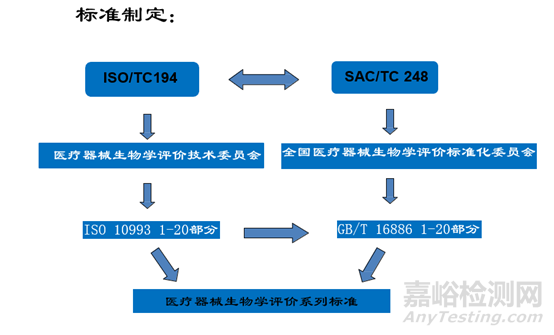
医疗器械生物学评价标准的目的
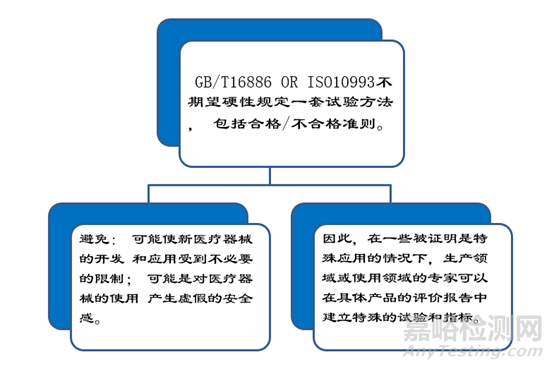
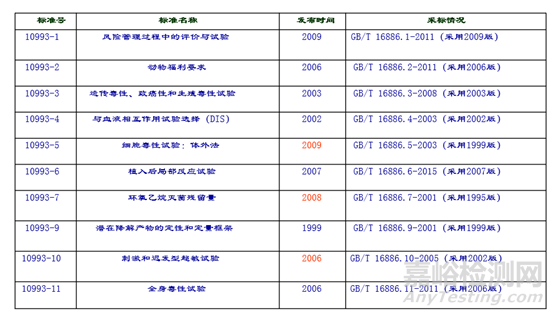
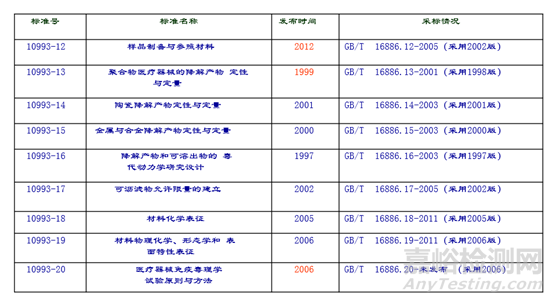
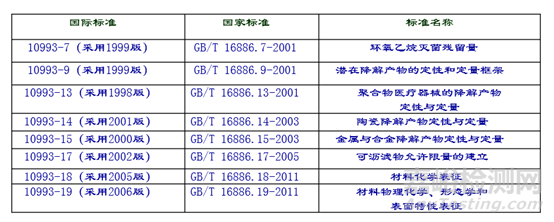
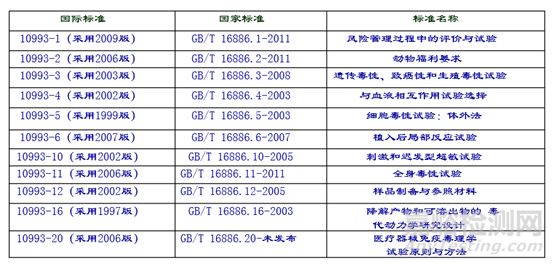
ISO 10993与GB/T 16886系列标准对应情况
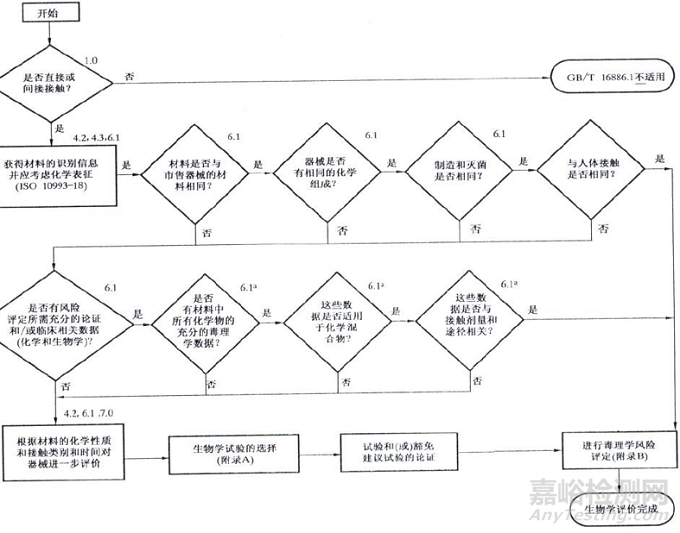
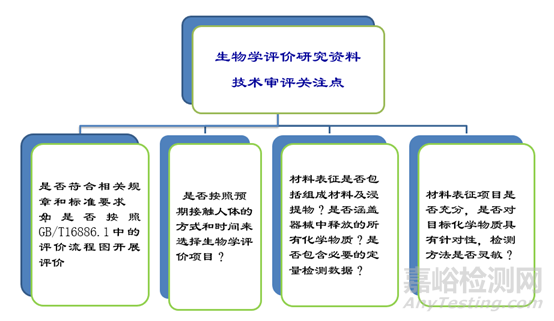
医疗器械生物学评价研究资料
1.生物相容性评价的依据和方法
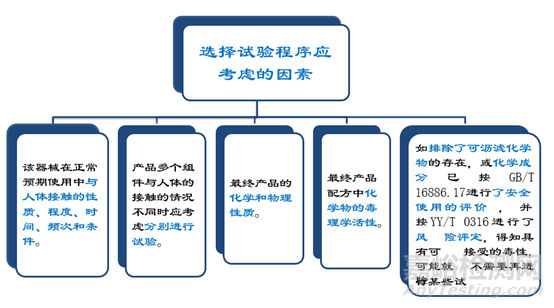
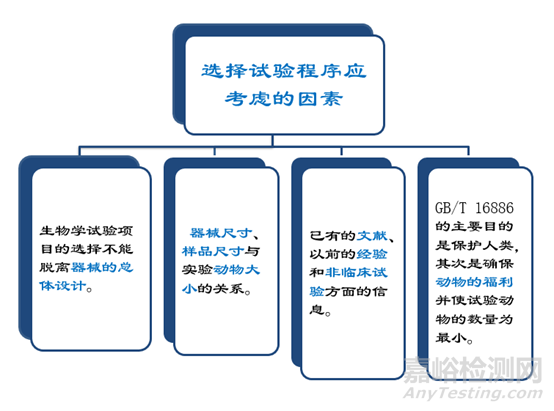
预期用于人体的任何材料或器械的选择和 评价应按YY/T 0316《医疗器械 风险管理 对医疗器械的应用》(ISO14971)开展风 险管理过程中的生物学评价。(见GB/T 16886.1:2011附录B)。医疗器械生物学评价程序应当按GB/T 16886.1-ISO 10993.1给出的评价流程图 开展。由于医疗器械的多样性和特殊性, 各医疗器械在按流程图进行生物学评价时, 实际产品在流程图中所走的路线是不一致的,应当对所走的路线予以详细说明。
作为风险管理组成部分的医疗器械生物学评价的系统方法框图
2.产品所用材料的描述及与人体接触的性质
产品各部件使用材料的标准化学名称。
产品预期与人体的接触分类,包括表面器械、外
部接入器械、植入器械。
产品与人体接触的组织类型,包括接触的组织类 型(损伤表面、循环血液、肌肉、骨、皮下、粘 膜等)
接触频次(频繁更换)。
产品预期与人体接触的最长时间(短期、长期、 持久)。
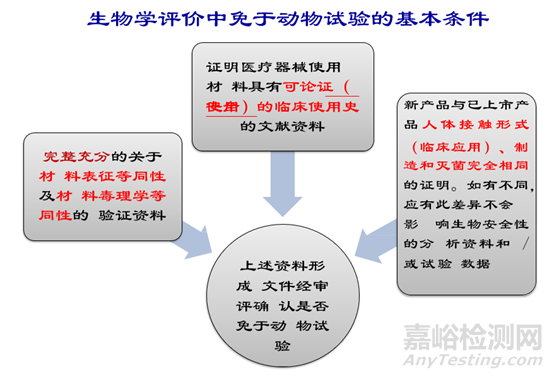
3.实施或豁免生物学试验的理由和论证
评价包括有关临床前和临床经验研究和实 际试验。如果医疗器械的材料及加工过程在具 体应用中具有可论证的使用史,可能不必再进 行生物学试验。
由于医疗器械的多样性, 对任何一种医疗 器械而言,GB/T16886.1-ISO 10993.1表1和表 2中推荐的试验并非都是必须的或可行的,应当根据医疗器械的具体情况考虑应做的试验,表 中未提到的其他试验也可能是必须做的。
生物相容性评价研究报告中应当对所考虑 的试验、选择和/或放弃试验的理由进行论证。资料性数据和材料的历史试验数据都可以作为不再进行生物学试验的理由,但要附这些数据。
4.对于现有数据或试验结果的评价
医疗器械材料表征数据及评估
1.材料的化学表征
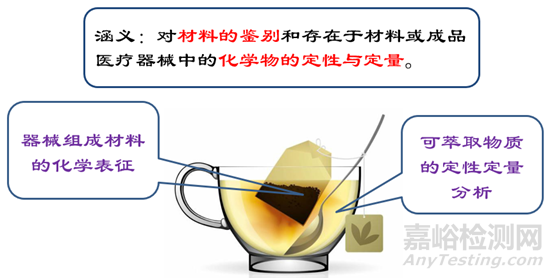
对制造用材料进行化学表征是生物学安全性评价首要 步骤,在进行任何生物学试验之前鉴别材料化学成分 并考虑其化学表征(详见GB/T16886.18)。对医疗器 械所选材料的配方和/或来源给予详细的说明。
建议参照GB/T 16886.18进行材料化学表征并提供材料表征信息,如描述提供所有组成材料的材料化学名 称、分子量和/或分子量分布、化学结构、加工助剂、 加工残留物及可能存在的杂质、各组分的比例及材料总量、已在中国境内上市的同类材料医疗器械等信息。
可从以下方面获取材料的相关信息:1)公认的材料化学名称;2)材料理化特性信息;3)从材料的供应方获取材料的成分信息;4)从医疗器械的加工方获取加工助剂的成分信息;5)化学分析;6)有关标准。
以下情况可能需要开展更深入复杂的化学表征 及数据评价:1)使用的材料缺乏长期的临床使用史;2)生物学试验出现了非预期结果;3)器械的材料应用到人体后将出现变化(如原位聚合或可吸收材料);4)含有已知毒性材料的医疗器械;5)材料成分或生产过程中使用了新的化学物质;6)由新材料制成的医疗器械。
报告应说明进行化学表征的目的,适宜时包括 下列信息:1)材料详细描述;2)分析方法和浸提条件;3)得出的定性数据;4)得出的定量数据;5)化学物临床接触评定。
2. 影响生物相容性的材料物理特性表征
当医疗器械材料的物理特性(包括但不限 于:多孔性、颗粒大小、形状和表面形态)对 于生物相容性产生影响时,这部分的数据也应 被收集并进行评估。
3. 医疗器械/材料与市售产品的等同性比较
目的:期望证明该产品与上市产品具有相同的生 物学安全性,从而为确定该产品的生物学评价和
/或试验是否可以简化或免除。
产品的等同性比较主要涵盖以下方面的比较:1)比较材料和产品的用途是否等同,若注册产品与市售产品具有等同性,就表明注册产品具有最基本的生物安全保证。2)比较两者的生产过程(加工过程、灭菌过程、包装等)是 否相同,因为生产过程也可能会引入新的有害物质(灭菌剂、加工助剂、脱模剂等残留物)。3)比较产品物理特性(多孔性、颗粒大小、形状与表面形态) 对于生物相容性的影响。
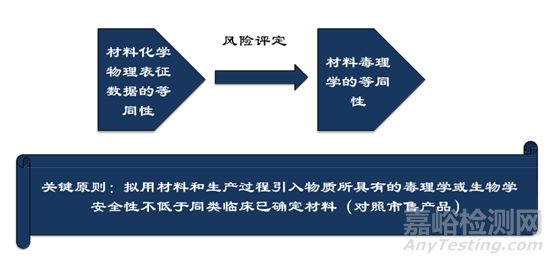
GB/T16886.18 附录C 判定毒理学等同性的原则:
1)拟用材料的成分和可溶出物与临床已确立材料等同;
2)拟用材料与现行标准规定材料的一致性及拟用材料符合现行标准中规定的用途、接触时间和程度;
3)拟用材料具有比其拟用接触方式更高接触程度的临床应用史;
4)拟用材料的可溶出物限量不超过GB/T 16886.17-ISO10993.17规定的允许极限;
5)拟用材料中含有的化学物质或残留物比其拟取代的临床已确立材料更具毒理学安全性(假定接触相似);
6)拟用材料中含有的化学物质或残留物与其拟取代的临床已确立材料具有相同的毒理学安全性(假定接触相似);
7)拟用材料与临床已确立材料的可溶出物成分种类和数量不变,唯一 区别是前者中的添加剂、污染物或残留物已经去除或比后者有所减少;
8)拟用材料与临床已确立材料的可溶出物相对量没有增加, 唯一区别 是前者使用了比后者更能降低可溶出物水平的加工条件。
非动物试验评价可参考标准:
国内外相关文献的检索与评审
医疗器械生物学评价的资料检索是提高 评价质量的重要前提,应保证相关生物学文 件检索的质量及数量。资料检索和文献评价 建议由具有理论知识和实验经验的生物学专家进行。文献评审是一种严谨和客观进行的 科学行为,宜能经受第三方验证。
建议按照GB/T 16886.1 附录C建议的文 献评审程序,提供详细的文献评审方案及文献评审报告。
已经开展过的生物学试验报告 和新开展的生物学试验报告
生物学试验应当委托具有医疗器械检验 资质认定、在其承检范围之内的生物学实验 室按照相关标准进行试验。国外实验室出具 的生物学试验报告,应附有国外实验室表明其符合GLP实验室要求的质量保证文件。试 验机构应按GB/T 16886-ISO 10993系列标 准规定进行试验并出具报告。
临床使用信息和/或临床研究 结论
鉴于材料在动物体内出现组织反应时,在人体内不一定出 现同样的反应,且对于通过生物学试验已证实是最好的材料, 由于人体间的差异,也会在某些人身上产生不良反应。因此,在医疗器械已经有临床评价数据的情况下,应当充分利用已获 取的临床信息进行评价。
医疗器械临床数据主要来自于:1.国内外相关该医疗器械/材料的临床研究报道;2.该医疗器械在上市前开展的医疗器械临床研究;3.该医疗器械上市后从临床中获取的数据,包括医疗器械不
良事件的报道和报告。
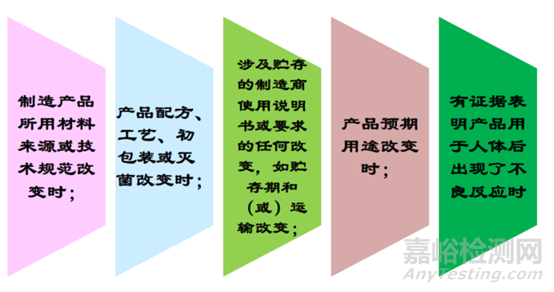
需考虑重新进行生物学评价的情形
下列任一情况下,应重新进行生物学评价,重新评价时应当尽量利用临床评价信息、临床研究信息 以及临床不良事件信息来进行。重新评价应当在以往评价所 形成文件的基础上开展,以避免重复不必要的生物学试验。视具体情况,重新评价可以是全面的,也可以针对某一方面。评价内容应当形成文件。
生物学评价研究资料技术审评关注点
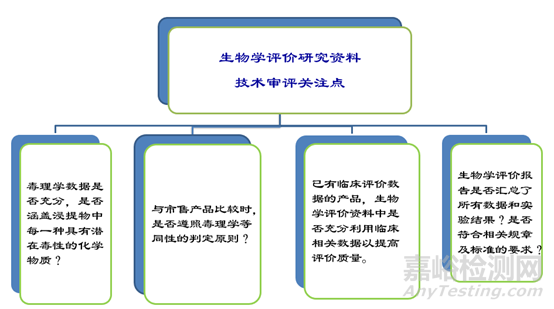
*医疗器械生物学试验
生物学可参考标准
选择试验程序应考虑的因素
细胞毒性试验
试验目的:评价医疗器械引起细胞毒性反应的潜在可能性,测定由器械、材料和(或)其浸提液引起的细胞溶解(细胞死亡)、细胞生长抑制、克 隆形成和细胞方面的其他影响。
试验方法:浸提液试验 直接接触试验 间接接触试验(琼脂扩散试验、滤膜扩散试验);推荐使用直接接触法、浸提液法用于终产品细胞毒性的评价。
描述举例:浸提液试验:无细胞毒性。在生物学评价报告中应明确体外细胞毒性试验的具体试验方法和判定指标。
迟发型超敏反应试验
试验目的:用一种适宜的动物模型评估器械、材料和(或)其浸提液潜在的接触过敏反应。
试验方法:豚鼠最大剂量试验、封闭贴敷试验、局部淋 巴结试验。
描述参考:应无迟发型超敏反应。
刺激试验(包括皮内反应性)
试验目的:在一种适宜模型的相应部位(如皮肤、眼和粘 膜)上测定医疗器械、材料和(或)其浸提液的潜在刺激作用。
试验方法:试验的进行应与使用或接触的途径(皮肤、皮内、 眼、口腔、阴茎、直肠、阴道)和时间相适应。
皮内反应试验
评价组织对医疗器械浸提 液或原液(液体类器械)的 局部反应。
皮内反应试验还可用于不适宜于用皮肤或粘膜试验测定 刺激的医疗器械 (如植入或 与血液接触的医疗器械)。
皮内反应试验也适用于疏水性浸提液。
描述参考:试 验 样 品 与 溶 剂 对 照 平 均 记 分 之 差 不 大 于 1.0。
动物皮肤刺激试验
采用相关动物模 型对材料在试验 条件下产生皮肤 刺激反应的潜在 性做出评价。
描述参考:刺激反应平均记分 0-0.4,反应类型为极轻微反应。
口腔刺激试验
口腔刺激试验只有 在用其他方法不能 得到安全性数据的情况下才考虑进行。并且仅适用于预期 与口腔组织接触的材料。
试验目的:对材料在试验条件下产 生口腔组织刺激反 应的潜在性做出评价。
描述 参考 :刺激 指数平均记分0,反 应 程度 应为 无反应 ,刺 激指 数平均记分1-4,反 应 程度 应为 极轻反应 。
阴道刺激试验
阴道刺激试验只有在用其他方法不 能得到安全性数据 的情况下才考虑进 行。并且仅适用于预 期与阴道组织接触的材料。
试验目的:对材 料在试验条件下产 生阴道组织刺激反 应的潜在性做出评价。
描述 参考 :刺激 指数平均记分0,反 应 程度 应为 无反应 ,刺 激指 数平均记分1-4,反 应 程度 应为 极轻反应。
直肠刺激试验
直 肠 刺 激 试 验 只 有 在 用 其 他 方 法 不 能 得 到 安 全 性 数 据 的 情 况 下 才 考 虑 进行。并 且 仅 适 用 于预期 与 直 肠 组 织 接 触的材料。
试验目的:对材料在试验条件 下产生直肠组织刺激反应的潜在性做出评价
描述参考:刺 激 指数 平均 记分0 ,反 应程 度应 为 无反 应 , 刺激 指 数平 均记 分1-4, 反应 程度应为极轻反应。
眼刺激试验
眼刺激试验只 有 在 用 其 他 方 法 不 能 得 到 安 全 性 数 据 的 情 况 下 才 考 虑进行。并 且 仅 适 用 于 预 期 与 眼 或 眼 睑 接 触的 材料。
试验目的:对材料在试验条件下产生 眼刺激反应的 潜在性做出评价。
试验方法:急性接触,多次接触 。
描述参考:任何观察阶段呈现阳性反应 的动物数应在半数以下 。
急性全身毒性反应:
试验目的:评估在一个动物模型中24h内一次或多次接触医疗器械、材 料和(或)其浸提液的潜在危害作用。
描述参考:供试品应无急性全身毒性反应。
亚急性或亚慢性毒性试验
试验目的:亚急性毒性观察每日将试验样品以一次或多次给予后在14-28日内引起的不良作用,亚急静脉研究一般规定接触时间>24h,<14天,其他途径一般为28d。
试验目的:亚慢性毒性为每日将试验样品以一次或多次给予后,在寿命期的一段时间内(一般是90日,但不超过寿命期的10%)引起的不良作用。啮齿类动物亚慢研究一般为90天,亚慢静脉研究一般为 14~28天。
如可行,可将亚急性和亚慢性全身毒性试验方案扩展为包括植入试验方案,来评价亚急性、亚慢性全身和局部作用。
对于亚急、亚慢性毒性试验,接触途径、接触剂量的选择应具有临床相关性。
描述参考:产品应无临床(局部和全身)毒性症状;与对照组比较, 肉眼和显微观察,应无明显病理改变;试验组和对照组之间体重、 器官重量、血液学、临床化学等指标应无明显的毒性反应。
慢性毒性试验
试验目的:慢性全身毒性为在动物的主要寿命期内反复或持续接触试验样品后发生的不良作用。慢毒研究一般为6~12月。大鼠一般为6个月。
这些试验应与器械或材料的作用或接触途径和时间相适应。
描述参考:产品应无临床(局部和全身)毒性症状;与对照组比较,肉 眼和显微观察,应无明显病理改变;试验组和对照组之间体重、器官 重量、血液学、临床化学等指标应无明显的毒性反应。
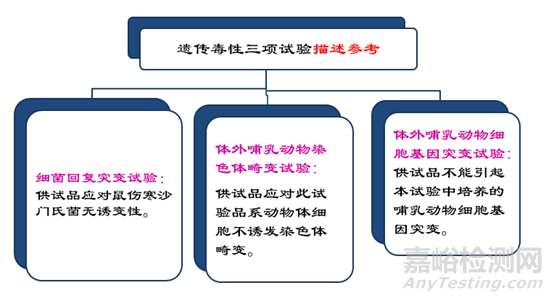
遗传毒性试验
试验目的:使用哺乳动物或非哺乳动物细胞培养或其他技术来测定由医疗器械、材料和(或)其浸提液引起的基因突变、 染色体结构和数量的改变,以及其他DNA或基因毒性。
实验策略:优先体外试验,方案1:细菌基因突变试验、哺乳 动物细胞基因突变试验、哺乳动物细胞诱导性试验.方案2:细菌基因突变试验、哺乳动物细胞基因突变试验(覆盖诱裂 性和基因突变)。
实验策略:如果体外试验出现阳性,应进行体内诱变性试验。常用体内试验包括啮齿动物微核试验、啮齿动物骨髓中期分析、 哺乳动物肝细胞程序外DNA合成试验。
植入实验
试验目的:在肉眼及显微镜水平上评价材料植入活体组织内导致的局部组织反应。对于可降解材料,也可用于确定可降解材料的 降解特性。
试验方法:肌肉植入、皮下组织植入、骨植入。
描述参考:比较不同时间内试验材料和对照材料的生物学反应
(肉眼观察和组织病理学反应分级),包括纤维化/纤维囊腔和炎 症程度、组织形态学改变而确定的变形、材料/组织界面炎性细胞类型等。可降解材料还需明确各观察时点材料的降解特性。

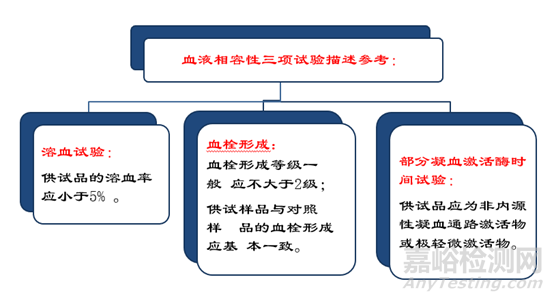
血液相容性
试验目的:血液相容性试验用一个相应的模型或系统评价与血
液接触的医疗器械或材料对血液或血液成分的作用。
试验方法:血栓形成、凝血、血小板、血液学(溶血、白细胞计数、白细胞活化、网织红细胞计数)、补体系统
其他特殊血液相容性试验还可设计成模拟临床应用时器械或材料的形状、接触条件和血流动态,测定血液/材料/器械的相互 作用。
血管内导管、导丝考虑血栓形成、凝血、溶血。瓣膜成形环、机械心脏瓣膜考虑血栓形成、溶血。人工心脏、心室辅助器械 考虑血栓形成、血液学。栓塞器械考虑溶血。人工血管、支架、 生物心脏瓣膜考虑血栓形成、溶血。
热原试验
试验目的:确定医疗器械或材料浸提液的间接致热反应。
试验方法:将医疗器械浸提液注入家兔静脉,在规定的时间内观察家兔体温升高的情况,以判定供试品是否具有潜在的材料致热作用。
描述参考:供试品浸提液应无材料致热作用(应无热原反应)。
靠单项试验不能区分热原反应是因材料本身还是内毒素污染所致。致热性反应可能是材料介导、内毒素介导或其他物质介导,对新型医疗器械没有必要都要进行体内致热性检验,但是材料如含有引起过热原反应的新化学成分或物质,则宜进行材料介导致热性评价。内毒素污染是致热反应的一个原因,不应与材料介导的致热反应相混淆。
生殖毒性试验
试验目的:评价试验样品对生殖功能、胚胎发育(致畸性)以及胎儿和早期婴儿发育潜在影响。
可能需要进行生殖及发育毒性试验的材料或器械:1. 与生殖组织或胚胎(胎儿)直接长期或永久接触的器械。2. 储能医疗器械。3. 可吸收材料或可溶出物质。(如在吸收、代谢和分布研
究方面有充分可靠的数据,或者材料或医疗器械浸提液中鉴别出的所有成分均无生殖和发育毒性时,就无需进行试验。)
实验策略:先进行OECD421生殖发育筛选毒性试验以获得可 能影响生殖和发育的初步信息,并最初评估危害。附加试验 在适宜的情况按OECD414致畸性/415一代生殖毒性/416二代生殖毒性试验进行。如果其他试验表明对雄性生殖系统有潜 在影响时,应进行相应的雄性生殖毒性试验。

来源:独孤吹泡/医用耗材研发


