您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-06-26 18:09
骨科产品相关指导原则
1、无源植入性医疗器械产品注册申报资料指导原则(2009-519-1)
2、金属接骨板内固定系统产品注册技术审查指导原则(2014-6-5)
3、脊柱后路内固定系统注册技术审查指导原则(2016-70-5)
4、椎间融合器注册技术审查指导原则(2016-70-6)
5、钙磷、硅类骨填充材料注册技术审查指导原则(2017-14-1)
6、髋关节假体系统注册技术审查指导原则(2017-23-2)
7、人工颈椎间盘假体注册技术审查指导原则(2017-23-1)
8、无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)(2017-75)
9、骨组织手术设备注册技术审查指导原则(2017年修订版)(2017-146-3)
10、骨科外固定支架注册技术审查指导原则(2018年修订)(2018年第107号)
11、骨水泥套管组件注册技术审查指导原则(2018年第107号)
透析类产品相关指导原则
1、一次性使用透析器产品注册技术审查指导原则(2013-3-6)
2、一次性使用血液分离器具产品注册技术审查指导原则(2014-6-3)
3、血液透析浓缩物产品注册技术审查指导原则(2014-6-4)
4、血液透析用制水设备注册技术审查指导原则(2016年修订版)(2016-22-9)
5、腹膜透析机注册技术审查指导原则(2016-27-4)
6、一次性使用血液透析管路注册技术审查指导原则(2016-146)
7、中心静脉导管产品注册技术审查指导原则(2017-14-2)
8、 一次性使用胆红素血浆吸附器注册技术审查指导原则(2018年第126号)
骨科/透析类医疗器械研究资料
5.1产品性能研究
5.2生物相容性评价研究
5.3生物安全性研究
5.4灭菌和消毒工艺研究
5.5有效期和包装研究
5.6动物研究
5.7软件研究
5.8其他
骨科/透析类医疗器械产品性能研究
应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标(如电气安全与电磁兼容、辐射安全)以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
(1)详述产品技术要求中性能指标及检验方法的确定依据,提供采用的原因及理论基础,提供涉及到的研究性资料、文献资料和/或标准文本。
(2)提供降解周期和降解产物及体内代谢情况的相关研究资料。
Ø这里的降解周期指产品在人体内降解的整体周期;
Ø可通过产品在动物体内的降解试验来间接研究产品在人体内的降解周期,但需提供相关依据;
Ø若通过体外的降解试验反应体内的降解性能,需提供相关的依据和研究资料。
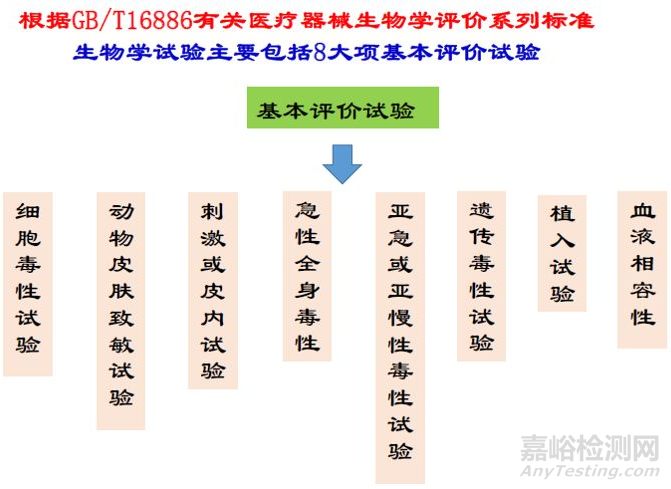
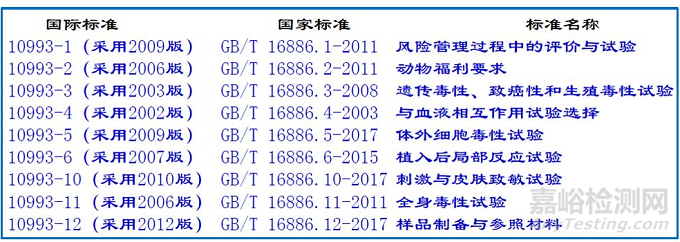
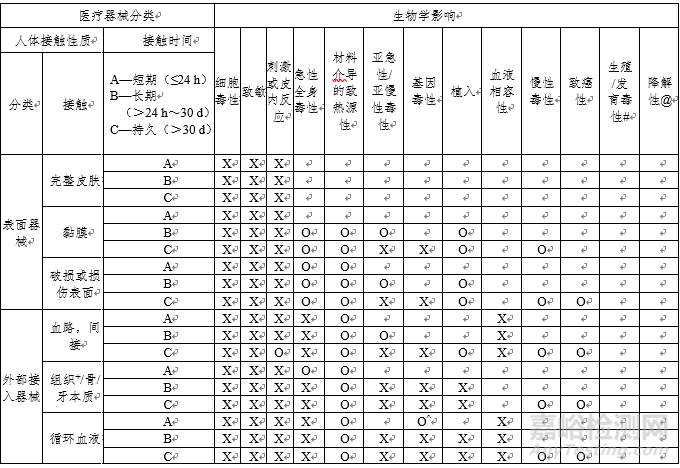
骨科/透析类医疗器械生物相容性评价研究
应对成品中与患者和使用者直接或间接接触的材料的生物相容性进行评价。
生物相容性评价研究资料应当包括:
1.生物相容性评价的依据和方法。
2.产品所用材料的描述及与人体接触的性质。
3.实施或豁免生物学试验的理由和论证。
4.对于现有数据或试验结果的评价。
ISO 10993.1的新变化
Ø强调间接接触的医疗器械
Ø强调需要评估医疗器械或其零部件断裂带来的生物学风险(胶囊内窥镜)
Ø强调所有生产过程,尤其是包装和灭菌
Ø新增纳米材料、辅助生殖器械相关要求
Ø新增瞬时接触的概念(<1分钟)
Ø强调包装材料作为考虑因素
Ø强调重复使用次数的最差条件
Ø新增呼吸管路的要求
生物安全性研究
对于含有同种异体材料、动物源性材料或生物活性物质等具有生物安全风险类产品,应当提供相关材料及生物活性物质的生物安全性研究资料。包括说明组织、细胞和材料的获取、加工、保存、测试和处理过程;阐述来源(包括捐献者筛选细节),并描述生产过程中对病毒、其他病原体及免疫源性物质去除或灭活方法的验证试验;工艺验证的简要总结。
YY/T 0771.1-2009 动物源医疗器械 第1部分:风险管理应用
YY/T 0771.2-2009 动物源医疗器械 第2部分:来源、收集与处置的控制
YY/T 0771.3-2009 动物源医疗器械 第3部分:病毒和传播性海绵状脑病(TSE)因子去除与灭活的确认
198. 动物源性医疗器械注册技术审查指导原则(2017年修订版)(2017年第224号)
1)动物源性材料与其他材料的比较分析;
2)对所取材动物的种类、地理来源、年龄、取材部位及取材部位的组织性质的具体描述;
3)说明动物的可追溯性标识、动物饲养、检疫、屠宰及加工方面的情况;
4)提供与动物饲养场所的采购协议、动物饲养和屠宰场所的资质证明,如果涉及中间商,应提供所有中间商的有关供货协议及资质证明;
5)对饲养、取材和加工处理等过程中产品可能感染病毒和/或传染性病原体的风险分析和相应的控制措施(若附有国外官方或第三方出具的证明性文件,应提交原件或公证件),以及对产品使用过程中人体可能由动物源性医疗器械感染病毒和/或传染性病原体的风险分析和相应的控制措施;
6)对产品使用过程中人体可能因为接触动物源性材料而产生的免疫原性方面的风险分析和相应的控制措施,以及清除(或降低)动物源性材料免疫原性工艺过程的描述、质量控制指标与验证性实验数据或相关资料。
灭菌/消毒工艺研究
1.生产企业灭菌:应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌确认报告。
2.终端用户灭菌:应当明确推荐的灭菌工艺(方法和参数)及所推荐的灭菌方法确定的依据;对可耐受两次或多次灭菌的产品,应当提供产品相关推荐的灭菌方法耐受性的研究资料。
3.残留毒性:如灭菌使用的方法容易出现残留,应当明确残留物信息及采取的处理方法,并提供研究资料。
4.终端用户消毒:应当明确推荐的消毒工艺(方法和参数)以及所推荐消毒方法确定的依据。
ØYYT 0884-2013 适用于辐射灭菌的医疗保健产品的材料评价
ØYYT 1265-2015 适用于湿热灭菌的医疗器械的材料评价
ØYYT 1267-2015 适用于环氧乙烷灭菌的医疗器械的材料评价
ØGB 18278.1-2015 医疗保健产品灭菌 湿热 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求
ØGB 18279.1-2015 医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求
ØGB 18280.1-2015 医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求
Ø ØGBT 16886.7-2015 医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量
Ø《可重复使用医疗器械再处理验证方法和标识注册技术审查指导原则(一)(征求意见稿)》
产品有效期和包装研究
1.有效期的确定:如适用,应当提供产品有效期的验证报告。
2.对于有限次重复使用的医疗器械,应当提供使用次数验证资料。
3.包装及包装完整性:在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。
提供产品有效期的验证报告(包括产品物理、化学稳定性和包装密封稳定性的验证资料)。不同包装或容器的产品需分别提供验证资料。
跌落、振动、模拟运输。
无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)
1. 验证试验类型
(1)加速稳定性试验:
(2)实时稳定性试验:25℃±2℃,60%RH±10%RH
无源植入性医疗器械的实时稳定性试验和加速稳定性试验应同时进行
2. 验证试验检测/评价项目
包括产品自身性能检测和包装系统性能检测两方面:与医疗器械货架有效期密切相关的物理、化学检测项目,可采用包装封口完整性检测用于替代无菌检测。后者则包括包装完整性、包装强度和微生物屏障性能等检测项目
建议注册申请人在试验过程中设立多个检测时间点(一般不少于3个)对无源植入性医疗器械进行检测。可采用零点时间性能数据作为检测项目的参照指标。
无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)
3. 进行验证试验的产品
与常规生产相同的终产品进行
建议至少包括三个代表性批次的产品,推荐采用连续三批。
设计最差条件下的验证试验。
无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)
1. 与申请注册产品货架有效期相关的基本信息。包括该医疗器械原材料/组件、包装材料、生产工艺、灭菌方法(如涉及)、货架有效期、储存运输条件等;
2.注册申请人在该医疗器械货架有效期验证过程中对相关影响因素的评估报告;
3. 实时稳定性试验的试验方案及试验报告,同时提供试验方案中检测项目、检测判定标准、检测时间点及检测样本量的确定依据和相关研究资料;
4. 如适用,可提供加速稳定性试验的试验方案和试验报告,同时提供加速稳定性试验的试验方案中检测项目、检测判定标准、加速老化参数、检测时间点及检测样本量的确定依据和相关研究资料;
5. 包装工艺验证报告及包装、密封设备的详述;
6.注册申请人认为应在注册时提交的其他相关支持性资料。
临床前动物试验
如适用,需包括动物试验研究的目的、结果及记录
278. 《医疗器械动物实验研究技术审查指导原则 第一部分:决策原则》
其他资料
对于添加药品成分的产品,若产品以医疗器械作用为主,则需按照药械组合产品的相关法规文件提供相应资料
Ø“研究资料”是指设计依据(包括公认的理论支持及由其得出的推论)及试验资料(研究成果的试验验证是否达到预期)。注意需考虑试验样本的代表性和试验方法的可靠性。也可采用提供引用文献的方式提供试验资料,但需对文献数据的可信度及引用文献的适用性进行评价。
Ø“质控资料”包括能够保证生产出的产品可以达到设计要求的控制标准和/或规范操作,以及验证报告(为了验证各批次间产品质量的稳定性,需提供至少连续三批的验证结果)。
Ø“支持性资料”是指可以支持某一理论或宣称的研究资料或证明性文件。
注册资料重点要求——生产制造信息
1.详述产品生产加工过程,包括各种加工工艺、各种加工助剂的使用情况,对残留单体或小分子残留物的控制情况及相应的验证资料等。
2.有多个研制、生产场地的,需概述每个研制、生产场地的实际情况。
透析产品注册申报资料重点要求及常见问题分析
血液透析浓缩物注册资料重点要求
血液透析浓缩物是一种含有各种不同无机盐的混合物,配制成浓缩液由血透机按特定比例用透析用水稀释成透析液使用。在血液透析治疗过程中透析液流动于半透膜患者血液的对侧,并通过对流及溶质弥散等物理过程,达到纠正患者的电解质失衡、酸碱平衡紊乱,清除体内代谢产物或毒性物质的目的。
血液透析浓缩物由A浓缩物和B浓缩物两部分组成。
A浓缩液由氯化钠(NaCl)、氯化钾(KCl)、氯化钙(CaCl2·2H2O)、氯化镁(MgCl2·6H2O)、冰醋酸(CH3COOH)组成,
B浓缩物由碳酸氢钠(NaHCO3)组成。
血液透析浓缩物注册资料重点要求——原材料
所有组方的化学原料应符合《中华人民共和国药典》(以下简称《中国药典》)或国家药品标准的相应要求,化学原料应当实施全项目批检验,提供每一种化学原料的自检报告。化学原料应具有固定供货渠道以保证产品质量,提供化学原料上市证明文件及供方资质证书。
血液透析浓缩物注册资料重点要求——包装材料
6.直接接触浓缩物的包装容器技术要求,建议参考《直接接触药品的包装材料和容器标准》提供注册或证明文件,还应包括:
包装材料的配方信息。包装容器的质量标准,包括符合国家标准的证明文件、企业接收包装容器的验收标准。包装容器的全性能检验报告。
如使用新型包装材料可以参考药品审评中心发布的《化学药品注射剂与塑料包装的相容性技术指导原则》、YBB 0014-2002《药品包装材料与药物相容性试验指导原则》中规定选择合适项目进行验证,提供药物相容性试验研究数据。
血液透析浓缩物注册资料重点要求——技术要求
2.1 性状
2.2 装量
2.3 pH值
2.4 离子浓度
2.5 微粒污染
2.6 微生物限度
2.7 细菌内毒素
血液透析浓缩物注册资料重点要求——稳定性研究
8.浓缩物稳定性验证建议参考《中国药典(2015版)》中《原料药与药物制剂稳定性试验指导原则》中药物制剂的要求提交验证资料。包括所有型号和装量产品,应在实际储运包装状况下,考核温度、湿度、时间对浓缩物稳定性的影响。观察项目应包括注册产品标准中条款和化学污染物分析。
按照注册标准中项目要求,给出浓缩物在不同考核时间段内、不同温度、不同湿度下溶质浓度、不溶性微粒、微生物限度(或无菌)、内毒素等项目的检验结果。干粉应增加溶解时间比较结果。B干粉产品还应提供前述至少四个时间点溶解度指标的检测结果。化学污染物分析建议参考YY 0572《血液透析和相关治疗用水》中检测指标项目,组方原料中已经包含的化学离子无须检测。应提交实时稳定性验证报告,并根据该结果确定产品有效期。
5.1 高温试验;5.2 高湿度试验;5.3 强光照射试验;
5.4 加速试验;5.5 长期试验
血液透析浓缩物注册资料重点要求——检测报告
1.透析液最终离子浓度、AB剂单剂化学原料成分和比例、透析浓缩物提供状态、浓缩物及透析用水配合比例,上述四者中只要存在一种情况不同,应分别提供全性能注册检测报告。
2.如产品以浓缩液状态提供,应提供生产中使用的符合YY 0572透析用水标准的全项目注册检验报告。
3.根据说明书中规定的适用机型,提供申报包装形式B干粉按照临床使用方式进行的注册检测报告,其中应包括至少四个时间点(透析开始时、临床使用时间三等分点、透析结束时)与A液配和形成透析液的溶解度指标。
QA
Q:对于可降解/吸收的植入性医疗器械产品,能否提供研究机构公开发表的文献作为产品降解性能的研究资料?
A:对于成熟材料,申请人可提交第三方公开发表文献作为降解产物代谢研究的支持性资料,但由于产品降解周期研究中的性能指标、观察时间点等要素与产品设计相关,因此申请人应对产品降解周期开展实验研究。
Q:产品在进行化学性能研究时,某项化学性能(例如还原物质)出现异常,需如何进行评价?
A:当化学性能研究结果出现异常时,建议申请人评估异常的原因,综合评估医疗器械的安全性。例如涂覆涂层的导管类产品,涂层材料导致还原物质测试结果异常时,建议对不涂覆涂层的产品进行测试,确认其化学性能是否可接受,同时结合涂层材料的临床应用史及生物相容性数据,综合评价。
Q:热原同细菌内毒素有何区别与联系?
A:热原泛指能引起机体发热的物质,热原包含了材料致热及细菌内毒素致热两方面信息,属于生物学评价项目。
细菌内毒素是革兰氏阴性菌死亡、自溶后,释放出的细胞壁中脂多糖成分,通常来源于生产中引入的生物污染,不属于生物学评价项目。
一般来说,细菌内毒素是热原,但热原不全是细菌内毒素。

来源:李道成 致众医疗


