您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-04-08 10:49
风险评价完之后每个风险是否可以接受你就清清楚楚了,那么接下来要做什么事情也十分清楚了,就是风险控制。今天法规狗就好好地和大家聊聊风险控制。
风险控制的总体思路
在开展风险控制的工作的时候我们应该用什么样的总体思路呢? 你可能会觉得这个问题似乎有点无厘头,实则不然。你只有把这个问题想通了,你才能真正把风险控制的工作做好。
结合坐标解释这个问题会让大家觉得更容易理解。如下坐标图,风险3经过风险评价之后我们认为是不能接受的,需要做控制,控制的思路有两个,一个是把风险3往坐标系的左边拉,一个是把风险3往坐标系的下面拉。
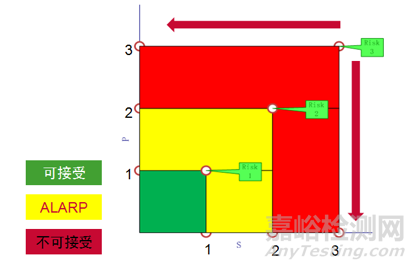
换个标准的说法是降低严重度,降低可能性。降低严重度,举个例子,能不能把造成的伤害从致死变成严重伤害,降低可能性你是要去想能不能把两个概率降低,一个是可预见事件序列导致危险情况发生的概率(P1), 另一个是危险情况导致伤害发生的概率(P2)。
风险控制的具体方法
上述的总体指导思想又可以衍生出风险控制的3个主要方法,标准里面是这么说的:
用设计方法取得固有安全
在医疗器械本身或在制造过程中的防护措施
安全信息
举个例子,对于一次性使用的无菌注射器,会有交叉感染的危险(源),要控制这个风险可以采取的方法有:
把注射器设计成自毁式的
注射器使用过之后会有明显的指示,该指示表示已经使用过了,提醒不能再次使用
说明书里告知不能重复使用,告知重复使用的后果
很明显,把注射器设计成自毁式的是通过设计方法取得固有安全。注射器使用过之后会有明显的指示属于在医疗器械本身或在制造过程中的防护措施,说明书里告知不能重复使用属于提供安全信息。
一般来说通过设计方法取得固有安全是最难的,提供安全信息是最容易的。从严谨性上来讲针对于每一个风险的控制要去想想是否这三种方法都可以采用的。
风险控制措施的有效性验证
医疗器械厂商采取了风险控制措施之后还要验证措施的有效性(Verification of effectiveness)。措施的有效性该如何验证呢? 该如何验证要基于你采取什么样的风险控制措施。风险控制的措施通常和标准是相关的,换句话说你会把标准的要求考虑进来,那么如何来做有效性验证就很明确了,就是看你有没有真正满足这些标准的要求。因此检测,核对说明书,可用性评估,临床试验等等都是风险控制措施有效性验证的方法。
剩余风险的分析
剩余风险的分析很容易理解,就是你在做完风险控制措施之后(有效性验证完之后)进行风险的再次评价,看剩余风险是否都是可以接受了。一般来说你肯定是期待到这一步应该是都可以接受了。但是万一还是不能接受怎么办呢?
受益/风险分析
采取了风险控制措施之后风险还是不能接受的情况也是会出现的,比如用于胃癌治疗的某种创新药物,副作用我们还不清楚,但是目前也没有其它更好的药物,如果不用这个创新药物,胃癌的患者基本上一线生机都没有。用了这个药物还有一线生机,像这样的情况很明显对于胃癌患者受益是大于风险的。
考虑因为采用风险控制措施是否会引入新风险
这个怎么理解呢? 举个例子,考虑到降低强电的风险,医疗器械厂商把一个网电源供电的产品设计成了电池供电。但是电池会带来新的风险,比如电池发热,电池充放电的风险等等。因此采用了风险控制措施之后还要考虑是否引入了新的风险。如果引入了新的风险,要对新的风险进行管理和控制。
风险控制的完整性
最后厂商要整体看一看所有的风险是否都进行了控制,标准中提到要确认是否对识别出的所有的危险情况都进行了针对性的处理,在这里你就会意识到如果危险情况都识别得不清楚不全面,何谈完整性。风险管理是一环扣一环的,前面没有做好,后面的工作不可能做得好。
参考资料:
[1] Medical devices - Application of risk management to medical devices (ISO 14971:2007, Corrected version 2007-10-01)
[2] 医疗器械-风险管理对医疗器械的应用(YY/T0316-2016/ISO 14971:2007更正版

来源:启升资讯


