您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-12-12 09:45
谈到遗传毒性,通常这是一个比较严肃的话题,因为这会直接影响下一代的健康水平。如果产品的遗传毒性过大,那么很有可能会造成新生儿畸形、身体残缺等疾病。所以,为了降低和规避这种不可逆的潜在风险,厂商需要通过遗传毒性测试来确保医疗器械的安全性。为此,ISO也制定了相关标准来指导和规范测试流程。今天,小编就带领大家一起解读ISO 10993-3:2014遗传毒性测试的标准要求。
遗传毒性测试,主要用于评估潜在的基因突变、染色体结构和数量变异、以及由医疗器械、材料或其浸提物引起的基因毒性。一般而言,遗传毒性测试主要检测两类基因损伤:1)基因突变(点突变);2)染色体损伤(即结构畸变,如染色体易位、缺失和插入,以及染色体数量变化)。
首先要明确的是,不可能通过单一测试就能够检测出所有相关的毒性物质,所以常用的方法是进行一组体外测试或特定情境下的体内测试。
其中,细菌回复突变试验结果表明,可以检测在啮齿类动物试验中出现的由大多数遗传毒性致癌物导致的遗传突变。但是,由于测试材料在细菌系统中产生的DNA损伤,可能与其在真核细胞中的影响不同,所以还要在哺乳动物细胞系中进行测试。
哺乳动物细胞系常用于:1)检测染色体总损伤(例如,染色体结构和数量畸变的体外试验);2)检测基因突变(例如,次黄嘌呤磷酸核糖基转移酶(HPRT)突变试验);3)检测基因突变和染色体断裂(例如,小鼠淋巴瘤胸苷激酶检测,菌落数和大小测定)。
在选择样品制备方法时,要结合考虑材料或产品的化学组成和物理化学性质,通常可以参考附录A的图A.1。该图明确了用于选择产品或材料提取方法(方法A、B或C)的决策过程。
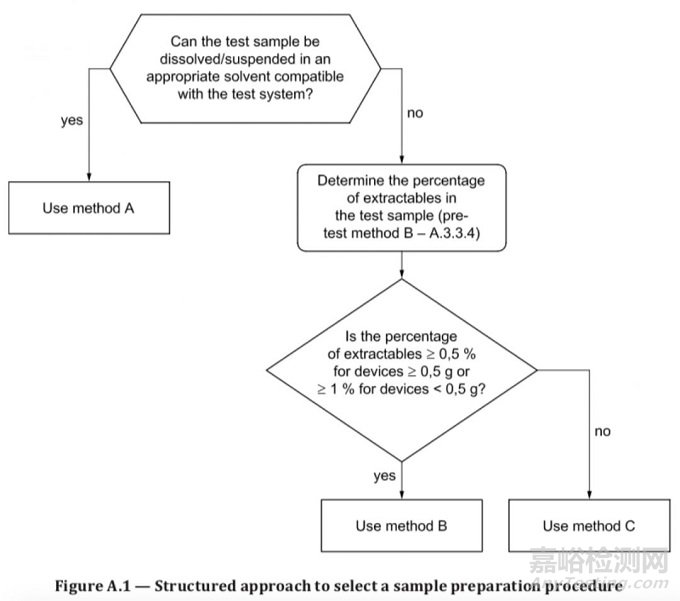
除非样品可以溶解在与测试系统相容的溶剂中,否则应基于稳定性,选择能够最大化提高医疗器械或材料的基因毒性残留物浓度,但又不会发生降解且不会与样品发生反应的浸提液,同时能保证足够的阳性反应。而且,通常会选择两种浸提液来进行测试(可参见“ISO 10993-12:2012样品制备及参考品解读”或本标准附录A)。另外,要根据与遗传毒性测试系统的兼容性,选择测试系统载体。试验应在溶液、悬浮液、或成品(包括来源于成品的组分或材料)提取液中进行。
开展遗传毒性测试时,测试组应包括:1)细菌(OECD471)基因突变测试,可用于医疗器械浸提物测试;2)使用哺乳细胞(OECD473)评估染色体损伤的细胞遗传学体外试验;3)体外小鼠淋巴瘤tk测定(OECD 476),同时包括检测菌落生长;4)用于评估染色体损伤和数量畸变的体外哺乳动物细胞微核试验(OECD 487)。
如果存在影响化合物基因毒性活性的其他相关因素(例如,遗传毒性机制和代谢动力学)时,则需考虑体内试验。其中,啮齿类动物造血细胞染色体损伤的体内试验,可用于骨髓细胞染色体畸变的中间分析,或骨髓和外周血红细胞的微核分析。
对于啮齿类动物造血细胞染色体损伤的体内试验,应使用两种浸提液进行检测。若为极性浸提液,则优选静脉注射;若为非极性浸提液,则优选腹膜内注射。
如果两组体外测试的结果都为阴性,则无需进一步开展体内遗传毒性测试。如果存在阳性结果,则要进行后续评估。评估过程总共分为6步(参见附录B.1流程图):
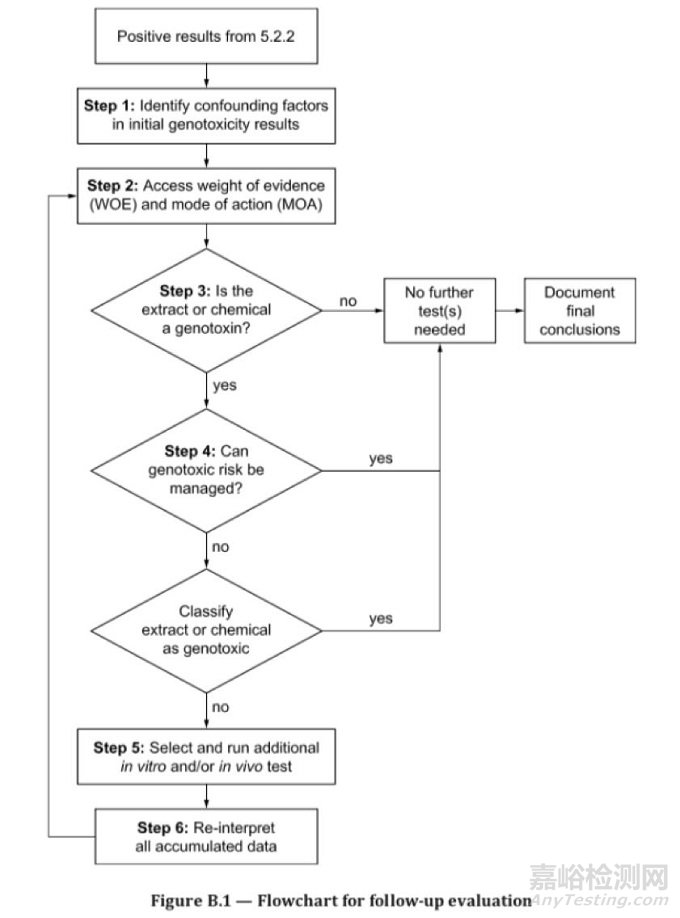
第一步:识别初始遗传毒性测试结果中的影响因素
a)识别交互因素(例如,非生理条件、测试品与培养基的相互作用、自氧化和细胞毒性);b)识别代谢影响(例如,外源性代谢系统的性质、代谢特征、特别的代谢产物);c)通过化学表征鉴定杂质(例如,材料成分研究或分析测试)。
第二步:评估作用机制和方式(MOA)及证据权重(WOE)
a)直接作用DNA与非直接作用DNA的模式比较;b)非整倍性和多倍性问题,是否涉及非整倍体机制(染色体数量畸变)。
第三步:决策点
确定医疗器械或材料浸提物是否为基因毒素,如果,a)在毒理学风险评估框架内,结果解释和WOE / MOA分析显示,在预期使用情况下,患者的关注度低或可忽略不计;或b)在毒理学风险评估框架内,结果解释和WOE / MOA分析表明,在预期使用情况下,患者可能存在潜在风险。如果确定是a),则不需要进一步测试或评估。如果决定是b),则继续步骤4。
第四步:执行风险管理
应对具有遗传毒性危害进行风险管理,或者选择适当的体外和或体内随访测试。
第五步:选择并开展另外的体外和或体内测试
任何体内试验,应基于体外试验结果,选择最合适的实验终点。常用的体内试验包括:1)啮齿类动物的微核试验(OECD 474);2)啮齿类动物骨髓的中期分析(OECD 475);3)转基因致突变性试验(OECD 488)。
测试过程中,应证明测试物已到达靶器官。对于啮齿类动物的微核试验或骨髓中期分析,生物利用度可以通过以下方法来证明:1)血液或血清中特定提取物化合物的定量分析;2)测试提取物对骨髓细胞的细胞毒性;3)静脉内暴露途径(对于急性浸提液)。如果不能证明靶器官暴露,则应在另一个靶器官中进行第二次体内试验,以验证缺乏体内遗传毒性。
第六步:重新解释所有数据并确定测试物是否具有遗传毒性
在某些情况下,体外试验的阳性结果不具备相关性。所以,在确定体外结果的总体相关性时,应考虑是否存在以下情况:1)最初的两次体外试验,仅有一次为阳性结果;2)使用类似机制终点做进一步体外研究,未证实阳性结果;3)体外阳性结果与体内情况无关;4)体内测试中已证实测试样品到达靶器官,但仍没有表现出遗传毒性。
ISO 10993-3:2014通读下来,关于如何开展遗传毒性测试,小编认为大体可分为三步:1)样品制备:根据样品理化性质选择合适的处理方法;2)体外测试:选用合适的细胞系开展基因突变、染色体突变等测试;3)体内测试:根据体内测试结果选定合适的试验终点,按照“六步法”持续评估遗传毒性水平。全文至此,小编希望能给大家带来一些思考和收获。

来源:启升


