您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-04-27 17:49
1.法规框架
印度尼西亚医疗器械监管机构为卫生部(Ministry of Health, MoH)下属国家食品药物管理局(National Agency of Drug and Food Control, NADFC),其马来语为Badan Pengawas Obat dan Makanan,故亦简称BPOM,主要负责监管和管理医疗器械的注册、市场准入、质量控制和监督等事务。
其法规要求有ASEAN Medical Devices Directive(AMDD)《东南亚国家医疗器械指令》及Regulation of the Minister of Health of The Republic of Indonesia Number 62 of 2017 on Product License of Medical Devices and Household Health Products《印度尼西亚共和国卫生部长关于医疗器保健品产品许可证的2017年第62号条例》等。
2.分类规则
印尼的分类规则与马来西亚类似,根据风险由低到高,将医疗器械产品分为 A、B、C、D 四个等级(体外诊断试剂也一样),具体可参考当局文件Pedoman Klasifikasi医疗器械分类指南,也可以使用BPOM的在线分类数据库确认具体产品的类别。
3.注册申请流程
在印度尼西亚注册医疗器械,公司必须首先获得IDAK (Izin Dibusi Alat Kesehatan) 或医疗器械分销许可证MDDL(Medical Device Distributor License)。IDAK/MDDC 可以通过在线授权平台申请,一旦获得批准,将通过Online Single Submission(OSS)网站发布。
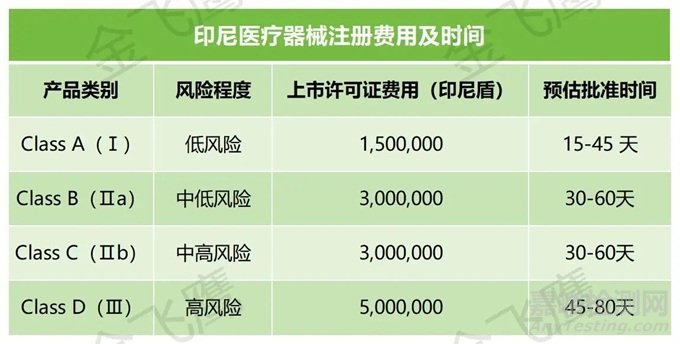
目前,只有印尼本地公司可以申请IDAK/MDDL。也就是说,国内企业假如没有在当地注册公司的打算,那就需要指定当地授权代表(跟马来西亚一样)。总的来说,国内企业在印尼申请医疗器械注册的流程大致如下:确认产品类别→任命授权代表→授权代表获得经销商许可证书→注册申请(授权代表提交)→缴费→资料评审→获得注册证(有效期为5年)。大致费用及周期如下:
另外,与马来西亚一样,印尼医疗器械注册技术文件的要求可以参考东盟共同提交档案模板(CSDT)。对产品标签和使用说明书的要求也是一样,必须用印尼语,包括产品名称、型号、制造商信息、有效期、使用说明和警告等。注册资料可同时提供英语和印尼语版本。
4.关于当地授权代表
印尼当地代表法规术语为Sole Agent/Sole Distributor/Exclusive Distributor,外国制造商必须在印尼指定当地实体公司为授权代表,属于独代性质。
资质要求:当地企业识别号NIB(Nomor Induk Berusana)、医疗器械分销证书IDAK或MDDL、好的分销管理符合性证明CDAKB(自2020年起强制要求)。

来源:Internet


