目的:通过对比 3 家不同供应商的无菌预灌装培养平皿实验结果,筛选出质量较好的平皿培养基,同时探讨其供应商筛选、进厂检查和使用方法,为无菌药品生产企业进行无菌预灌装培养平皿的质量控制工作提供参考。
方法:分别对 3 家供应商的无菌预灌装培养平皿进行 3 个批次的模拟使用,培养基无菌性、内层包装袋无菌性、平皿密闭性和培养基适用性检查,筛选适合用于无菌生产区洁净环境微生物监测的平皿培养基。
结果:3家供应商的模拟使用、培养基无菌性和内层包装袋无菌性实验结果没有差异,供应商 A 的平皿密闭性和培养基适用性实验结果较另外两家更好。
结论:本实验方法可用于筛选质量较好的无菌预灌装培养平皿。
微生物污染是药品质量评估的重要指标[1],无菌药品生产企业在生产车间核心区域监测到微生物污染,说明药品无菌生产过程存在安全隐患。为避免外源性污染进入药品生产车间[2],2010版GMP规定:制药企业需对洁净环境进行动态或静态监测,使用沉降菌平皿、空气浮游菌平皿和表面接触皿评估无菌生产的微生物状况[3],制药企业一般通过自配和购买无菌预灌装培养平皿满足其大量使用的需求。
自配的平皿培养基有一些值得探讨的问题:①制备无菌平皿培养基需具备配皿、包装、抽真空、伽马射线终端灭菌等条件,工艺复杂,难以实现,如不进行终端灭菌易造成假阳性结果[4];②经100%的预培养后[5],需要对平皿培养基进行无菌性检查,以防带入外来的污染物到监测区;③使用容器装放平皿,或直接将平皿传入洁净区使用,也会污染生产区[6];④自配的平皿有效期短,常小量多次配制,增加了批间差异和管理成本[7]。
无菌预灌装培养平皿采用双层或三层抽真空包装,通过伽马射线终端灭菌,在使用时根据物料传递程序剥除外层包装,避免外源性的微生物和颗粒通过物料传递过程污染无菌生产区[8],正逐渐受到无菌药品生产企业的青睐。
本文对无菌预灌装培养平皿的供应商筛选、进厂检查和日常使用方法进行了探讨,为无菌药品生产企业进行无菌预灌装培养平皿的质量控制工作提供参考。
1、实验材料与方法
1.1培养基
无菌预灌装培养平皿分别为胰酪大豆胨琼脂培养基(Tryptose Soya Agar,TSA)和沙氏葡萄糖琼脂培养基(Sabouraud Dextrose Agar,SDA),规格为直径90 cm,3层包装,伽马辐照终端灭菌;样品来自3家不同的供应商,分别以供应商A、供应商B、供应商C表示。
1.2主要仪器设备和耗材
BHC-1000ⅡA/B3型生物安全柜(苏州安泰空气技术有限公司);DENSIMT型细菌比浊仪(法国梅里埃诊断产品有限公司);GNP-9270型隔水式培养箱(上海精华宏实验设备有限公司);直径90 cm空平皿,6004型数字风速计(日本加野麦克斯公司);无菌涂布棒,移液器,G560E型电动混匀器(美国Scientific Industries公司)。
1.3菌种
金黄色葡萄球菌[CMCC(B)26003],铜绿假单胞菌[CMCC(B)10104],生孢梭菌[CMCC(B)64941],枯草芽孢杆菌[CMCC(B)63501],白色念珠菌[CMCC(F)98001],黑曲霉[CMCC(F)98003],均购自中国食品药品检定研究院,试验用菌种的传代次数不得超过5代。
1.4实验方法
1.4.1 模拟使用
模拟日常使用过程,人员打开或关闭平皿动作应流畅,将每家供应商产品进行3个不同批次的独立试验。平皿堆叠移动时应稳固。
1.4.2 培养基无菌性检查
取2个TSA和SDA,置30~35 ℃和20~25 ℃下培养72 h和5 d后,观察结果,将每个供应商产品进行3个不同批次的独立平行试验。经培养后,2个平皿应无菌生长。
1.4.3 密封内包装无菌性检查
取2袋装TSA和SDA,无菌操作打开第一层和第二层包装,用TSA接触皿于第二层和第三层包装表面取样,接触时间应不少于10 s,置30~35 ℃培养72 h后,观察结果,将每个供应商产品进行3个不同批次的独立平行试验。第二层和第三层包装应无菌生长。
1.4.4 平皿密闭性检查
取2个TSA,称量其重量,于较高的侧面风速下倒置摆放72 h后,再称量其重量,根据前后重量差计算失水率,将每个供应商产品进行3个不同批次的独立平行试验。气流可吹至培养皿内,导致平皿污染、失水,并在皿盖上形成水珠或水雾,应选择失水率最少的产品。
1.4.5 培养基适用性检查
①样品准备:将待测无菌预灌装培养平皿打开皿盖,在风速为0.36~0.54 m·s-1的A级单向流下放置4 h后盖上皿盖;②菌液制备:取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物,用pH 7.0无菌氯化钠-蛋白胨缓冲液制成不大于100 cfu/0.1 mL的菌悬液;取黑曲霉的新鲜培养物加入3~5 mL含0.05%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液,将孢子洗脱,然后,采用适宜的方法吸出孢子悬液置无菌试管内,用含0.05%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液制成不大于100 cfu/0.1 mL的黑曲霉孢子悬液;③适用性检查:接种0.1 mL不大于100 cfu的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉孢子的菌液至TSA,均匀涂布,在30~35 ℃培养72 h,计数;接种0.1 mL不大于100 cfu的白色念珠菌、黑曲霉菌孢子的菌液至SDA,均匀涂布,在20~25 ℃培养5 d,计数;每一试验菌株平行制备2个平皿,同时用国家对照培养基替代被检培养基进行上述试验,将每个供应商产品进行3个不同批次的独立平行试验。琼脂表面不应出现裂缝、涟漪、缩小等现象,样品培养基与对照培养基上菌落平均数的比值在0.5~2,且样品培养基的菌落形态大小与对照培养基上的一致,无明显差异[9]。
2、结果
2.1模拟使用
3家供应商3个不同批次的TSA和SDA模拟日常使用过程均符合要求。
2.2培养基无菌性检查
3家供应商3个不同批次的TSA和SDA经培养后均无菌生长。
2.3密封内包装无菌性检查
3家供应商3个不同批次的第二层和第三层包装均无菌生长。
2.4平皿密闭性检查
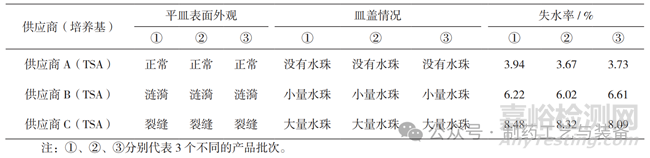
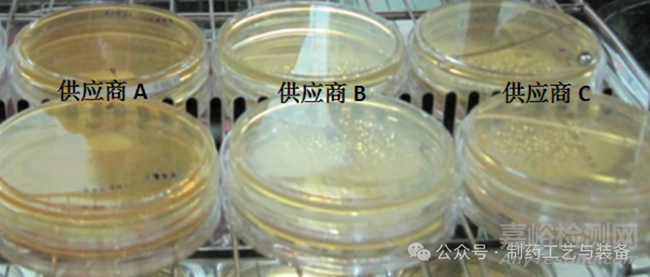
以风速为1.44 m·s-1侧吹平皿,测试结果见表1和图1。供应商A平皿表面外观正常,皿盖没有产生水珠,失水率最低,与供应商B和C差异明显,能有效地减少培养过程中外界环境的影响。
表1 平皿密闭性测试结果
图1 平皿密闭性测试
2.5培养基适用性检查
按《中国药典》2015 年版四部“1105 非无菌产品微生物限度检查:微生物计数法”规定[5],培养基适用性以回收率和菌落形态作判定标准,琼脂培养基在经过 A 级单向流放置后,含水量对微生物的促生长起至关重要的作用;普遍以琼脂培养基是否出现裂缝、涟漪、缩小等现象作为不合格标准,但较难观察与比较。
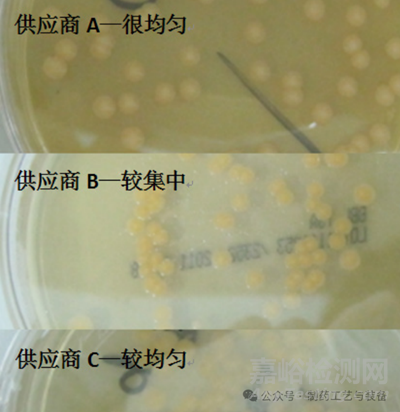
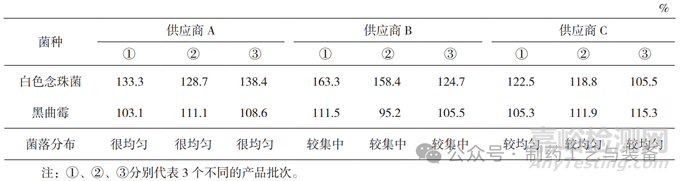
本实验采用菌落分布指标 [10],该指标与琼脂培养基的含水量相关,当含水量高的培养基在较小量的菌悬液操作情况下能涂开,于是经培养后菌落在平板上的分布较均匀;而含水量较少的培养基,当加入较小量的菌悬液后,培养基立刻将水分吸收,使菌悬液不能均匀地涂布至平板中,于是经培养后菌落在平板上的分布较集中,见图 2。基于菌落的分布情况,使用“很均匀 > 较均匀 > 较集中”表示菌落均匀程度。
图2 菌落分布情况比对
图3 大肠埃希菌菌落形态比对
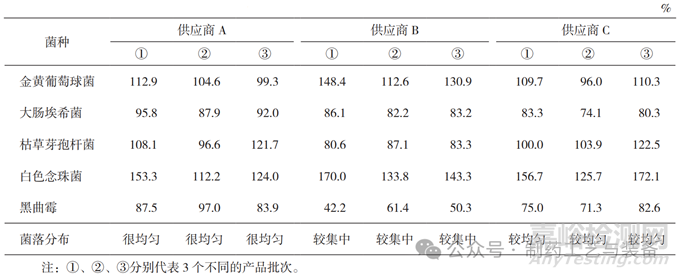
本实验使用 0.1 mL 菌悬液接种涂布 [11],测试结果见表 2 和表 3。供应商 A 培养基质量符合要求;供应商 B 培养基黑曲霉回收率在第一次测试中不符合规定(42.2%),且大肠埃希菌的菌落形态和大小与国家标准培养基上的不一致,见图 3,琼脂平皿含水量也低;供应商 C 培养基的菌落分布(含水量)不如供应商 A。
表2 TSA培养基适用性检查结果
表3 SDA培养基适用性检查结果
3、讨论
3.1供应商筛选
本实验经模拟使用,培养基无菌性、密封内包装无菌性、平皿密闭性和培养基适用性测试后,发现不同供应商的无菌预灌装培养平皿有差异,本研究最终选用供应商A的产品。
有的供应商为了减少平皿培养基在培养过程中的失水量,皿盖与皿底非常密合,这样会造成平皿培养基打开或关闭时困难,建议在模拟使用测试符合要求的情况下选用密闭性能较高的平皿培养基。
3.2进厂检查
应对每个生产批次的无菌预灌装培养平皿进行质量控制[12],包括核对供应商质检证书[13](Certificate of Authenticity,COA)、外观检查、培养基无菌性检查、密封内包装无菌性检查和培养基适用性检查。
图4 含水珠的最内层包装
外观检查可包括:①冷凝水,最内层包装袋应不存在明显的水滴和气泡,见图4,平皿盖及皿盖边缘不应存在流动水滴,平皿培养基表面不应存在流动水滴;②培养基,皿盖不应有流动水,培养基表面不应有气泡、流动水、涟漪、开裂、杂物等现象,见图5。
图5 外观检查缺陷
3.3日常使用
建议:①根据自身环境需求,选取带有中和剂成分的无菌预灌装培养平皿 [14];②操作人员在使用前应目视检查质量,包括外观和菌落生长检查;③要求供应商在最内层包装内附带 1 个或 2 个透气呼吸袋,将取样后的平皿培养基放入透气呼吸袋内密封,然后转移至质量控制部培养,培养结束后,打开包装,点计最终的菌落结果;透气呼吸袋能有效阻止外源性微生物污染 [15],避免源于物料传递或培养过程的假阳性结果。
参考文献
[1] 郑小玲,王征南,王知坚,等 . 药品微生物检测实验室环境菌库的建立 [J] . 中国现代应用药学,2015,32(7):847-850.
[2] 范一灵,冯震,钟玮,等 . 无菌药品生产企业核心区微生物污染调查与分析 [J] . 中国药事,2014,28(6):586-590.
[3] 王秀梅 . 浅析新版 GMP 无菌药品生产环境监测 [J]. 山东化工,2013,42(9):186-188.
[4] 蒋淑宏 . 微生物检验中培养基的质量控制 [J]. 中国卫生标准管理,2015,(15):171-172.
[5] 中国药典:四部 [S]. 2015:通则 9203,通则 1105.
[6] 方芳,马其胜,尹群,等 . 无菌工艺模拟试验的研究 [J].中国医药工业杂志,2013,44(4):415-419.
[7] 刘茜,姜俊慧,张慧慧,等 . 药品检验用培养基配制及灭菌后贮存有效期的研究 [J]. 药学研究,2015,34(2):81-83.
[8] 余峰,王旭,肖益热,等 . 制药厂房洁净车间物流的防交叉污染设计实践 [J]. 中外食品工业,2014,(9):42-43.
[9] 景荣先,张国林 . 2015 年版《中国药典》微生物限度检查法洁净环境及计数培养基修订分析探讨 [J]. 中国卫生产业,2015,(5):184-185.
[10] 朱亚虹,黄凯,曾环想 . 药品微生物检测的质量保证[J] . 中国医药指南,2010,8(33):176-176.
[11] 马绪荣,苏德模 . 药品微生物学检验手册 [M] . 北京:科学出版社,2000:86-86.
[12] 王绥家,黄宏星 . 微生物实验室培养基的质量控制 [J].检验医学与临床,2011,8(20):2557-2558.
[13] 张喜 . 商品微生物培养基质量状况及其控制 [J]. 当代医学,2009,15(16):37-38.
[14] 潘友文,钱维清,熊家娟 . 现代医药工业微生物实验室质量管理与验证技术 [M]. 北京:中国协和医科大学出版社,2004:118-118.
[15] 国家食品药品监督管理局药品认证管理中心 . 药品GMP 指南:无菌制剂 GMP 实施指南 [M]. 北京:中国医药科技出版社,2011:40-40.
本文作者黄家乐、王玥、何睿、裘畅、董铸雄,广东天普生化医药股份有限公司,来源于中国药事,仅供交流学习。