摘 要 Abstract
人乳头瘤病毒(human papillomavirus,HPV)感染具有广泛性和自限性,通常能被免疫细胞清除。然而,持续感染很有可能导致正常细胞病变,最终引发宫颈癌等恶性肿瘤。接种HPV 疫苗是宫颈癌一级预防的有效措施。采用大肠杆菌表达系统研发的HPV 疫苗具有低成本、高产量的优势。本文综述了HPV 基本概况和大肠杆菌表达系统的优势与挑战,重点梳理了大肠杆菌表达的HPV 疫苗的研发进展,以期为大肠杆菌重组表达系统的改进策略和新型HPV 疫苗的研发方向提供参考。
Human papillomavirus (HPV) infection is a common and self-limited viral infection that is primarily cleared by the immune system. However, persistent HPV infections may lead to cellular abnormalities, elevating the risk of malignant tumors, including cervical cancer. HPV vaccination is an effective primary prevention strategy against cervical cancer. The use of Escherichia coli expression systems for HPV vaccine development offers significant advantages in terms of costeffectiveness and high production yield. This paper provides an overview of HPV, discusses the advantages and challenges of the Escherichia coli expression system, and reviews the progress in the research and development of HPV vaccines using this system. It offers insights into the improvement of the Escherichia coli recombinant expression system and the future development of novel HPV vaccines.
关键词 Key words
原核表达系统;大肠杆菌;人乳头瘤病毒;疫苗;重组蛋白;宫颈癌
prokaryotic expression system; Escherichia coli; human papillomavirus; vaccine; recombinant protein; cervical cancer
人乳头瘤病毒(human papilloma virus,HPV)是一种脱氧核糖核酸(DNA)病毒,属于乳头瘤病毒科。HPV 通过皮肤或黏膜的微小创伤接触具有分化能力的基底层细胞后,依靠衣壳蛋白与受体的相互作用进入细胞内。随后,病毒基因组在衣壳蛋白L2 的协助下进入细胞核。低危型HPV 感染通常导致皮肤疣、口腔及喉部瘤和尖锐湿疣等疾病;HPV16、18 等其他高危型HPV的持续反复感染与宫颈癌的发生、发展密切相关。因此,开发有效的HPV 疫苗对于防控上述疾病具有重要意义。目前,全球共有6 种针对不同HPV 型别的预防性HPV 疫苗。这些疫苗可诱导人体产生免疫力以抵御70% 的生殖器疣和90% 的皮肤疣及癌症,比自然感染产生的免疫力更强,且对非疫苗型别也能产生一定的交叉保护作用。
基于衣壳蛋白L1 形成的重组病毒样颗粒(virus-likeparticle,VLP) 开发的HPV疫苗,由病毒结构蛋白组成。它模拟天然的病毒但缺乏病毒遗传物质,是疫苗中高度安全且有效的活性成分。目前已获批的基于VLP 开发的疫苗大多采用酵母、大肠杆菌、植物、昆虫和哺乳动物细胞系统进行生产。其中,原核表达系统特别是大肠杆菌,相较于昆虫和酵母等更具成本效益,成为全球疫苗开发的首选表达宿主。2010 年,有研究者证明了在重组大肠杆菌中大规模生产小鼠多瘤病毒VP1 五聚体蛋白的可行性,采用1L 大肠杆菌可得到克数级别的目的蛋白[1]。2019 年年底, 厦门大学携手万泰生物采用大肠杆菌表达系统研发的第一支国产HPV 二价疫苗在我国获批上市,为大肠杆菌应用于重组蛋白疫苗生产奠定了基础。此后,大肠杆菌表达的HPV 疫苗不断创新发展,越来越多免疫原性更强、保护性更广的新型疫苗出现在HPV 疫苗赛道上。本文总结了HPV 分子生物学和流行病学发展情况,回顾了大肠杆菌表达的HPV 疫苗的里程碑试验,并阐述了基于原核表达系统生产的HPV 疫苗的发展前景和面临的挑战,旨在为HPV 疫苗开发提供新思路。
1、 HPV 疫苗研发背景
1.1 基因组及编码蛋白
HPV 是一种小双链环状DNA 病毒,通过感染黏膜和皮肤组织引发各种良性和恶性病变。HPV 的基因组大小约为8kb[2],主要由3 个区域组成:① 上游调控区(upstream regulatory region,URR), 为非编码区,包含病毒的启动子、增强子和复制起点等重要调控元件,在病毒的复制和转录中发挥作用。②早期编码区(early region,ER),约占4kb,负责编码调节病毒基因组复制和转录的蛋白质,包括E1、E2、E4、E5、E6、E7 蛋白,其中E6 和E7 蛋白的持续表达可导致癌变。③晚期编码区(lateregion,LR), 约占3kb, 负责编码装配病毒粒子的主要衣壳蛋白L1 和次要衣壳蛋白L2,二者构成了T=7 正二十面体病毒衣壳结构。其中,L1 蛋白分子量约为55kDa,编码衣壳上5 个高度可变的Loop 环区(分别为BC、DE、EF、FG、HI), 环区包含L1 蛋白的大部分中和抗体表位。L1 蛋白可通过二硫键、离子键等相互作用自发组装成VLP,后者与天然病毒粒子结构高度相似,是HPV 疫苗的主要成分。L2 蛋白的分子量约为55kDa,目前其结构还未被完全解析。但有研究表明,L2 蛋白可与细胞表面受体相互作用,影响病毒的吸附、入胞和入核等过程。L2 蛋白在HPV 中高度保守,具有广谱中和表位,是新型预防性和治疗性疫苗的研发热点。
1.2 流行病学研究
HPV 感染会导致多种癌症,包括宫颈癌、肛门癌、口咽癌、外阴癌、阴茎癌、口腔癌、喉癌等。2020 年全球癌症统计数据[3]显示,宫颈癌是全球女性第四大常见癌症,也是全球女性癌症死亡的第四大原因。统计数据还显示,2020 年,全球新增宫颈癌病例约60.4 万例,因宫颈癌死亡病例数达34.2 万,死亡率约为56.62%。
HPV 可分为高危型和低危型。高危型HPV 包括HPV16、18 、31 、33 、35 、45 、52 、58 等型别。其中,HPV16 和HPV18 更为常见,与70% 的宫颈癌直接相关。各型别HPV 的总患病率约为31%(95%CI:27%~35%),其中高危型HPV的总患病率为21%(95%CI:18%~24%)。HPV16 是最常见的HPV 基因型(5%,95%CI:4%~7%),其次是HPV6(4%,95%CI:3%~5%)[4]。值得关注的是,大多数宫颈癌病例发生在中低收入国家。相关数据显示,宫颈癌在发展中国家和发达国家中的标化发病率分别为18.8/10万和11.3/10 万,标化死亡率分别为12.4/10 万和5.2/10 万[3]。
在全球细胞学检查正常的妇女中,HPV 的感染率约为10%。患病率最高的地区是撒哈拉以南非洲(24%),其次是拉丁美洲和加勒比(16%)、东欧(14%)和东南亚(14%)[5]。在全球范围内,宫颈癌发病年龄多分布在35 岁以下。随着年龄的增长,女性宫颈癌发病率呈下降趋势。然而,在45 岁及以上,女性感染HPV 的概率会达到第二高峰,该趋势在非洲、南美洲、北美洲以及欧洲地区尤为明显[6]。
在我国,宫颈癌病例数量逐年增多, 已成为女性健康的一大杀手。数据显示,2020 年我国宫颈癌新发病例数约为11 万,约占全球宫颈癌新发病例数的18.2%,仅次于印度(20.5%),位居全球第二。2020 年荟萃分析[7] 发现,在我国,HPV CIN1(宫颈上皮内瘤变1 级)中常见的HPV 型别依次为HPV52(20.31%)、HPV16(16.81%)、HPV58(14.44%)、HPV18(6.44%)、HPV53(5.76%)。HPV CIN2/3(宫颈上皮内瘤变2/3 级) 以HPV16(45.69%)为主,其次为HPV58(15.50%)、HPV52(11.74%)、HPV33(9.35%)、HPV31(4.34%)。此外,我国易感染宫颈癌的女性年龄阶段从以往集中于40~60 岁逐渐转移到15~44 岁,呈现出宫颈癌发病年龄逐渐年轻化的趋势。
1.3 HPV 疫苗的重要性
目前,HPV 感染途径主要包括性接触、母婴垂直传播、皮肤黏膜接触等。尽管90% 以上的人群在感染HPV 后可在自身免疫力的作用下清除大部分病毒,多数癌前病变也会自行消失,但在HPV 持续感染的情况下,癌前病变发展为浸润性癌症的风险大幅提高。目前宫颈癌是唯一一种可以预防的癌症, 女性从感染HPV 发展到罹患宫颈癌需要15~20 年。在整个过程中,针对宫颈癌的预防可分为三级。其中,第一级也是最重要的一级预防措施就是接种HPV 疫苗。及时接种HPV 疫苗能够针对不同型别HPV 提供免疫保护,从而预防相关疾病的发生,这是目前较为经济有效的防护措施。
1.4 HPV 疫苗的发展
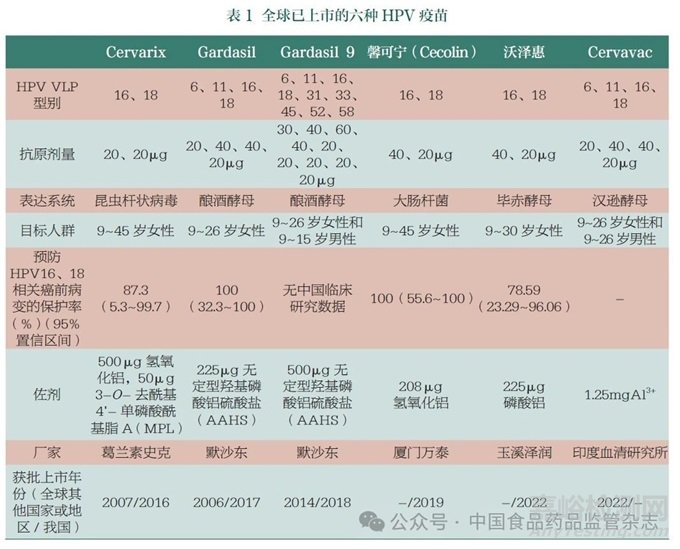
在20 世纪90 年代, 一系列动物实验表明,牛乳头瘤病毒可感染牛[8],而狗在接种福尔马林灭活病毒疫苗后可抵御犬口腔乳头瘤病毒的黏膜感染[9]。鉴于HPV 无法在体外培养基中生长,HPV 预防疫苗研制初期的主要挑战是寻找合适的HPV 抗原。在20 世纪90 年代初,有研究者成功表达出能够形成VLP 的PV L1蛋白;进一步研究发现,VLP 保护是特异性的,因此疫苗需要由多价VLP 构成[10]。1995 年的一项研究表明,接种VLPs 可保护家兔免于棉尾兔乳头瘤病毒感染[11]。随后又有研究发现,人体在接种HPV16 VLPs 后,血清免疫球蛋白G(IgG)会渗出进入生殖道,为宿主提供保护作用[12]。基于以上研究结果,有企业开发并测试了相关疫苗产品。2006 年,默克公司研发出针对HPV6、11、16、18 的四价疫苗Gardasil[13],该疫苗可预防约90% 的生殖器疣和70% 的宫颈癌。2007 年,葛兰素史克公司的针对HPV16、18 的二价疫苗Cervarix 上市[14],该疫苗可预防约70% 的宫颈癌。2014 年年底,默克公司又上市了针对HPV6、11、16、18、31、33、45、52 和58 的九价疫苗Gardasil 9[15]。临床试验表明,肌内注射这类预防性疫苗能产生高度的免疫原性[16-17],也能诱导产生特异性记忆B 淋巴细胞[18]。上述3 种疫苗均已获得美国食品药品监督管理局(FDA)和世界卫生组织(WHO)的许可,并已获批用于我国适龄女性人群。
然而,HPV 疫苗在我国的普及问题尚未完全得到解决。在我国,由于进口疫苗价格高昂且供应有限,以及对预防接种的认知程度仍有待提高,接种群体主要为18~45 岁女性, 而大部分9~14 岁的女性仍未接种疫苗。加之缺乏HPV 疫苗接种计划,HPV 引起的宫颈癌发病率和死亡率仍较高,疫苗接种和筛查的覆盖率较低。2020 年国际癌症研究机构的报告显示,2000~2016年,我国宫颈癌年发病率和死亡率均显著上升。其中,新发病例达109 741 例,占全球新发病例总数的18.2% ;死亡病例达59 060 例,占全球死亡病例总数的17.3%[19]。
目前,我国女性群体能够接种的商品化HPV 疫苗共有6 种,除了全球范围内使用的3 种HPV预防性疫苗外,我国国家药品监督管理局(NMPA)还批准了2种我国自主研发的二价HPV 疫苗(表1)。值得关注的是,2019年首个国产二价HPV 疫苗馨可宁(Cecolin) 的获批上市, 促进了我国及其他发展中国家HPV疫苗接种计划的推行。Cecolin采用了大肠杆菌表达系统,生产成本低、产量高,每剂售价约为Cervarix 价格的一半, 但保护率相似。据报道,Cervarix 和Cecolin 两种疫苗预防HPV16、18 相关6 个月持续性感染的保护率分别为96.8%(95%CI:88.0%~99.6%) 和97.7%(95%CI :86.2%~99.9%)。因此,Cecolin 的上市很好地解决了进口HPV 疫苗价格高昂且供应有限的问题。
2、 大肠杆菌表达的HPV疫苗研发主要进展
2.1 大肠杆菌表达系统概述
外源基因表达系统可分为真核表达系统和原核表达系统。真核表达系统包括昆虫杆状病毒表达系统、植物表达系统、酵母表达系统、哺乳动物细胞表达系统;原核表达系统主要为大肠杆菌表达系统。
大肠杆菌是一种革兰阴性细菌,属于肠杆菌科,是广泛应用于生产重组蛋白的宿主。目前,大肠杆菌已被开发出许多不同的菌株,其中B 和K-12 系列菌株常用来生产重组蛋白[20]。大肠杆菌K-12 系列菌株通常缺失表达rec A 重组酶、非特异性的核酸内切酶以及β- 半乳糖苷酶的部分基因,常用于DNA 克隆构建。而大肠杆菌B 系列菌株或B 系列与K-12 系列的杂交菌株通常不表达宿主蛋白酶,可用于外源表达重组蛋白。例如,大肠杆菌BL21 菌株是一种大肠杆菌B 系列与K-12 系列的衍生菌株,具有生长速度更快、乙酸积累量更低、重组蛋白表达水平更高、在纯化过程中蛋白降解更少等特性[21]。这些菌株缺乏可增加蛋白稳定性的蛋白酶Lon 和OmpT, 菌株BL21(DE3) 含有T7 RNA 聚合酶基因的染色体拷贝,可以在T7 启动子的控制下简单有效地表达基因[22]。而菌株Rosetta 和Rosetta(DE3) 携带pRARE质粒,其中编码氨基酰基tRNA合成酶的基因使得精氨酸(Arg)、异亮氨酸(Ile)、亮氨酸(Leu)、脯氨酸(Pro) 和甘氨酸(Gly)共表达[23],能有效促进含有罕见密码子的基因高频表达。
大肠杆菌作为一种常用的重组蛋白表达系统, 被广泛应用于疫苗研发, 如戊型肝炎疫苗益可宁(Hecolin)、B 型脑膜炎球菌疫苗Trumenba 和Bexsero、治疗性乙型肝炎疫苗HeberNasvac[24] 等。2018 年1月~2022 年6 月,在美国和欧盟批准的重组生物制药产品中,有67% 采用哺乳动物细胞,23%来自大肠杆菌,5% 来自酵母[25]。大肠杆菌具有较强的生物合成能力和分泌能力,能够高效表达蛋白质。此外,大肠杆菌表达系统的成本较低,生产规模化较为容易,因此被认为是一种理想的表达系统。大肠杆菌的主要优势在于其特征明确的基因组、已知的转录和翻译系统,以及易于遗传操作。这些特点允许构建大量的菌株突变体,因此可以根据异源蛋白质的性质和结构选择合适的表达菌株。此外,这些细菌能够在廉价的培养基中快速生长到高密度[26],且所有大肠杆菌表达菌株都不含致病剂。
2.2 大肠杆菌表达系统与HPV 疫苗研发
与真核表达系统相比,原核表达系统具有独特的优势。大肠杆菌是一种生长速度快、培养周期短、产量大、遗传背景清晰的优质重组蛋白表达宿主。将大肠杆菌应用于基因工程疫苗的研究中,有助于降低疫苗生产成本、简化制备过程,从而实现工业化生产,提高疫苗的可获得性。因此, 大肠杆菌表达系统在VLP疫苗的研发与生产方面具有巨大潜力。近年来,我国不断突破技术难关,成功上市多款基于大肠杆菌表达系统的基因工程疫苗。2012 年,厦门万泰联合厦门大学成功研发全球首个戊型肝炎疫苗益可宁并获批上市,开创了基于原核表达系统的VLP 疫苗技术体系的先河。随后,厦门大学团队与厦门万泰又于2019 年成功研制出基于大肠杆菌表达系统的HPV 疫苗馨可宁。这是第一支由发展中国家拥有完全自主知识产权而获得WHO 预认证(PQ)的宫颈癌疫苗,标志着我国成为继美国、英国之后世界上第3 个具备宫颈癌疫苗自主供应能力的国家。在Ⅰ 期和Ⅱ 期临床试验中,馨可宁显示了良好的安全性和免疫原性,其中HPV16 具有剂量依赖性。60μg 和90μg 中高剂量疫苗组的中和抗体几何平均滴度(GMT) 分别为10 548和12 505, 显著高于30μg 低剂量组(GMT=7596), 整体来说疫苗耐受性良好,没有出现疫苗相关严重不良反应[27]。Ⅲ期临床试验共入组7372 名18~45岁女性, 馨可宁在符合方案集(PPS)人群中对主要临床终点HPV16、18 相关的CIN2/3、宫颈原位腺癌(AIS)或对宫颈癌的保护效力为100.0%(95%CI :55.7%~100.0%), 高于或等于两个同类进口疫苗,且两种抗原可诱导强抗体反应并能够持续至少66 个月[28]。研究证明,9~14岁女性仅需接种两针该疫苗。使用大肠杆菌表达系统研发HPV疫苗是一条全新的技术途径,提供了经济实惠且高质量的疫苗选择,有助于HPV 疫苗在全球范围内进一步普及。根据肯尼亚[29]、莫桑比克[30] 和菲律宾[31] 的模型试验结果,在当前的商品化HPV疫苗中,馨可宁是净成本最低且最具经济效益的HPV 预防性疫苗。馨可宁已于2019 年12 月获得我国NMPA 批准,并于2020年5 月在我国境内(不包括港澳台地区)正式推行[32]。2021 年10 月, 该疫苗获得WHO 预认证[31,33]。截至2023 年3 月,该疫苗还获得了孟加拉国、摩洛哥、尼泊尔、泰国、刚果民主共和国和柬埔寨的上市许可[28,33]。
在现有的6 种HPV 疫苗中,只有四价和九价疫苗可以高效保护人体免于HPV6 和HPV11 感染。基于馨可宁的成功研发,厦门大学于2017 年进一步尝试使用大肠杆菌表达一种针对HPV6和HPV11 的双价疫苗。该疫苗抗原由HPV6 和HPV11 的L1截短蛋白组装而成的VLPs 构成,氢氧化铝作为佐剂。体内评价结果表明,该疫苗在猴子体内表现出与四价疫苗Gardasil 相当的中和效价并且能够产生相似的抗体谱。目前,该疫苗已在我国完成Ⅰ期和Ⅱ期临床试验[34]。
此外,厦门大学研制的第二代HPV 疫苗馨可宁9(Cecolin9)正处于Ⅲ期临床试验阶段,可预防HPV6、8、11、16、31、33、45、52、58 感染。研究表明,该疫苗在小鼠和非人类灵长类动物体内均显示出与Gardasil 9 相似的免疫原性;进一步研究发现,在接种该疫苗后,针对9 个HPV型别均能产生耐久性良好且高效的中和抗体[35]。Ⅰ期和Ⅱ期临床试验数据显示,HPV 九价疫苗在18~45 岁女性中具有良好的耐受性和免疫原性[36-37]。这意味着若馨可宁 9 上市,有望填补当前九价HPV 疫苗的市场空白。
据报道, 我国CIN1 患者中常见的HPV 型别依次为HPV52(20.31%)、HPV16(16.81%)、HPV58(14.44%)、HPV18(6.44%)、HPV53(5.76%)。其中,HPV53 感染率为3.87%~4.74%, 其在我国CIN 患者中的感染率排名第6,在CIN1 患者中的感染率排名第5[7]。从全球范围来看,不同型别的HPV 在不同国家和地区呈现出不同的流行情况,如高危型HPV35 在非洲和欧洲的流行率分别为3.4% 和1.4%。然而,目前市场上保护范围较广的HPV 预防性疫苗Gardasil 9 对HPV53 和HPV35 等高危型别无法达到理想的保护效果。因此,根据HPV基因型的流行和分布特点,开发预防HPV 感染的新疫苗具有重要意义。厦门大学于2017 年发表的研究确定了HPV 型别特异性的关键表位,其中HPV58 关键表位为D154、S168 和N170,HPV59 的关键表位为M267、Q270、E273、Y276、K278 和R283[38]。该研究将HPV 衣壳上参与病毒感染的区域缩小至几个关键氨基酸,提供了不同型别免疫机制分子层面的见解,为研制出更具有交叉保护效果的HPV VLP 打下了基础。
先前的研究表明,HPV16和HPV31 的L1 蛋白的FG 环上替换部分残基可以产生一种新的血清型[39]。为解决现有疫苗交叉保护率低的问题,2018 年, 厦门大学团队使用环区表位移植设计了包含HPV33、58、52 这3 种型别的嵌合VLPs[40],旨在不增加免疫颗粒数量和剂量的情况下提高HPV 疫苗对宫颈癌的保护率。研究者根据L1 蛋白的进化距离将20 种HPV 型别分为7 组,选取了亲缘关系最近的两个型别HPV58 和HPV33,分别以这两种型别的L1 蛋白作为骨架,移植另一种型别的五个环区之一构建了10 个双型别的嵌合VLPs。在性质鉴定后,选择H33-58HI 和H58-33BC两个能够产生与野生型HPV58和HPV33 相当中和效果的颗粒, 进一步尝试加入第3 个与HPV58、33 均为亲缘关系的型别HPV52。在评价抗HPV52 的中和效果后, 选定H33-58HI-52DE 、H33-58HI-52FG 、H58-33BC-52DE 和H58-33BC-52HI 这4个分子, 而其中只有H58-33BC-52HI 能够在小鼠和非人灵长类动物中引发与3 种野生型VLPs 混合后相当的中和抗体效应。该团队将此策略进一步推广,成功开发了其他5 种嵌合分子(HPV16/35/31、HPV56/66/53、HPV39/68/70[41]、HPV69/51/26[42]、HPV18/45/59),为研制包含全部致癌性HPV 型别的新一代预防性疫苗提供了可能性。
若能继续扩大单个HPV VLP的保护范围,便能够进一步降低疫苗剂量,提高保护效力,降低生产成本。2020 年,厦门大学团队围绕HPV 杂合体[43] 展开了研究,研究表明,在HPV VLP上相邻五聚体之间的Cys175 和Cys428 两个残基,能够通过氧化还原反应控制衣壳的组装、解聚过程。任何一个残基的突变都会抑制衣壳的组装。研究发现,当C175A 和C428A 两种突变五聚体可以杂合组装成VLPs 且摩尔比率相等时,组装效率最高。性质鉴定表明,杂合VLPs 性质与野生型VLPs 相似,且保持了与野生型同样高水平的免疫原性,并对其他未包含型别的HPV 具有轻微的交叉中和作用。这两种研发策略为广谱性HPV 疫苗的设计提供了全新的思路,旨在达到“以一防多”的目的。
我国女性HPV 感染型别分布情况表明,HPV58 是我国常见的HPV 型别之一。对此,康乐卫士于2020 年开发了一种重组三价HPV 疫苗,其中包含大肠杆菌表达的HPV16、18 和58型L1-VLP 抗原。疫苗型在恒河猴体内的GMT 均可达到105 以上;对非疫苗型HPV6、11、31、33、45 和52 也能产生一定的交叉保护效果[44]。目前,康乐卫士已完成三价和九价HPV 疫苗Ⅲ期临床试验入组,并已启动九价HPV 疫苗男性适应症Ⅰ期临床试验。目前,厦门大学团队采用嵌合分子的策略正在研制全球首个第三代宫颈癌疫苗(二十价),现已取得关键技术突破。
3、 大肠杆菌表达的HPV疫苗面临的挑战和发展前景
大肠杆菌表达系统成本低廉、增长迅速、易于生产,已被大量用于病毒蛋白、抗体片段、酶、脂类等多种生物产品的工业化生产。然而,与其他生物技术应用情况相同,大肠杆菌表达的HPV疫苗研发也面临着诸多挑战。
3.1 安全性问题
脂多糖(LPS) 也称内毒素,是几乎所有革兰阴性菌外膜外小叶的主要成分。其分子被脂质A 段锚定在外膜上,是哺乳动物中Toll 样受体4 和髓系分化因子2 介导的促炎活性的有效激动剂,高浓度可引起哺乳动物宿主的发热反应和感染性休克。大肠杆菌表达重组蛋白通常会引起内毒素污染,从产品的安全性考虑必须去除内毒素,但该过程非常困难且成本高昂。有研究者通过鉴定和编辑与LPS 合成途径相关的非生长必需基因(lpxL、lpxM、lpxP、eptA、pagP、kdsD、msbA 和gutQ)制备和表征了无内毒素大肠杆菌菌株,在沉默这些基因后,LPS 转化为脂质IVA并锚定在重组菌株的膜外,IVA并不会引发人类典型的细菌LPS化学型内毒素反应[45]。在纯化过程中,细菌表达的治疗性蛋白内毒素水平降低,因此安全性进一步提高。
在目前实验室规模上,质粒的稳定表达通常依赖于内含的抗性基因。然而,在大规模发酵中,质粒的快速复制会给细胞带来代谢负担,同时也会使质粒结构不稳定,导致发酵得到的蛋白质量参差不齐[46]。此外,抗生素的存在会对公众健康和环境产生很大的影响。对此,厦门大学团队成功构建了7 株LPS 缺陷的大肠杆菌整合染色体菌株,在生产过程中不需要使用抗生素,且与野生型菌株相比,其蛋白产物中残留的内毒素水平显著降低[47]。
3.2 生产效率问题
与真核表达系统相比,大肠杆菌缺乏翻译后修饰系统,可能会影响蛋白质折叠、空间构象及生物活性。折叠错误会导致大量重组蛋白表达在包涵体内。有研究者发现,温和增溶法可溶解包涵体聚集体,同时保留蛋白质的天然结构,因此将蛋白质重新折叠纯化可得到高回收率的具有生物活性的蛋白质[48]。在N 端融合MBP、GST 等高分子量的标签可促进靶蛋白的溶解度。目前,在大肠杆菌中可以通过共表达相应的酶来实现某些翻译后修饰。然而,这种共表达会影响大肠杆菌的生长速度,且多种载体难以在单一菌株中共表达。一种解决方案是将编码翻译后修饰因子的基因整合到基因组中,以创造“真核样”大肠杆菌。有研究者通过敲除大肠杆菌中编码O 端抗原连接酶的waaL 基因后,引入空肠弯曲菌N 端糖基化系统的关键酶PglB,将O 端多糖从脂质载体(焦磷酸烯丙烯酯)转移至受体蛋白,以达到在大肠杆菌中建立糖基化修饰系统的目的[49]。
目前,大肠杆菌表达系统已被广泛研究,但使用该系统进行蛋白质表达和纯化仍费时费力。因此,蛋白质的表达和纯化可逐步尝试采用并行和高通量的方法。对此,研究者们提出了一些有效的高通量蛋白质生产方法,包括通过商用机器人工作站, 如来自Labcyte(Sunnyvale,CA,USA)的Equator GX8 分配器,来自Genomic Solutions(AnnArbor,MI,USA)的MicroSys分配器[50] 等其他系统实现快速基因克隆至蛋白纯化;使用含有优化后的甘油、乳糖和葡萄糖培养基实现蛋白自诱导[51] 等。
综上所述,大肠杆菌表达系统在HPV 疫苗的生产上具备良好的发展前景,且将逐渐成为开发其他重组疫苗的主要技术平台之一。HPV 感染与相关癌症为全球带来了沉重的医疗负担,也成为人类生命健康的一大威胁。一方面,我们将继续致力于研发免疫原性更强、成本更低的广谱预防性疫苗。另一方面,蛋白和多肽疫苗、重组载体疫苗、核酸疫苗以及树突状细胞疫苗均在一定程度上具有免疫原性弱、个体差异性大等不足,相关问题亟待解决。个体化基因靶向治疗仍是未来疫苗接种计划和相关疾病治疗的主要方向,mRNA 和佐剂等方面新兴技术的出现也将推动疫苗开发和联合治疗方法持续发展。
引用本文
张姝玥,王致萍,顾蓉,李少伟,夏宁邵*.基于大肠杆菌表达系统的人乳头瘤病毒疫苗研发进展[J].中国食品药品监管.2023.12(239):42-49.