创伤和运动医学领域在医疗技术的演进中扮演着至关重要的角色。随着运动相关损伤和创伤性损伤的增加,这一领域的发展旨在寻求更有效、更精确的治疗方案,以满足患者的需求。
在过去几年中,创伤和运动医学取得了令人瞩目的进展,这些进展包括新的医疗技术、先进的手术工具和更精准的诊断方法。知名企业也在这一领域内努力创新,致力于推动医疗技术的边界。本文将对最新的FDA 510(k)审批项目进行回顾,探讨创伤和运动医学领域所取得的进步。文章中介绍的公司有三家是首次进入骨科FDA 510(k)认证市场。
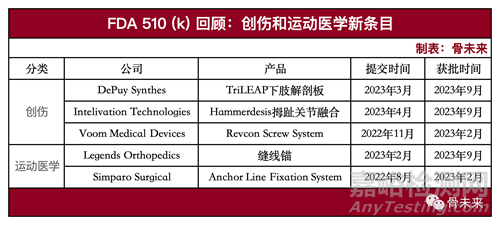
创伤
1.DePuy Synthes|TriLEAP下肢解剖板
TriLEAP™下肢解剖型骨板固定系统是一个全面的模块化手术专用系统,旨在满足骨科医生以及足部和脚踝专家的复杂需求。TriLEAP™系统提供了多种解剖型金属板和传统板,可以容纳多种螺钉直径,以及可以在骨骼和骨碎片的复位,内部固定和融合过程中使用的仪器。
该系统包括2.0mm、2.5mm、3.0mm、3.5mm和4.0mm非解剖型金属板和解剖型特定手术金属板、皮质螺钉和不同尺寸的可变角度锁定螺钉,将提供多种特定手术的选项,涵盖广泛的手术范围,为外科医生提供了多种术中决策选择,预计将于2024年在美国上市。
关于DePuy Synthes
DePuy Synthes是强生旗下的骨科公司,提供全面的骨科产品组合,有助于数百万患者的治愈和恢复运动。DePuy Synthes解决方案,除了 VELYS™ 数字手术产品组合外,还包括关节重建、创伤、四肢、颅颌面、脊柱外科和运动医学等专业领域,旨在推进患者护理,同时为全球医疗保健系统提供临床和经济价值。
2.Intelivation Technologies | Hammerdesis拇趾关节融合
Hammerdesis允许外科医生通过在患者的脚趾关节上固定独特设计的植入物来纠正拇趾外翻和退行性问题。在门诊手术环境中,它能够在术中节约大量时间和治疗成本。
该系统由旋转环植入物、恢复插销和与指骨的楔孔融合一起使用的K线组成。植入物有两种不同的尺寸,以适应不同的解剖结构。旋转环具有轴向尖刺,防止关节两侧在融合过程中旋转。
关于Intelivation Technologies
Intelivation Technologies是一家创新的医疗器械公司,拥有尖端的骨科产品组合,专注于颠覆性创新,目标是成为全球领先的骨科和脊柱技术公司。
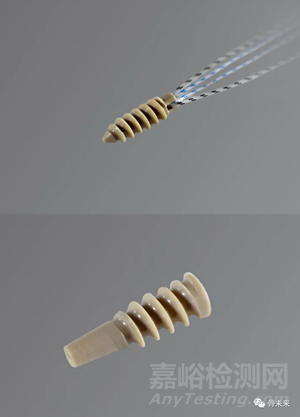
3.Voom Medical Devices | Revcon Screw System
Revcon™Anchor螺钉的推出,标志着微创拇囊炎手术迈出了重大的创新步伐,采用了Voom Medical Devices独有的无融合拇囊炎解决方案™,这是独一无二的单螺钉解决方案,具有双区间螺距。
Revcon Anchor和该公司的Bunionplasty手术解决方案于2022年十月全面商业化发布。Revcon Neutra v1.0和Revcon Anchor v2.0具有中性的、非压缩的螺距,旨在稳定骨段并支持骨愈合和再生。
关于Voom Medical Devices
Voom Medical Devices, Inc.成立于2017年,总部位于纽约的Voom Medical由外科医生创立,是一家快速发展的骨科医疗器械公司,主要专注于开拓创新的微创拇囊炎手术(MIBS)解决方案,促进外科手术创新,并确保患者护理的最高质量。
运动医学
1.Legends Orthopedics|缝线锚
Legends Orthopedics推出的5.5毫米缝线锚固件和2.9毫米缝线锚固件是用于软组织再附着手术的医疗器械。5.5毫米缝线锚固件适用于肩部、肘部、手腕/手部、脚部/踝部和膝盖,可用于多种手术,如旋转袖肌修复、跟腱修复和外侧稳定。而2.9毫米缝线锚固件也适用于类似手术,例如肩部Bankart修复、肱二头肌腱重建和膝盖外侧副韧带修复。这些锚固件为医生提供了灵活的选择,可用于一系列软组织再附着手术,促进了患者的治疗和康复。这些锚是Legends Orthopedics的首个骨科FDA 510(k)认证。该产品将于2024年4月开始在美国销售。
关于Legends Orthopedics
Legends Orthopedics是一家位于肯塔基州莱克星顿的研发阶段医疗器械制造商。公司为临床医生和企业家提供研究、设计、开发和推广产品的框架,目前正在设计缝线锚固件、干扰螺钉以及其他与运动医学相关的手术产品。
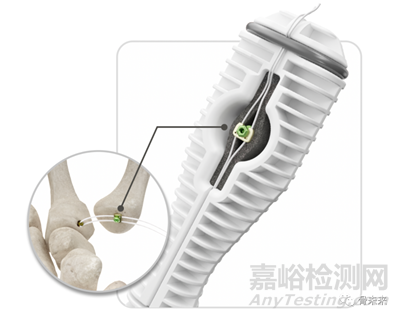
2.Simparo Surgical | Anchor Line Fixation System
Anchor Fixation System是Simparo的首个骨科FDA 510(k)认证,旨在用于骨到骨或软组织到骨固定时在韧带或肌腱修复区域分配缝线张力。Anchor Line Fixation System采用Falcon Suture Clutch Technology,为CMC悬吊成形术提供便利性和安全性。无需骨隧道或肌腱获取,仅需单个切口即可完成手术,使用钛锚固定,简化了缝线管理步骤。
Falcon Suture Clutch Technology(专有的紧缩和张力装置)使外科医生能够在较少步骤中进行CMC Suspensionplasty手术,并实现安全固定和无麻烦的缝线管理。这是一种可以调整线路和拉力的捆绑和张力系统,让外科医生能够舒适地并轻松地将张力施加到悬吊托带上,并在术中将张力锁定。
关于Simparo Surgical
Simparo Surgical成立于2013年,是一家在四肢外科领域的医疗器械公司,拥有四位合伙人,共拥有近90年的骨科器械设计、制造和商业化经验。其旗舰产品解决了影响1200多万美国人的问题,并且有望成为掌骨间关节(CMC)修复的新标准。