FDA官网中一个有关药物开发报告的实例,用以说明申请人如何实施质量源于设计(QbD)。 该实例的目的是说明ANDA申请人在其仿制药开发过程中实施QbD时,可使用的药物开发研究的类型,同时促进探讨OGD在审评中如何使用该信息。
本文主要概述了处方开发的案例2。
2.2.1.5 Formulation Development Study #2 处方开发研究#2
基于处方开发研究#1 的结果,暂定了内加辅料浓度。但是,硬脂酸镁在二元辅料相容性研 究中与 acetriptan 形成加合物有关(见 2.1.1.2 节)。该研究的目的是找出用于压片所需的外加 硬脂酸镁最小浓度并评估增加滑石粉是否可弥补硬脂酸镁的减少。处方开发研究#1 使用的 外加硬脂酸镁浓度为 1.0%。药用辅料手册中推荐的最小浓度为 0.25%。因此,在 0.3%~ 0.9%范围内研究外加硬脂酸镁浓度。滑石粉浓度相应地调整以保持使用两组分混合物 DOE 的总外加助流剂和润滑剂为 3.5%。
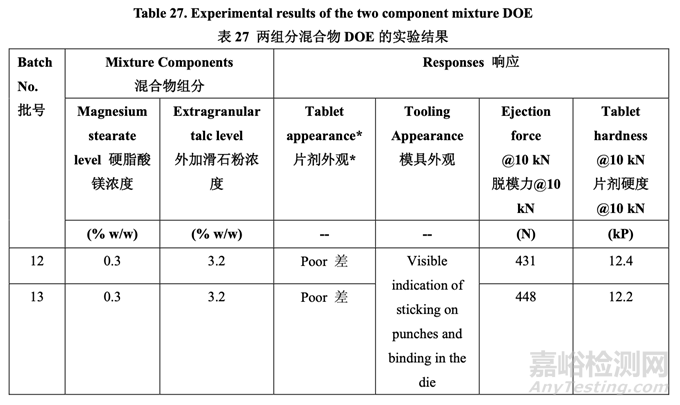
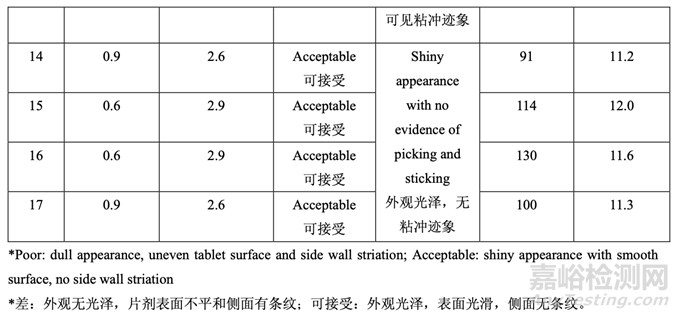
使用表 20 所列的碾压工艺参数生产了一批 5.0 kg 的颗粒。使用表 25 所示的处方制作颗粒。 然后该批颗粒分为 6 个亚批次,按照表 27 所示的组分加入不同数量的硬脂酸镁和滑石粉。 使用10 kN压缩力将最终混合物压制成片。固定压缩力(10 kN)下的片剂外观,模具外观, 片剂脱模力和硬度的实验结果(Y1, Y2, Y3 和 Y4, 其他响应未显示)见表 27。
Tablet and tooling appearance 片剂和模具外观
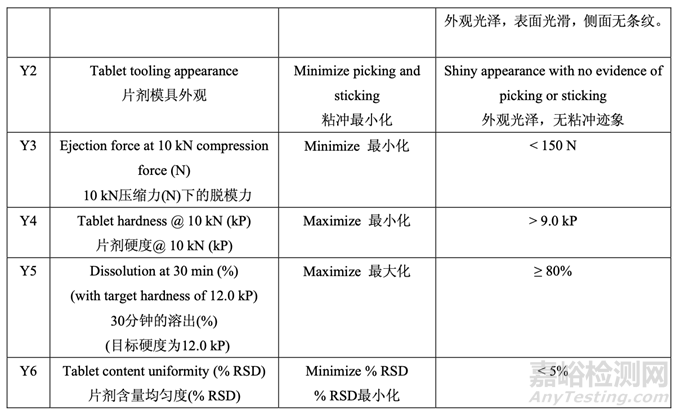
用 0.3%硬脂酸镁,观察到显著与压缩相关的问题,如片剂粘冲和侧面条纹。但是,用 0.6% 或更高的硬脂酸镁,片剂外观优美,未显示出粘附或粘连片剂模具。
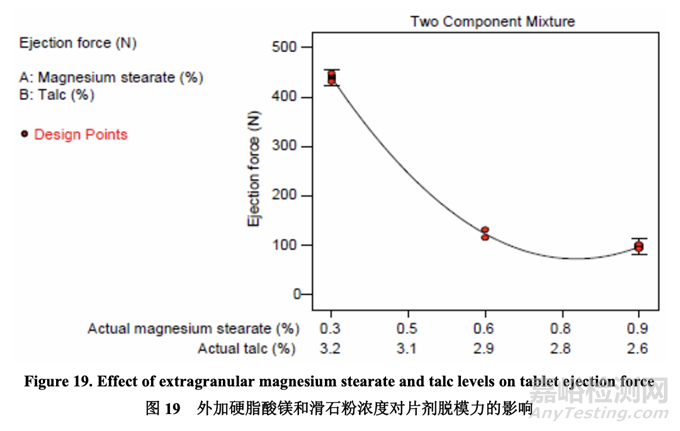
Ejection force 脱模力
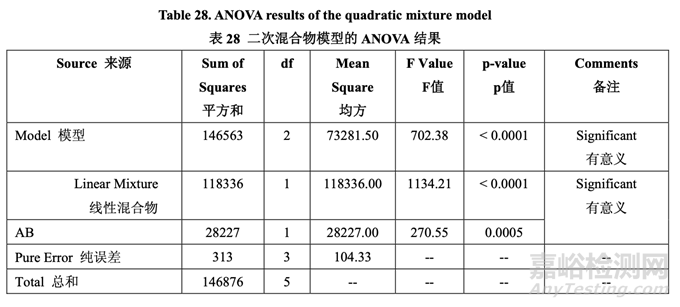
表28提供的ANOVA结果表明线性混合物组分和二次项(AB)是显著的。图19显示了混合物 组分对脱模力的影响。
用0.3%硬脂酸镁,观察到显著较高的脱模力:脱模力随硬脂酸镁增加而减少;但是,一旦 浓度为0.6%~0.9%,则影响可忽略不计。
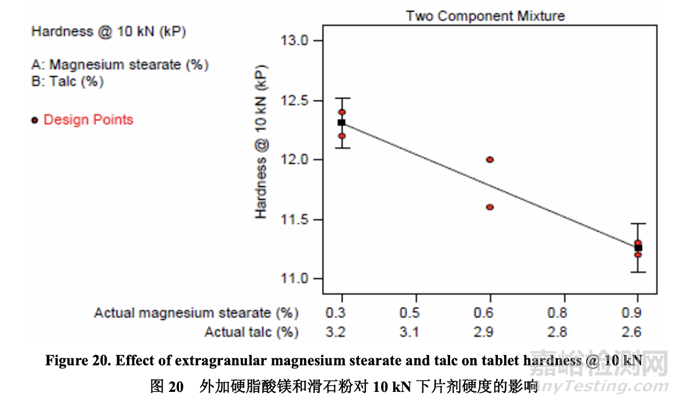
Tablet Hardness 片剂硬度
图 20 说明了混合物组分对片剂硬度的影响。压缩力固定为 10 kN 下,观察到片剂硬度随硬 脂酸镁增加而减少。
Dissolution and Content Uniformity 溶出和含量均匀度
所有片剂,即使硬度为12.0 kP的片剂,显示出可接受的溶出(> 85%,30 min)。含量均匀度 不是问题当每批的% RSD<3%时。因此,硬脂酸镁和滑石粉在研究的范围内显示出对片剂溶 出和含量均匀度无任何显著影响。
Summary of Formulation Development Study #2 处方开发研究#2的总结
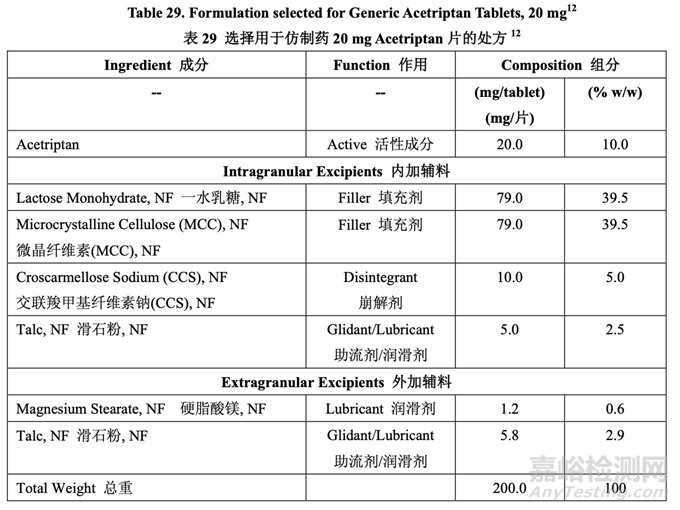
基于处方开发研究#2 的结果,外加硬脂酸镁和滑石粉浓度分别固定为 0.6%和 2.9%。
2.2.1.6 Formulation Development Conclusions 处方开发结论
基于处方开发研究#1 和#2,最终确定了处方组分。第一个研究最终确定了 MCC/乳糖比和崩 解剂浓度。第二个研究中,得出的结论是处方中需要最低浓度的硬脂酸镁以防止粘冲。通过 与滑石粉一起使用来降低处方中硬脂酸镁浓度。仿制药 20 mg Acetriptan 片的最终处方见表 29。
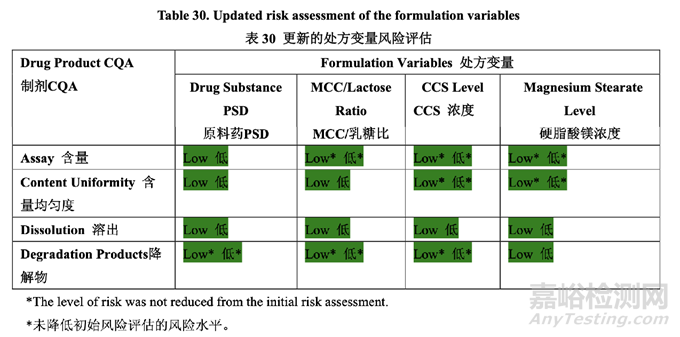
2.2.1.7 Updated Risk Assessment of the Formulation Variables 更新的处方变量风险评估
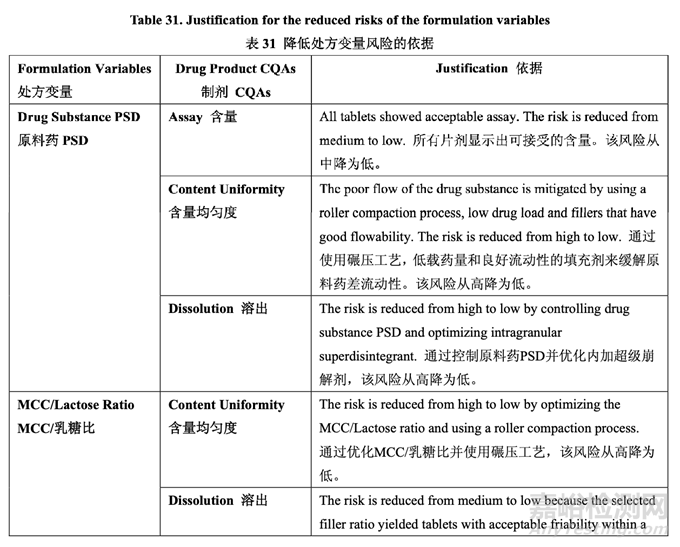
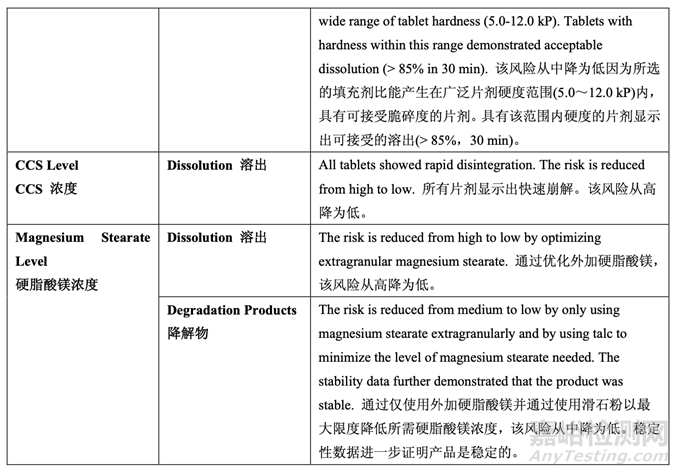
确定了高风险处方变量的可接受范围并包括在控制策略中。基于处方开发研究的结果,更新 了处方变量的风险评估,见表 30,依据见表 31。
2.2.2 Overages 过量投料
在仿制药20 mg Acetriptan片处方中未使用过量投料
2.2.3 Physicochemical and Biological Properties理化和生物学性质
对于溶出开发方法的讨论和中试生物等效性研究的结果,请参阅 1.4 节。
参考文献:
Example QbD IR Tablet Module 3 Quality 3.2.P.2 Pharmaceutical Development,FDA,2012.