您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-10-26 18:32
关注到新的分类规则的征求意见稿,我们再来会看一下第一类医疗器械产品禁止添加成分。原文摘取信息如下:
“第一类医疗器械产品目录中“09-02-03物理降温设备”“09-03-08光治疗设备附件”“14-10-02创口贴”“20-03-11穴位压力刺激器具”中的产品不能含有中药、化学药物、生物制品、消毒和抗菌成分、天然植物及其提取物等发挥药理学、免疫学、代谢作用的成分或者可被人体吸收的成分,包括但不限于下表所列成分。”
“备案时在产品描述项下应当详细列明产品的具体组成成分,不可使用“所含成分不具有药理学作用。所含成分不可被人体吸收”或者类似笼统描述。”
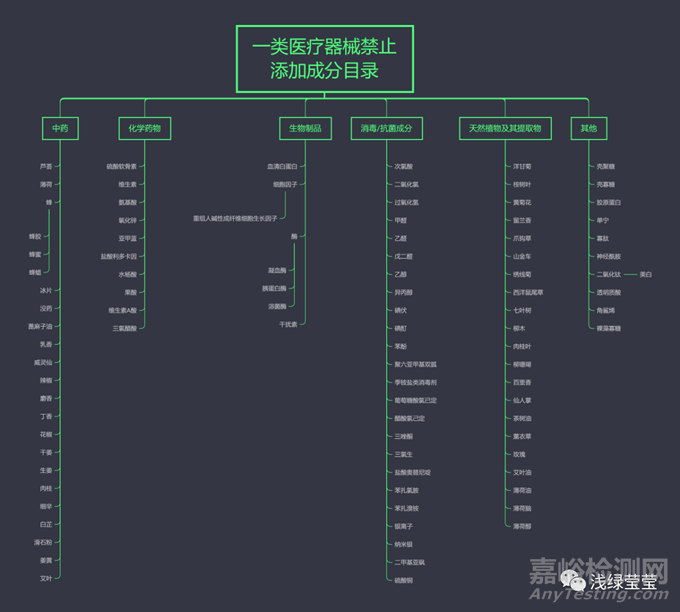
下面我从《医疗器械分类判定表》中分析理解:
一、 接触人体器械
仅有皮肤/腔道(口)暂时(<24小时)接触的侵入器械,重复使用手术器械,及其他无源器械,创伤/组织的暂时(<24小时)接触的重复使用器械。四种情况可以为一类备案管理。
结合第一类医疗器械产品禁止添加成分的“09-02-03物理降温设备”“09-03-08光治疗设备附件”“14-10-02创口贴”“20-03-11穴位压力刺激器具”的限定,其他相关产品,符合分类规则的产品,可以采用含有中药、化学药物、生物制品、消毒和抗菌成分、天然植物及其提取物等发挥药理学、免疫学、代谢作用的成分或者可被人体吸收的成分。还有个前提就是不要触碰其他不低于二类的规则,然后就是别触碰到药械组合。诸如16 眼科器械 ,17口腔器械, 18 妇产科、辅助生殖和避孕器械。再诸如一下,内置生理卫生棉类产品,添加一定的功能性成分,诸如抑菌、或者类似益母草啥的成分…… 再一次提醒, 产品设计时一定要注意各种限制哈,诸如暂时使用小于24小时。同类产品的替代,是要记为连续使用时长的,所以只能用小于24小时,另外的时间其他采取不载成分模式。 这类项目怎么样?
|
接触人体器械 |
||||||||||||
|
无源医疗器械 |
使用状态
使用形式 |
暂时使用 |
短期使用 |
长期使用 |
||||||||
|
皮肤
/腔道
(口) |
创伤
/组织 |
血循环
/中枢 |
皮肤
/腔道
(口) |
创伤
/组织 |
血循环
/中枢 |
皮肤/腔道
(口) |
创伤
/组织 |
血循环
/中枢 |
||||
|
1 |
液体输送器械 |
Ⅱ |
Ⅱ |
Ⅲ |
Ⅱ |
Ⅱ |
Ⅲ |
Ⅱ |
Ⅲ |
Ⅲ |
||
|
2 |
改变血液体液器械 |
- |
- |
Ⅲ |
- |
- |
Ⅲ |
- |
- |
Ⅲ |
||
|
3 |
医用敷料 |
- |
Ⅱ |
Ⅱ |
- |
Ⅱ |
Ⅱ |
- |
Ⅲ |
Ⅲ |
||
|
4 |
侵入器械 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅱ |
Ⅱ |
Ⅲ |
- |
- |
- |
||
|
5 |
重复使用手术器械 |
Ⅰ |
Ⅰ |
Ⅱ |
- |
- |
- |
- |
- |
- |
||
|
6 |
植入器械 |
- |
- |
- |
- |
- |
- |
Ⅲ |
Ⅲ |
Ⅲ |
||
|
7 |
辅助生殖和避孕器械(不包括重复使用手术器械) |
Ⅱ |
Ⅱ |
Ⅲ |
Ⅱ |
Ⅲ |
Ⅲ |
Ⅲ |
Ⅲ |
Ⅲ |
||
|
8 |
其他无源器械 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅱ |
Ⅱ |
Ⅲ |
Ⅱ |
Ⅲ |
Ⅲ |
||
|
有源医疗器械 |
使用状态
使用形式 |
轻微损伤 |
中度
损伤 |
严重损伤 |
||||||||
|
1 |
能量治疗器械 |
Ⅱ |
Ⅱ |
Ⅲ |
||||||||
|
2 |
诊断监护器械 |
Ⅱ |
Ⅱ |
Ⅲ |
||||||||
|
3 |
液体输送器械 |
Ⅱ |
Ⅱ |
Ⅲ |
||||||||
|
4 |
电离辐射器械 |
Ⅱ |
Ⅱ |
Ⅲ |
||||||||
|
5 |
植入器械 |
Ⅲ |
Ⅲ |
Ⅲ |
||||||||
|
6 |
其他有源器械 |
Ⅱ |
Ⅱ |
Ⅲ |
||||||||
二、 非接触人体器械
非接触人体,那些发挥药理学、免疫学、代谢作用的成分或者可被人体吸收的成分,我想是没有添加的意义了。
|
非接触人体器械 |
|||||
|
无源医疗器械 |
使用状态
使用形式 |
基本不影响 |
轻微影响 |
重要影响 |
|
|
1 |
护理器械 |
Ⅰ |
Ⅱ |
- |
|
|
2 |
医疗器械清洗消毒器械 |
- |
Ⅱ |
Ⅲ |
|
|
3 |
其他无源器械 |
Ⅰ |
Ⅱ |
Ⅲ |
|
|
有源医疗器械 |
使用状态
使用形式 |
基本不影响 |
轻微影响 |
重要影响 |
|
|
1 |
临床检验器械 |
Ⅰ |
Ⅱ |
Ⅲ |
|
|
2 |
独立软件 |
- |
Ⅱ |
Ⅲ |
|
|
3 |
医疗器械消毒灭菌设备 |
- |
Ⅱ |
Ⅲ |
|
|
4 |
其他有源器械 |
Ⅰ |
Ⅱ |
Ⅲ |
|

来源:浅绿莹莹


