在非无菌药品生产过程和有效期内控制微生物水平和种类,对保证非无菌药品质量和患者安全至关重要,非无菌药品中如存在不可接受微生物,有可能降低药品的疗效,影响药品质量,对消费者健康有潜在风险。所以药品注册中,需药品生产企业建立微生物风险识别和控制策略,笔者结合微生物相关法规和指南,整理分享了非无菌药品注册检验中微生物检验项目相关考量,欢迎大家一起交流学习这个主题。
一、药品微生物检验的法规和指南依据知多少?
药品的微生物限度检查是涉及药品质量和安全的重要项目,中美药品相关监管机构陆续发布法规和技术指南,要求对非无菌产品污染微生物进行控制,期望减少不可接受微生物对产品质量以及患者安全带来的风险,确保产品有效性和安全性。笔者整理分享如下表:
|
|
|
|
|
《中国药典》三部/四部《1105 非无菌产品微生物限度检查:微生物计数法》 |
|
|
《中国药典》三部/四部《1106 非无菌产品微生物限度检查:控制菌检查法》 |
|
|
《中国药典》三部/四部《1107 非无菌药品微生物限度标准》 |
|
|
《中国药典》三部/四部《9201 药品微生物检验替代方法验证指导原则》 |
|
|
《中国药典》三部/四部《9203 药品微生物实验室质量管理指导原则》 |
|
|
《中国药典》四部《1108 中药饮片微生物限度检查法》 |
|
|
|
|
|
|
|
|
《中国药典》四部《9201 药品微生物检验替代方法验证指导原则》 |
|
|
|
|
|
《中国药典》四部《9205 药品洁净实验室微生物监测和控制指导原则》 |
|
|
CDE《非无菌化学药品及原辅料微生物限度研究技术指导原则(试行)》(2023年2月21日) |
|
|
美国FDA“Microbiological Quality Considerations in Non-sterile Drug Manufacturing”(非无菌药品生产中的微生物质量考量)(2021年9月草案) |
|
|
USP通则<60>非无菌产品的微生物学检验-洋葱伯克霍尔德菌属试验 MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS—TESTS FOR BURKHOLDERIA CEPACIA COMPLEX |
|
|
USP通则<61>非无菌产品的微生物检验:微生物计数试验microbiological examination of nonsterile products: microbial enumeration tests |
|
|
USP通则<62>非无菌产品的微生物学检验-控制菌检验 MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS TESTS FOR SPECIFIED MICROORGANISMS |
|
|
USP通则<610>非无菌吸入和鼻用产品的微生物取样替代方法 ALTERNATIVE MICROBIOLOGICAL SAMPLING METHODS FOR NONSTERILE INHALED AND NASAL PRODUCTS |
|
|
USP通则<1111> 非无菌产品微生物检查法: 药品及药用原料的微生物限度标准 (Microbiological Examination of Nonsterile Products: Acceptance Criteria for Pharmaceutical Preparations and Substances for Pharmaceutical Use) |
|
|
USP 通则<1115>非无菌药用原料和药品的生物负载控制(Bioburden Control of Non-sterile Drug Substances and Products) |
二、非无菌药品注册检验中微生物检验项目常见问题?
非无菌药品注册检验中,非无菌制剂及原料的微生物限度检查,由于检验目多(涉及需氧菌总数、霉菌及酵母菌总数以及多种类型的控制菌检查)、标准限值设定要求高和检验方法灵活多样等等,因此在注册阶段存在较多问题。在微生物相关群及讲座中有药友分享的几个注册检验中涉及微生物项目的发补问题,比较有代表性,分享如下:
(1)申报资料未提供非无菌化学药品的微生物限度控制策略。
(2)申报单位提供了本品【申报质量标准】,【检验方法】和【检验报告】,但未提供本品【微生物限度的方法适用性报告】。
(3)在注册批次稳定性关键时间点和稳定性末期未进行微生物限度检查。
(4)【申报质量标准】附件和【分析方法】中控制菌项目不一致,前者为金黄色葡萄球菌,铜绿假单胞菌,大肠埃希菌和洋葱伯克霍尔德菌群,后者仅为金黄色葡萄球菌,铜绿假单胞菌,请确认最终检查项目。
(5)【申报质量标准】“微生物限度”项符合中国药典,但【方法适用性资料】中所用试验菌菌株与中国药典规定不一致。
(6)【方法适用性资料】需氧菌总数计数回收试验不充分,未进行白色念珠菌及巴西曲霉在胰酪大豆琼脂培养基(SCDA)中的回收试验。
(7)【申报质量标准】“微生物限度”项和【检验报告】中检验项目为:需氧菌总数,霉菌和酵母菌总数,金黄色葡萄球菌,铜绿假单胞菌,大肠埃希菌,沙门菌,白色念珠菌,但【方法适用性资料】较上述检验项目增加了耐胆盐革兰阴性菌(定性检验),请确认最终检查项目。
(8)根据【检验方法】不能得到【检验报告】中的计数结果。
三、如何建立非无菌药品微生物控制策略?
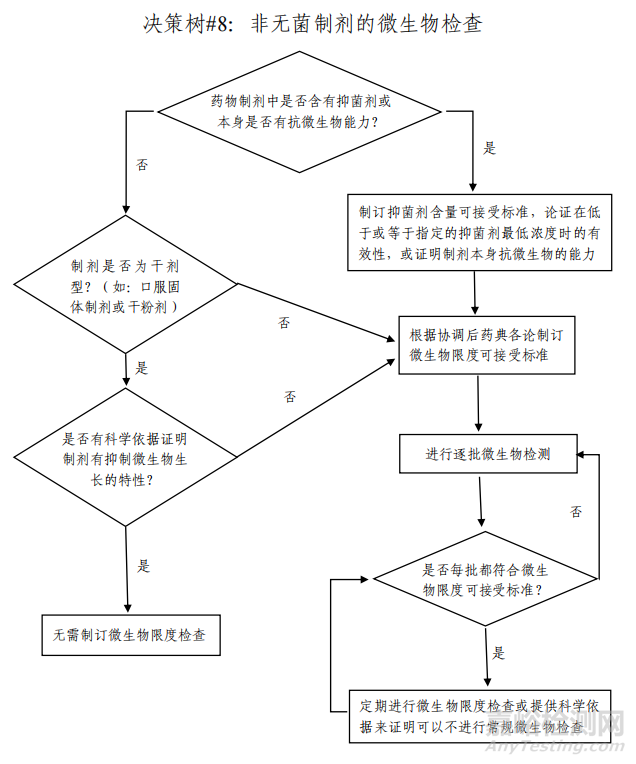
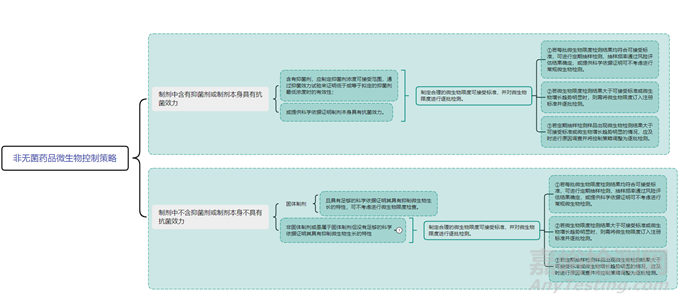
对于非无菌药品,微生物限度是反映产品安全性和质量可控性的重要指标之一。非无菌药品微生物限度研究应基于风险评估,风险评估需综合考虑产品特点、组成成份、生产工艺、车间环境、设备清洁状态、人员素质、最差生产条件、历史数据及趋势等因素,参考 ICH Q6A 决策树#8(非无菌制剂的微生物限度检查)(见图1),制定企业自己产品的微生物限度控制策略(见图2)。
▲图1-ICH Q6A 决策树#8(非无菌制剂的微生物限度检查)
▲图2-非无菌药品微生物控制策略图
参考文献
[1]中国药典、USP官网、NMPA及CDE文章、注册圈等公众号文章