今日头条
远大复方鼻喷剂鼻炎III期临床成功。远大医药创新产品Ryaltris复方鼻喷剂(GSP 301 NS,盐酸奥洛他定/糠酸莫米松)用于治疗季节性过敏性鼻炎(SAR)的III期临床(GSP 301-308)达到主要终点。结果显示,GSP 301 NS组、Patanase NS组和内舒拿NS组治疗14天期间受试者自评的上午和下午12小时rTNSS平均值较基线变化的最小二乘均值分别为-3.84、-2.58和-3.35,GSP 301 NS疗效评分均优于单方原研制剂Patanase NS和内舒拿NS。产品的安全性良好。
国内药讯
1.迪哲JAK1抑制剂报产。迪哲医药高选择性JAK1抑制剂戈利昔替尼的上市申请获CDE受理,用于治疗复发/难治性外周T细胞淋巴瘤(r/r PTCL)。今年公布于ASCO2023年会上的国际临床(JACKPORT8 Part B)积极数据显示,独立评审委员会(IRC)评估的ORR达44.3%,完全缓解率为23.9%。2022年,FDA已授予戈利昔替尼治疗r/r PTCL的快速通道资格。
2.科越C5/FH1-5补体抑制剂早期临床积极。科越医药C5/FH1-5双靶点补体抑制剂KP104在ICW2023大会上公布其I期临床以及临床前的研究成果。KP104可选择性地同时靶向补体旁路途径和末端途径。I 期试验数据支持进一步开展KP104用于补体介导疾病的临床试验,包括阵发性睡眠性血红蛋白尿症(PNH),IgA肾病(IgAN)和C3肾小球病(C3G)在内的肾脏疾病和继发于系统性红斑狼疮的血栓性微血管病(SLE-TMA)。
3.BI创新MDM2-p53拮抗剂获批实体瘤临床。勃林格殷格翰MDM2-p53拮抗剂brigimadlin(BI 907828)获国家药监局批准开展IIa/IIb期临床(Brightline-2),用于治疗局部晚期/转移性、MDM2扩增、TP53野生型胆道腺癌、胰腺导管腺癌或其他选定实体瘤患者。BI 907828旨在通过阻止MDM2-p53的相互作用,以恢复p53的转录活性,从而可介导肿瘤细胞凋亡。去年10月,该新药已在中国开展一线治疗去分化脂肪肉瘤(DDLPS)的国际Ⅱ/Ⅲ期临床。
4.艾伯维JAK1抑制剂中国获批斑秃临床。艾伯维口服JAK1抑制剂乌帕替尼片获国家药监局批准开展用于重度斑秃的临床试验。这是全球首款获批上市的JAK1抑制剂,已于2022年2月获批进口中国,目前已在中国获批5种适应症,包括特应性皮炎、类风湿性关节炎、银屑病关节炎、溃疡性结肠炎以及克罗恩病。据悉,该产品在2021年和2022年销售额分别达到16.51和25.22亿美元。
5.康德赛个体化肿瘤疫苗获批卵巢癌临床。四川康德赛1类生物制品“CUD002注射液”获国家药监局临床许可。CUD002是一种个体化的肿瘤疫苗,根据患者独特的突变信息定制设计并制造,适用于卵巢癌,可作为肿瘤切除后的辅助治疗。该产品通过对mRNA结构的改造和设计,使得mRNA更稳定并具有更优的表达性能,将mRNA导入DC细胞中,可以有效避免mRNA疫苗稳定性不足的缺点。
6.英派PARP1抑制剂美国获批临床。英派药业自主研发的PARP1选择性抑制剂IMP1734获FDA批准开展Ⅰ期临床研究。临床前研究显示,IMP1734具有良好的抗肿瘤活性和较宽的治疗窗口;单药或与其他药物联合治疗均显示出强大的抗肿瘤疗效。今年6月,Eikon公司已获得IMP1734除大中华区以外所有区域内独家开发、生产和商业化的权利。
国际药讯
1.Madrigal公司THR-β激动剂获优先审评资格。FDA受理Madrigal公司口服选择性甲状腺激素受体(THR)-β激动剂resmetirom治疗伴有肝纤维化的非酒精性脂肪性肝炎(NASH)成人患者的新药申请(NDA),并授予优先审评资格,预计明年3月14日前完成审评。在Ⅲ期临床中,接受剂量为100 mg的resmetirom治疗52周后,患者肝脏脂肪水平平均降低51%;肝纤维化、肝脏体积和脾脏体积也显著降低。今年4月,该新药已被FDA授予突破性疗法认定。
2.Alnylam公司RNAi疗法新适应症获FDA专家支持。FDA心血管和肾脏药物咨询委员会(CRDAC)推荐批准Alnylam公司RNAi疗法patisiran(商品名:Onpattro)的补充新药申请(sNDA),用于治疗转甲状腺素蛋白介导(ATTR)淀粉样变性心肌病。在Ⅲ期临床中,patisiran治疗组患者的6分钟行走检测结果较基线的变化显著优于对照组。此前,该新药已被FDA批准上市,用于治疗患有hATTR淀粉样变性引起的多发性神经病。
3.Sumitomo公司肾上腺素能受体激动剂Ⅲ期临床积极。Sumitomo公司β3肾上腺素能受体激动剂vibegron(Gemtesa)治疗因良性前列腺增生(BPH)而接受药物治疗的膀胱过度活动症(OAB)患者的Ⅲ期临床(URO-901-3005)达到共同主要终点和所有次要终点。第12周时,与安慰剂组相比,vibegron治疗组与基线相比(最小二乘均值)每日减少的排尿次数(-2.04 vs -1.30 ,p<0.0001)和尿急发作次数(-2.88 vs -1.9,p<0.0001)显著改善。Gemtesa安全性与既往研究一致。
4.莫德纳流感mRNA疫苗新制剂Ⅲ期临床成功。莫德纳在研发日活动上透露,季节性流感疫苗mRNA-1010新制剂在Ⅲ期临床P303中达到所有主要终点。与流感灭活疫苗Fluarix相比,mRNA-1010对于四种亚型A/H1N1、A/H3N2、B/Yamagata、B/Victoria均达到更高的血凝抑制分析(HAI)滴度。此外,在与赛诺菲Fluzone头对头的Ⅰ/Ⅱ期临床中,mRNA-1010对A/H1N1、A/H3N2、B/Victoria达到了更高的HAI滴度,对B/Yamagata达到了可比的HAI滴度。
5.Valneva/辉瑞莱姆病疫苗Ⅱ期临床积极。Valneva公司与辉瑞联合开发的莱姆病(Lyme disease)候选疫苗VLA15用于加强接种的Ⅱ期临床VLA15-221结果积极。VLA15涵盖六种表达于伯氏疏螺旋体上的OspA血清型。结果显示,5-11岁儿童、12-17岁青少年以及18-65岁成人加强接种VLA15一个月后,所有年龄组均对所有血清型产生强烈的抗原抗体反应,所有OspA血清型的血清转换率(SCR)为95.3%和94.6%;而且OspA抗体滴度也显著提高;疫苗的安全性与之前研究一致。
6.IL-17A抑制剂汗腺炎IIb/III期研究失败。ACELYRIN公司IL-17A融合蛋白拮抗剂izokibep治疗中重度化脓性汗腺炎 (HS) 的IIb/III期试验B部分未达到主要终点。16周治疗数据显示,每周接受izokibep治疗的患者达到HiSCR75改善的比例为39%,而每两周接受izokibep治疗的患者这一数值为34%,安慰剂组为29%,没有实现统计学意义上的改善。创响拥有该新药的大中华区及韩国的商业化权益。
医药热点
1.我国将推进医保基金智能审核和监控工作。9月13日,国家医保局发布《关于进一步深入推进医疗保障基金智能审核和监控工作的通知》。《通知》明确,聚焦医疗保障基金智能审核和监控知识库、规则库建设,到2023年底前全部统筹地区上线智能监管子系统,初步实现全国智能监控“一张网”。到2025年底,规范化、科学化、常态化的智能审核和监控体系基本建立,“两库”建设应用、智能审核、反欺诈大数据智能监测分析更加成熟完善。
2.广东省生殖医院优化MDT门诊。为改善患者就医体验,广东省生殖医院在此前推出午间门诊、全天候线上免费问诊、专家团队号、多学科联合会诊(MDT)门诊等多项服务的基础上,近期对MDT诊疗模式进一步优化,分别推出生殖医学中心、男科、妇科、优生遗传、生殖免疫主导的MDT门诊号,患者可以结合自己的主要问题,挂相应的号,让多学科联合诊疗在全面的基础上更具针对性。MDT门诊由多个不同科室的专家共同出诊,避免患者辗转多个科室看病,提高就诊效率。
3.我国部分口腔医疗项目将纳入医保。9月11日,国家卫健委发布《关于进一步推进口腔医疗服务和保障管理工作的通知》,主要包含了口腔医疗耗材采购供应、服务价格治理、医保政策等6个方面。在优化医疗服务价格及医保政策方面,《通知》指出:在基金可承受的基础上,将符合条件的治疗性医疗服务项目和医用耗材按程序纳入基本医保支付范围。支持鼓励商业保险积极发挥作用,减轻群众经济负担。
评审动态
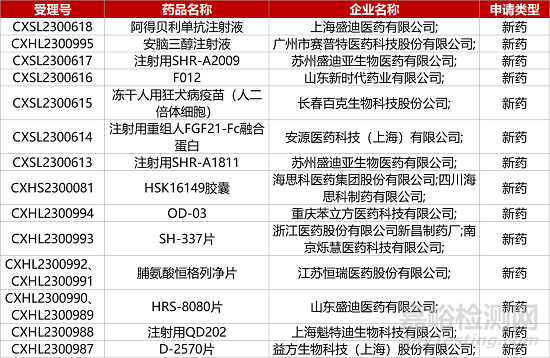
1. CDE新药受理情况(09月13日)
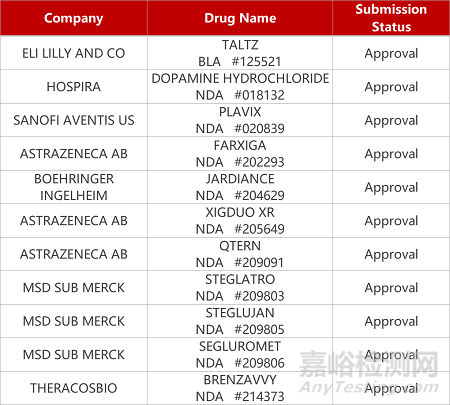
2. FDA新药获批情况(北美09月13日)