医疗器械分类
第一类风险程度低,实行常规管理可以保证其安全、有效的医疗器械。仅需备案管理。
第二类具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。需要申报注册。
第三类具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。需要申报注册。
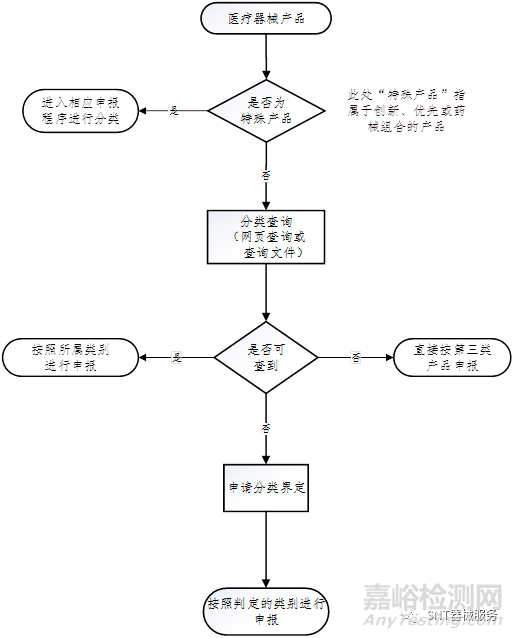
医疗器械类别的判定途径
1. 网页查询
进入"国家药监局网站—医疗器械"栏——点击医疗器械查询——点击医疗器械分类目录。
2. 查询文件下载《医疗器械分类规则》《医疗器械分类目录》《体外诊断试剂分类规则》《体外诊断试剂分类子目录(2013版)》《第一类医疗器械产品目录》或搜索相关分类界定文件等进行查询。
3. 申请分类界定
境内产品向当地省局提交申请,进口产品向医疗器械标准管理研究所提交申请。具体可参照《医疗器械分类界定申请资料填报指南》。
4. 同第三类申报
可直接按第三类医疗器械产品申报,器审中心根据申报产品的实际情况判定类别。
5. 创新,优先,药械组合
属于创新、优先或药械组合的产品在办理进入相应流程后,可随即进行产品类别判定。
参考流程如下:
新版《医疗器械分类目录》自2018年8月1日开始实施,请根据相关要求进行分类工作。