摘 要 / Abstract
计算机建模与仿真在提升药物研发效能、创新监管科学发展中具有重要意义。本文首先从战略视角分析了计算机建模与仿真在全球主要国家和地区的监管科学发展中的战略地位,剖析了其在药物研发与监管科学发展中的战略意义。其次,本文以“科学界针对各种应用场景开发有价值的建模仿真科学工具,监管机构将有价值的科学工具转变为有价值的监管科学工具,并形成更多数字化证据的运行机制”为牵引,对近期全球的创新探索进行了分类总结。最后,为了推动我国计算机建模与仿真在监管科学、医药研发中深化应用,提出了面向未来的行动建议,即加快弥合跨学科思维方式差异,打造虚拟临床试验样板,建立中国的应用场景清单,促进有价值的科学工具转变为有价值的监管科学工具。
Computer modeling and simulation is of great significance in improving the efficiency of drug research and development and fostering innovation in regulatory science. This paper first analyzes the strategic position of computer modeling and simulation in the development of regulatory science across major countries and regions globally from a strategic perspective, shedding light on the strategic significance in drug research and development and regulatory science. Secondly, the paper classifies and summarizes recent global innovative explorations using computer modeling and simulation. The classification and summary are based on the concept of "the scientific community developing valuable modeling and simulation tools for various application scenarios, while regulatory agencies turn those tools into valuable regulatory scientific resources, thus establishing an operational mechanism for digital evidence". Finally, in order to promote the wider application of computer modeling and simulation in China and guide the rapid development of pharmaceutical research and development, this paper puts forward future-oriented action suggestions. These include expediting the bridging of interdisciplinary thinking gaps, building a prototype of virtual clinical trials, establishing a list of demand scenarios specific to China, and facilitating the transformation of valuable scientific tools into valuable regulatory scientific resources.
关 键 词 / Key words
监管科学 ;计算机建模与仿真 ;虚拟临床试验
regulatory science; computer modeling and simulation; virtual clinical trial
以计算机建模与仿真引导医药研发已经是一种全球共识的战略选择。计算机建模与仿真能够通过提供不同于实验和理论提供的观点,通过精确的数字化模型生成的数字化证据来解锁生物系统,服务于医药研发。人工智能已经是新一轮产业变革的核心驱动力。各国都在探索以人工智能技术为核心的计算机建模与仿真的新路线。以人工智能为代表的新一代信息技术与生命科学深入融合的趋势越来越明显,为复杂疾病的治疗和精准模型的开发带来了新的希望。其生成的数字化仿真模型在预测安全性、优化临床试验设计等各方面都展示出了潜力与价值。
如何将计算机建模与仿真技术转化为有价值的监管科学工具、药物研发工具,需要清晰的战略布局,需要在最佳实践基础上探索出切实可行的评估机制、监管标准。监管科学的创新发展是一项全球性议题。监管机构间相互分享经验和最佳实践非常重要。为此,本文总结分析了全球范围内主要国家和地区的计算机建模与仿真技术在监管科学发展中的战略地位、运行机制、最佳实践,并在此基础上提出了我国监管科学创新发展的几点思考。
1、战略选择
1.1 以计算机建模与仿真引导医药研发已经是一种全球共识的战略选择
近几十年各国不断努力将计算机建模与仿真纳入药物发现、开发、设计和优化过程中。欧盟、美国、中国的药品监管机构接受并鼓励在监管过程中使用计算机建模与仿真。计算机建模的方法已被证明可以减少药物成本和时间,也可以促进新药的开发过程。药物计量学模型,如群体药代动力学(PK)、药代动力学/药效动力学(PK/PD)和生理药代动力学(PBPK),越来越多地被制药公司使用,并被监管部门批准在药品审批申请条件中替代临床试验[1]。
近十年来,计算机建模与仿真的战略地位显著提升。计算机方法有潜力在科学和医疗创新中创造一场革命。在监管评估中逐步采用计算技术是迈向制药业成功的新技术革命时代[1]。具体来说,可以从各国的战略规划中找到证据。
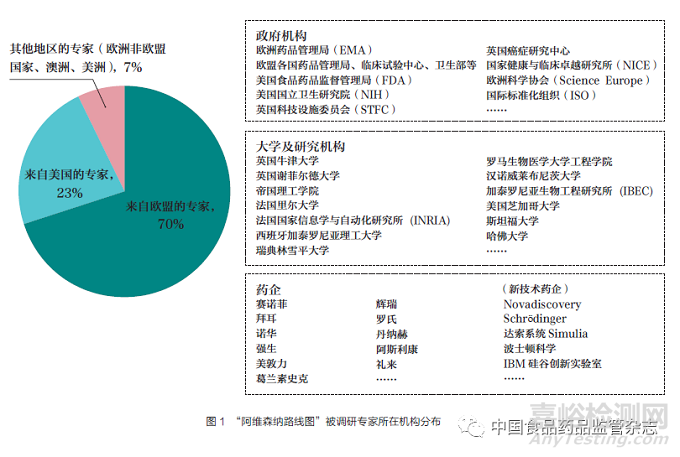
2015年,欧盟发布“阿维森纳路线图”作为利用计算机模拟支撑生物医药产品研发的顶层计划。在欧盟委员会资助下,让来自35个国家的525名专家参与了为期18个月的协商一致进程,以制定这一研究和技术发展路线图(图1)[2]。此后,以“阿维森纳路线图”项目为基础建立了阿维森纳联盟,不断吸纳这一领域的研究机构和企业成为联盟会员,并持续推进欧盟医药政策变革。2020年,欧盟药品局总部(HMA)和欧洲药品管理局(EMA)管理委员会发布了《到2025年的欧盟药品机构联合战略》(European Medicines Agencies Network Strategy to 2025)将“数据分析、数字工具和数字化转型”列为6个战略优先领域之一[3]。
美国食品药品监督管理局(FDA)2011年的战略计划“推进FDA监管科学”列出了开发和应用产品生命周期、风险评估和其他监管科学用途的仿真模型作为目标。2016年,美国国会敦促FDA与设备和药物研发主办方合作,在适当的情况下探索更多地使用电子计算机临床试验来推进新设备和药物治疗应用[4]。此后,FDA每年都将“模拟与仿真”作为年度计划的优先事项,持续投入资源将计算模型从一种有价值的科学工具转变为一种有价值的医疗器械监管工具[5]。
2022年1月,工业和信息化部、国家发展改革委等九部门联合发布了《“十四五”医药工业发展规划》,提出“以新一代信息技术赋能医药研发。探索人工智能、云计算、大数据等技术在研发领域的应用,通过对生物学数据挖掘分析、模拟计算,提升新靶点和新药物的发现效率”[6]。
重大的战略规划往往伴随着组织架构的调整。欧美地区都开始系统性调整药品监管组织架构,发展监管科学工具。
美国:2016年,FDA首席科学家办公室批准成立建模与仿真工作组(ModSimWG),其主要目标是支持建模与仿真(M&S)在监管审查过程中的实施。建模与仿真工作组由近200名FDA科学家组成,汇集了整个机构的M&S科学家。领导层由来自FDA下属中心[包括所有6个产品中心和国家毒理学研究中心(NCTR)]的2名代表和来自监管事务办公室(ORA)的1名代表组成[5]。
欧洲:2013年EMA在人用药品委员会(CHMP)下成立了建模与仿真工作组(MSWG),设置了提高整个欧洲国家当局对建模和模拟方法的认识和水平等一系列目标。在2018年左右又进行了架构调整,EMA成立方法学工作组(MWP),整合生物统计学工作组(BSWP)、建模与仿真工作组、药物基因组学工作组(PGWP)和药代动力学工作组(PKWP)等工作内容[7]。
1.2 为什么计算机建模与仿真技术是医药研发的重要战略选择
计算机建模与仿真技术成为重要的战略选择,原因来自于医药研发者、审评者和研究者多方面需求。概括来说,医药研发者需要解决因疗效不足导致临床试验失败的新研发决策工具。审评者需要能加强肿瘤机制性认识的新监管科学工具。研究者提出了越是复杂疾病,越需要数字化建模手段的需求。
第一,临床试验失败率高的问题亟需方法创新。“阿维森纳路线图”中明确提出,生物医学产品的开发与评估仍主要基于实验而非计算机模拟方法。需要在体外、动物身上,然后在临床试验期间对患者进行长期而复杂的实验,这将开发成本推到了不可持续的水平,扼杀了创新,并将医疗保健的成本推到前所未有的水平[2]。
第二,以临床价值为导向的药品审评工作亟需方法创新。机制决定临床结果。以高失败率的抗肿瘤药物研发为例,肿瘤发展机制、治疗目标以及肿瘤微环境复杂性的探索对临床成功具有重要意义。新药开发始终要以患者需求为导向,需要加强对肿瘤疾病学的全面认识,在患者选择中要考量精准人群分型,要通过应用科学工具助力新药研发等[8]。
第三,疾病的研究和治疗取得新的突破亟需方法创新。人类疾病模型仍然是以模式动物为基础。但是,动物疾病模型的发病过程、病理机制、发病状态和愈后康复等与真实的人体环境存在较大差异。对人的整体生命活动规律的认知还停留在局部或碎片化阶段,一些新发现仍是在“盲人摸象”。这导致医学领域对大多数疾病的研究和治疗并没有革命性的突破。全面系统刻画人类数字生命和全息人体,研制更逼近人类疾病真实世界的数字化人体疾病模型,是生命科学领域的世界前沿[9]。
美国癌症协会曾调研了90多位顶尖癌症专家,描绘了肿瘤未来十年研究的蓝图,提出了近百项行动建议。其中一个重要观点是,越是复杂疾病,越需要数字化建模手段。检查肿瘤进化、预测治疗耐药性的计算方法和数学建模已经成为推进研究和临床影响的有力方法[10]。
在围绕动物实验的伦理问题日益增加的推动下,对可用于减少、改进和替代动物实验的非动物方法、体外或计算机技术的兴趣日益增加。此外,动物实验在预测临床结果的能力方面正在被严格修订[11]。
1.3 评价数字化证据是监管科学研究计算机建模与仿真技术的重要议题
计算机建模与仿真技术对监管科学到底意味着什么?简而言之就是计算机模型生成的数字化证据,可以作为监管证据,来减少、改善、替代传统上通过体外、动物或人体试验生成的证据(表1)[12]。监管科学需要形成评价数字化证据的标准体系,从而使技术驱动的可持续和安全的制药业成为可能。

2、战略实践
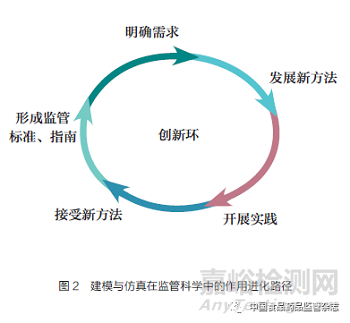
计算机建模与仿真的监管工具发展,正在走一条转化路径:科学界针对各种应用场景(Context of Use,COU)开发更多有价值的科学工具,监管机构将有价值的科学工具转变为有价值的监管科学工具,并进而形成开发更多数字化证据的运行机制[13]。该运行机制形成了一个定义监管科学差距,开发新方法,积累新经验与新知识,验收数字化证据,进而形成规范、标准、指南的路径推进计算机建模与仿真技术在监管科学领域的发展与应用落地(图2)[14]。
2.1 近期具有突破性的科学工具向监管科学工具转化的国外实践
2.1.1 科学工具完成了向监管科学工具转化的案例
2022年9月,一家人工智能公司Unlearn获得了EMA认可意见。EMA认可该公司的人工智能模型可以提高随机对照临床试验的速度和效率。Unlearn的TwinRCT解决方案现在将控制臂尺寸减少了35%左右,允许更多的试验对象接受实验治疗。该公司还在积极推进与FDA的沟通,希望获得类似审核认可[15]①。
2.1.2 正在由科学工具向监管科学工具转化的案例
以下3个模型工具均来自欧盟地区,均尚未获得正式监管机构的批准,但开发商正处于与监管机构互动的不同阶段。涉及的计算机建模与仿真技术的企业有:InSilicoTrials Technologies,Novadiscovery,GIGA In silico Medicine。
(1)通用免疫系统模拟器(UISS)。该工具是在肺结核治疗性疫苗剂量选择方面提供数字化证据,用于为临床试验补充额外的证据。UISS是一个基于生理学和代理人的人类免疫系统模型。UISS‐TB包括肺结核感染的疾病模型组件、治疗(待测试的治疗性疫苗)效果组件,并在代表目标人群的虚拟人群中运行。该模型的目的是为确认性试验选择剂量,显著减少Ⅱ期剂量反应试验中的人体试验[16]。
(2)药物心脏毒性测试的虚拟分析模型。该工具是在预测药物的心脏毒性方面提供数字化证据,用于取代临床试验中产生的数据。Virtual Assay是一种基于人体的心脏电生理建模和仿真工具,关注即使在hERG检测阳性和多通道效应的情况下,该药物是否会导致人群中发生尖端扭转型室性心动过速风险的科学问题[16]。
(3)心肌生理学模型。该工具是用来模拟预测Ⅱ期临床试验中该药物的目标人群特征,为优化Ⅲ期临床试验设计提供数字化证据,用于为临床试验补充额外的证据。该模型是一个基于定量系统药理学(QSP)模型,用于识别药物响应人群的生物标志物,辅助Ⅲ期临床试验设计中用于预测药物的临床效益[16]。
监管机构还在不断地对新模型工具进行沟通审核当中,未来将有更多的模型可能被获批。
2.2 发展能够预测患者个体对疾病进展或者治疗反应的特异性模型是一项重要议题
医药研发的成本75%集中在动物和人体临床试验阶段,临床试验阶段更是“死亡之谷”。很多临床前表现良好的药物,在临床Ⅱ期或Ⅲ期折戟。发展能够预测患者个体对疾病进展或者治疗反应的特异性模型是一项重要议题。2005年,欧盟在计算机模拟与仿真的战略路径上规划的“阿维森纳路线图”的一个重要议题就是重视临床转化,特别是围绕患者特异性模型来进行预测,提供临床决策。通过探索虚拟患者、虚拟临床试验来有效补充临床试验,实现减少入组患者的数量,探索受试者间的差异如何影响治疗反应,提高统计的显著性,并给出建议的临床决策。
本文选取了部分正在研究中的科学工具案例逐一呈现。虽然这些工具目前还没有转化为监管科学工具,但是发展出高质量的监管科学工具的必由之路是由学界、工业界一起探索科学工具的创新。目前,在扩大患者入组标准、预测药物临床反应这些应用场景上,已经发展出了新的一部分数字化模型,特别是使用了人工智能方法,并取得了一定的研究结果。机器学习和人工智能相对于传统的基于统计计算的算法工具的优势在于,更具备潜能发现未被发现的潜在生物机制[17-18]。
第一,利用人工智能工具扩大临床试验入组标准。斯坦福大学、基因泰克开发了一个开源的人工智能工具Trial Pathfinder,使用真实世界数据模拟已完成的非小细胞肺癌试验,用于证明一些常见的入组标准,例如实验室检查指标,几乎不会影响临床试验的风险比率。这意味着,有很多不符合最初试验标准的人,也有可能从该治疗方法中获益。这为拓宽临床试验入组资格标准以解决特定患者群体在临床试验中代表不足的问题提供了新的思路[19]。
第二,利用QSP模型生成虚拟患者模拟抗肿瘤免疫治疗药物效果的虚拟临床试验研究。美国约翰霍普金斯大学一项由美国国立卫生研究院(NIH)资助的研究项目,利用QSP模型生成黑色素瘤虚拟患者,对已开展的抗PD-1临床试验、抗CTLA-4临床试验、抗CTLA-4与PD-1联合治疗临床试验方案开展虚拟临床试验,捕捉在临床中观察到的各种各样的肿瘤动力学,预测CTLA-4、PD-1和PD-L1的各种组合的中位反应。虚拟模拟结果显示出与真实临床试验数据的良好相关性。研究希望通过定义不同生理参数的患者组合区分对不同类型疗法应答的虚拟患者,从而为未来优化给药方案、有效剂量选择提供助力[20]。
第三,多动症的头对头虚拟临床试验。来自西班牙的研究人员使用了一种整合了人工智能、系统生物学、药理学等知识开发的TPMS方法,以药物和病理学的分子表征,建立了注意缺陷多动障碍(ADHD)成人患者和儿童/青少年患者的虚拟患者群,通过建立PBPK和QSP模型模拟两个群体使用甲磺酸(Lisdexamfetamine)和哌甲酯(Methylphenidate)药物的治疗效果,最终使用人工智能进行数据分析识别两种药物之间的机制差异、患者队列差异、患者间和患者内的反应变异性。该项目验证了计算机技术可以促进对疾病的病理生理学和可用疗法的分子作用机制的理解。从科学证据的角度来看,研究人员认为可用上述模型生成的电子证据来补充荟萃分析。计算机建模与仿真技术有助于加深对疾病的病理生理学和可用疗法的分子作用机制的理解。该项目由武田制药资助[21]。
第四,美国加州大学圣地亚哥分校的医学部、生物工程系、计算机科学系联合开发了一种名为DrugCell的人类癌细胞深度学习模型进行药物反应预测。DrugCell根据1235种肿瘤细胞系对684种药物的反应进行了训练。该模型生成了体外层面的计算模拟结果。研究人员利用临床试验数据,利用221名雌激素受体阳性的转移性乳腺癌患者对stom和CDK4/6抑制剂的反应预测做了概念验证,证明可以利用来自体外数据训练的深度学习模型预测真实世界患者的药物反应[22]。
第五,虚拟患者引擎研发项目。赛诺菲与德国某大学利用赛诺菲专有的疾病数据集(体外、体内临床前数据集+临床数据集),开发体外、离体或类器官虚拟患者模型,用于疾病相关的患者内分型、疾病分层生物标志物的预测以及新药候选物与标准护理化合物和竞争对手化合物的虚拟直接临床疗效比较[23]。
第六,利用疾病模型的电子证据推荐药物适应症。辉瑞与以色列公司Cytoreason合作,利用Cytoreason的疾病模型(机器学习技术、遗传学、基因组学、蛋白质组学、医学文献)分析CCR6蛋白的生物学特性,基于Cytoreason的分析结果,辉瑞确定靶向CCR6蛋白的最佳方法以及受CCR6抑制剂影响最大的疾病,即炎症性肠病(IBD)。辉瑞的该药物于2020年7月进入Ⅰ期临床试验,首个适应症就是IBD。
第七,在国内,北京大学肿瘤医院联合图灵-达尔文实验室计算医学团队开展了一项平行的前瞻性的虚拟临床试验研究。该研究利用计算医学技术建立基于组学生物信息的肿瘤药物疗效预测的新方法,使受试者同时进入真实的随机对照试验和虚拟临床试验,评估虚拟临床试验与真实临床试验结果的一致性。研究的意义在于对新技术生成的数字化证据进行评估,验证技术可信度,为未来设计临床试验、精准匹配患者人群提供证据基础。
2.3 科学工具向监管科学工具的转化机制
从上述案例中,笔者还归纳提炼了欧盟等地区在将科学工具转化成监管科学工具、研发决策工具中的一些内在运行机制。
第一,各利益方全程同步参与研究,将研究过程及时总结,以发表论文等形式做公开披露,是欧盟地区做创新工具转化的一种工作机制。
第二,FDA、EMA认识到,由于计算机模拟试验是一类具有颠覆性创新的新方法,利用应用场景引导科学工具向监管科学工具转化,是一种非常有用的机制。各方可以针对具体使用场景展开监管科学工具转化的讨论[18]。
第三,以患者为中心是医药研发的第一价值理念,计算机建模与仿真需要重视临床转化。从实际案例中可以发现,探索虚拟患者、虚拟临床试验,从实际观察建立对模型可用性的信心是一项非常重要的事项。
3、面向未来的行动思考
3.1 加快弥合跨学科思维方式的差异
利用好计算机模拟技术,离不开医学科学家、生物学家、药理学家、生物化学家、生物物理学家、生理学家、计算机科学家的协同工作。跨学科研究带来的最大挑战之一是如何弥合认识论的差异。
第一,需要找到异中求同的最大公约数。医学科学家需要避免过于苛刻的评价思维。计算机模拟技术在体外、体内、临床试验上产生的作用强度需要有递进过程,当下必须要利用计算机模拟技术产出大量、多样化的证据,来建立进行药物研发关键决策的信心。对计算机模拟技术的预测准确性提出过于苛刻的要求,例如不能产生有偏差的预测结果,必须百分百预测正确才能算合格的思维方式需要避免。有必要允许计算机模拟技术产出多样化的数字化证据,来逐步建立对模型可用性的信心[2]。
第二,在沟通中形成共识,在共识中促进转化。成立工作组是产生共识的一个非常好的工具。欧盟在“阿维森纳路线图”发布后即成立了阿维森纳实践社区,欧洲地平线计划不仅资助研究课题,还在2020年资助成立了Silico World在线联盟社区,广泛开展促成相关利益方形成共识的工作[2,13]。在国内,也可以借鉴这种运作方式,促进监管机构、产业界、临床研究机构与新兴技术之间的相互理解,降低技术向应用实践转化的壁垒。
第三,尽可能发展、识别具有可解释性的模型。更好地实现跨学科的融合,计算机建模与仿真不仅需要预测得准,还需要提供解释,为什么会发生这样的事情。在2021年意大利那不勒斯举办的IMMUNOTHERAPY bridge会议上,肿瘤免疫学者们就提出了希望:我们要了解一种治疗方法为什么有效,或者为什么无效,以此来揭示抗肿瘤免疫的复杂性。将多组学的分子数据与临床数据相整合,构建可用的、可解释的模型,来获得具有生物学意义的有关药效作用、机制洞见、潜在生物标志物的信息[24]。从全球来看,利用人工智能方法,从数据驱动的模型中预测药物对临床结果的因果效应,依然是一个难题。人工智能生成的疾病数字化模型需要具备生物学意义的可解释性,系统性提升预测药物疗效与安全性的能力[25]。
3.2 打造虚拟临床试验样板,探索高级别数字化证据
3.2.1 虚拟临床试验可以贡献什么
计算机模拟技术在体外、体内、临床试验上产生的作用强度逐级递增。生成虚拟患者,开展虚拟临床试验,在患者药物反应预测、新标志物发现、患者亚组分层上产出高级别的数字化证据,来实现有效补充甚至部分替代临床试验,是业界对计算机建模与仿真进行临床转化、服务临床试验的一个重要战略目标。
虚拟临床试验未来可用于指导临床试验设计;补充现有的临床试验代表性不足人群的试验(例如罕见病);使用Ⅱ期临床试验结果预测Ⅲ期临床试验,以减少入组患者数量。这是减少临床试验持续时间、提升临床试验成功率、提高临床决策质量的有效手段[26]。
3.2.2 我们如何行动
实现道路必然不是一帆风顺,从科学工具转化为监管科学工具、研发决策工具,需要各方的努力。
倡议监管科学部门、药厂、临床研究机构与技术提供方,组建跨学科项目组,合力开展证明虚拟临床试验可靠性的研究项目。
对于行业应用者来说,相对于就模型谈论模型,让非计算机科学的人员弄明白建模算法背后的机制,更加关注开展广泛的创新研究项目,从实际观察建立对模型可用性的信心。
倡议药厂选择已有的临床试验(无论是成功的,还是失败的),使用计算医学技术进行回顾性评估,比较计算机模拟产生的电子证据结果与人体内试验获得的结果的一致性,建立对模型可用性、可靠性的信心。
更为创新的做法是,设计平行、前瞻性的虚拟临床试验,患者可以同时进入真正的临床试验与计算机模拟的虚拟临床试验,根据平行临床试验产生的观察结果进行测试,将虚拟临床试验的预测结果跟真实世界的结果比对,生成高级别的电子证据,促进监管科学工具与研发决策工具的转化落地。
当我们重复多次(包含模型训练、优化与验证)并且累积了大样本量后,生成的虚拟患者数据库和前瞻性的电子证据,可与现有的专家意见、文献意见,一起优化指导临床试验设计,逐步实现补充、优化、替代临床试验的目标。在实施路径上,可以首先在药物适应症探索、罕见病领域开展。
倡议监管科学部门与临床研究机构、药厂密切配合,选择在研的临床试验启动前瞻性的虚拟临床试验,从药物对象的选择、解决的具体科学问题、应用场景的确定等方面创新试点,在具体的实例当中进行多方研判,试点中探索评估和认证框架。尤其是在罕见病方面,由于可纳入的患者资源稀缺,虚拟和真实患者相结合的复合型临床试验符合以患者为中心的价值理念。针对这一目标,可进行专门的研究工作。
希望技术提供方在虚拟临床试验项目中,不仅能够预测临床结果,还要揭示一个临床试验为什么成功,为什么不成功。通过加强对疾病生物学的理解,来系统性地提升药物研发效能。
3.3 建立中国应用场景清单,促进有价值的科学工具转变为有价值的监管科学工具
由于计算机模拟试验是一类具有颠覆性创新的新方法,FDA、EMA也认识到,利用应用场景引导科学工具向监管科学工具转化,是一种非常有用的机制。各方可以针对具体使用场景展开监管科学工具转化的讨论。也就是在具体的应用场景下,确认模型产生的数据证据是否可以有效地支持决策,来建立使用模型的共识。
从全球药品发展的战略层面,在药物开发中使用计算机模拟与仿真的重要地位逐步呈现。全球主要国家在没有成熟的监管指南情况下,都在基于通用评估框架的基础上,利用应用场景清单法,推动产出监管科学最佳实践。
因此,呼吁征集中国的应用场景清单,通过清单,将先进科学工具下沉到药品研发的具体问题场景中,解决真实的困难,从而将虚拟临床试验这种颠覆性创新方法融入药物研发的价值链中。
注:①该意见由EMA 的人用药品委员会根据科学建议工作组(SAWP)的意见给出,认可意见表示基于数字技术的方法,可以用于支持医药产品的批准。
引用本文
赵宇,张静,张春明*,张伟*.从全球药品监管科学视角看计算机建模与仿真新方法的发展现状及趋势[J].中国食品药品监管,2023(7):6-15.