您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-08-03 11:20
电子泌尿系统内窥镜为通过创口或自然孔道进入人体内,用于成像和诊断的电子泌尿系统内窥镜。一般包括电子膀胱肾盂内窥镜、电子输尿管肾盂内窥镜、电子膀胱内窥镜、电子输尿管内窥镜、电子经皮肾盂内窥镜等。
该类产品在《医疗器械分类目录》中分类编码为06-14-03。产品的管理类别为Ⅱ类。
一、电子泌尿系统内窥镜结构组成及工作原理
不同类型电子泌尿系统内窥镜的差别主要在于工作长度、插入部外径、器械孔道内径、弯曲角度,根据其插入部材质的不同,还可以分为硬镜、半硬镜、软镜,硬镜插入部一般为医用不锈钢或是硬度较高的材质,不含弯曲部,不能进行弯曲;半硬镜的插入部一般为医用不锈钢或是硬度较高的材质,弯曲部可弯曲;软镜的插入部一般为具有一定柔性的聚合物材质,其一般特征如下:
|
产品名称 |
插入部材质 |
适用部位 |
进入方式 |
|
电子膀胱肾盂内窥镜 |
软镜 |
尿道、膀胱、肾盂 |
经尿道插入膀胱,或经皮插入肾盂 |
|
电子输尿管肾盂内窥镜 |
软镜 |
尿道、膀胱、输尿管、肾盂 |
经尿道插入膀胱、输尿管、肾盂或者经皮插入肾盂 |
|
电子膀胱内窥镜 |
软镜/半硬镜/硬镜 |
尿道、膀胱 |
经尿道插入膀胱 |
|
电子输尿管内窥镜 |
硬镜 |
尿道、膀胱、输尿管 |
经尿道插入膀胱、输尿管 |
|
电子经皮肾盂内窥镜 |
硬镜 |
肾盂 |
经皮插入肾盂 |
工作原理:器械头端部的光电转换器件将接收到的光学信号转换为电信号,通过图像处理系统在显示器上观察。
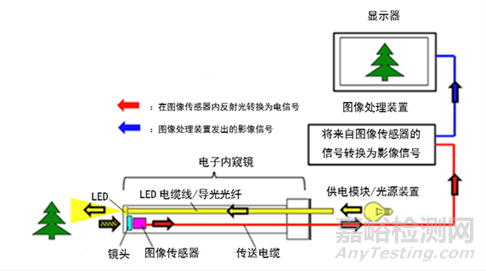
电子泌尿系统内窥镜成像流程图
结构组成:电子泌尿系统内窥镜一般为直视型(视向角为0度),镜体由头端部、弯曲部、插入部、操作部及连接部组成,产品组成中可包括与之连接、组装的附件,例如吸引按钮、钳子管道开口阀/止液阀等。附件可集成在电子泌尿系统内窥镜上,也可作为单独附件,使用前安装到电子泌尿系统内窥镜上。
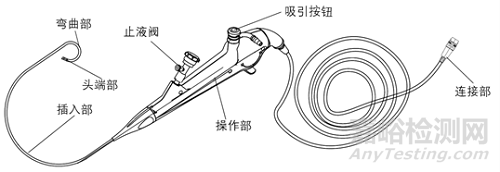
电子膀胱肾盂内窥镜、电子膀胱内窥镜(软镜)结构示意图
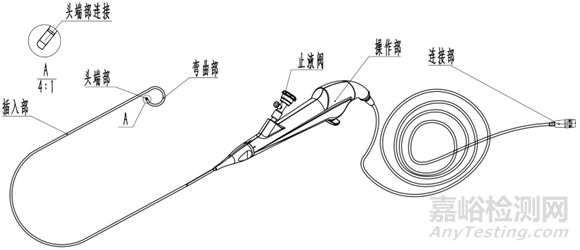
电子输尿管肾盂内窥镜(软镜)结构示意图
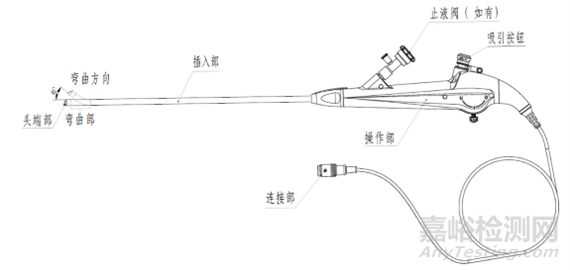
电子膀胱内窥镜(半硬镜)结构示意图
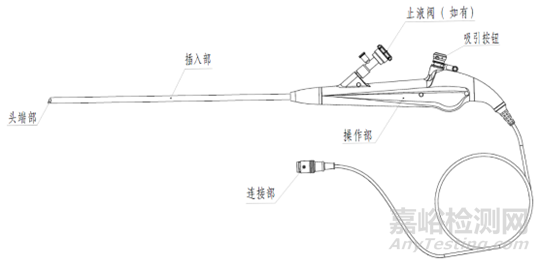
电子膀胱内窥镜(硬镜)结构示意图
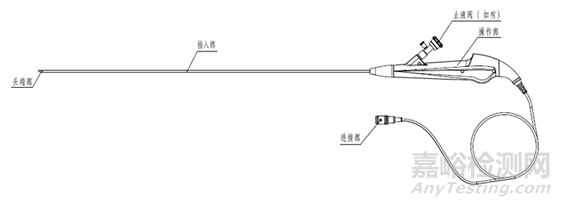
电子输尿管内窥镜(硬镜)结构示意图
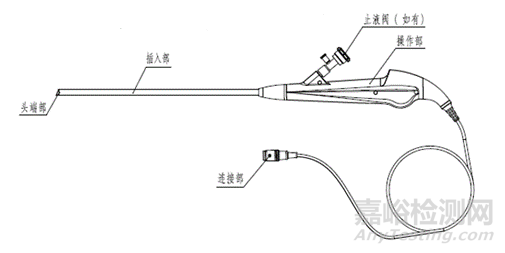
电子经皮肾盂内窥镜(硬镜)结构示意图
i头端部
头端部为内窥镜中最为精密的部分,是实现内窥镜功能的重要组成部分。其中内置了图像传感器、照明等基本部件,设置有器械孔道口。图像传感器是内窥镜成像的核心部分,在一定程度上影响内窥镜图像的优劣,目前常用的图像传感器有CCD和CMOS两种。
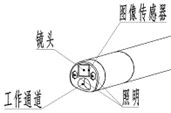
头端构造
ii弯曲部
弯曲部一般由可弯曲的蛇管实现弯曲功能,外部包覆氟橡胶、氟树脂、嵌段聚酰胺树脂(Pebax)、聚氨酯等外皮,通过操作部角度控制机构驱动内窥镜内部牵引钢丝,带动弯曲部蛇管弯曲,可易于插入体内并且进行目标部位的观察。


内窥镜弯曲部结构
iii插入部
电子泌尿系统内窥镜插入部多为氟树脂、聚氨酯、聚砜、尼龙编织管、聚醚醚酮(PEEK)等高分子材料,也有含不锈钢材质。内含有电缆线、导光光纤(如有)、工作通道、牵引钢丝等。重复性使用的电子泌尿系统内窥镜多采用液体化学试剂进行浸泡消毒/灭菌,外层高分子材料应具有一定的耐腐蚀性。
iv操作部
内窥镜操作部除了角度控制机构控制弯曲部位进行弯曲,还可带有吸引按钮和钳子管道开口阀/止液阀等。通过操作钳子管道开口阀/止液阀、吸引按钮,可以送水和吸引操作。在操作部设有器械插入口,内镜诊疗附件从此处进行插拔操作。
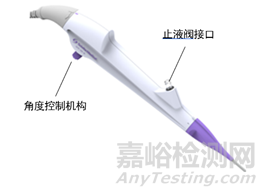

操作部结构图
v连接部
内窥镜连接部信号输出口一般通过电缆线与图像处理装置连接,用于传输图像信号。
二、电子泌尿系统内窥镜的主要风险
按照YY/T 0316《医疗器械风险管理对医疗器械的应用》,电子泌尿内窥镜主要的风险包括能量危害、生物学危害、环境危害、与使用有关的危害、功能失效及老化有关的危害等,具体危害如下:
1.能量危害
(1)电能危害
与图像处理装置、冷光源等有源医疗器械连接使用时可能对使用者、患者产生电击危害。
(2)机械能危害
①当插入管外表面有毛刺、破损时,使用该产品进行检查可能划伤患者内腔,造成患者受伤、出血。
②当弯角操纵系统失效时,可能使弯角部弯曲后无法还原,造成退镜困难或使患者受伤。
③送水时压力过大或吸引时负压过大,靠近患者黏膜操作时,可能导致患者黏膜受伤。
(3)热能危害
与图像处理装置、冷光源等连接使用时可能超温,对使用者、患者产生灼伤或烫伤危害。
2.生物学危害
(1)生物相容性危害:与患者接触的材料生物相容性不好,患者使用后可能出现细胞毒性、刺激和致敏反应危害。
(2)溶解析出物危害:内窥镜与患者接触部分使用的聚合物材料溶解析出物有害物质超标,可能使患者产生不适或毒性反应危害。
(3)交叉感染危害:内窥镜在使用前后,不按规范严格的清洗、消毒和灭菌,或者推荐的清洁、消毒和灭菌方法不合理,可能导致污染物或细菌残留,对患者产生交叉感染的危害。
3.环境危害
(1)电磁危害:产品电磁屏蔽、滤波和接地设计以及抗干扰设计不充分,可能导致设备对外界电磁辐射超标或设备受外部电磁干扰出现工作异常。
(2)与运输、储存和运行偏离预定的环境条件、意外的机械破坏有关的危害:如果内窥镜包装设计不合理、未按要求包装运输,或贮存环境不满足要求,或使用时发生摔打、跌落和碰撞,可能造成内窥镜损坏或性能变差。
(3)与溢流、泄漏及进液有关的危害:如果重复性使用内窥镜密封性不好,可能进液造成图像雾层性能下降或产品损坏。
(4)环境污染危害:使用说明书未对到达使用期限后废弃处置进行规定,用户处置可能造成环境污染危害。
4.与内窥镜使用有关的危害
(1)与标签、标记有关的危害
①标签上警告、禁止等标识不充分、不清晰或不符合标准要求,控制按键/按钮标识不清晰或不易辨认,可能造成用户误操作等危害;
②内镜上标签、丝印不耐受浸泡,标签上文字、丝印油墨或标签脱落,信息无法识别,可能造成用户误操作等危害。
(2)与说明书有关的危害:
①说明书中没有产品安装有关的信息或相关警告等,可能导致错误安装造成产品损坏等危害。
②说明书中没有使用人员的资质说明,被未经培训或非专业人员使用,可能导致误操作造成设备损坏或患者受伤等危害。
③使用说明书没有指出兼容的主机型号和其他配套设备;说明书中未包含安装内窥镜各附件的使用说明等,可能导致内窥镜不能正确连接造成设备无法正常工作。
④使用前检查规范不充分,如未说明必须检查内窥镜外表面、密封性、成像功能、送水送气等性能是否良好,检查与吸引泵等配用器械连接工作是否正常等内容。
⑤使用前后的清洗、消毒和灭菌方法不规范或不充分,可能导致消毒灭菌不彻底,对患者造成交叉感染等危害。
(3)合理可预见的误用危害:
①在清洗和浸泡消毒灭菌前,未测试镜子密封性,可能导致镜子内部进液,造成设备损坏。
②当内窥镜弯曲部大角度弯曲时,插入或抽出活检钳等附件过度用力,或者活检钳、抓钳等附件在未伸出工作通道或未在内窥镜视场内就打开,可能损伤内窥镜工作通道或使患者受伤。
5.与功能失效、不当的维护及老化有关的危害
(1)与功能失效有关的危害
①光学性能不良,视场角、分辨率、景深范围等光学性能不符合标准要求,导致光学性能不能达到使用要求,可能造成延误诊疗或误诊等危害。
②照明光分布和边缘均匀性不良,可能导致成像不良,临床灰阶识别困难不易诊断或手术失误;受辐射区域组织局部过热,可能存在组织烘干或灼伤的潜在危险。
③像面边缘光强与中心光强的分布不良,可能导致腔内边缘组织无法识别诊查或视场中心光能过大产生眩光/中心光亮饱和导致关健区域观察失效的临床风险。
④头端照明组件发散角不足及照明光谱红外线波段过高会导致出光口光能过高,从而引起与出光口接触的组织过热炽伤。
⑤机械性能不良,尺寸、表面安全性能、吸引性能、弯曲操纵系统、密封性、附件配合性能不符合标准要求,导致机械性能不能达到使用要求,可能造成患者延误诊疗、腔内划伤等危害。
⑥弯曲操纵系统的最大破坏强度限值未考虑操作者的施力程度,可能导致弯曲操纵系统容易损坏,内镜检查或手术时插入人体部分失控、某形状下僵住或手术孔道内器件锁死,甚至可能破坏外层胶皮,造成患者延误诊疗、腔内划伤等危害。
⑦内窥镜内部钳道管、蛇骨等部件材质质量、尺寸配合等设计不合理,未考虑使用时的应力集中效应等,可能导致钳道管内部管路局部过度磨损、应力变形、蛇骨出现脱节损坏甚至断裂,造成患者延误诊疗、腔内划伤等危害。
⑧弯曲操控机构的耐久性不良,可能导致弯曲操控机构的活节点疲劳破坏而断裂、拉伸钢丝焊接部疲劳破坏脱离、拉伸钢丝表面磨损而摩擦系数增大又导致焊接部拉应力增大而加速疲劳破坏,拉伸钢丝表面过度磨损处应力集中缩径或断丝(多束时)增大变形直至断裂,造成患者延误诊疗、腔内划伤等危害。
⑨外胶皮的耐久性不良,外胶皮自身的老化发脆使表面硬化、起边或棱毛疵直接损伤组织,多次弯曲的疲劳破坏而损伤密封性,造成设备损坏、患者延误诊疗、腔内划伤等危害。
⑩插入头端部胶接的耐久性不良,头端座与光学镜片和钳道胶接处的胶接材料因长期重复清洗、消毒灭菌浸泡和老化,出现密封不良,造成设备损坏等危害。
⑪内窥镜内部信号线可能因弯曲或扭转、严重的机械碰撞或其他因素发生断裂、失去信号传输功能,导致图像异常故障、患者延误诊疗等危害。
⑫内窥镜材料对消毒剂耐受性不好,在重复消毒或灭菌后损坏,插入人体部分密封不良而带来电击、感染、生物毒性等危险,或与人体接触部分材料发生化学变化导致生物毒性。
(2)与不当的维护有关的危害:
①如内窥镜的清洗、消毒和灭菌及储存等维护保养不规范或维护不当,可能会导致内窥镜性能下降,造成设备损坏或患者延误诊疗等危害。
②如内窥镜被非专业人士维修或更换不合适的部件,可能会导致内窥镜性能下降,造成设备损坏或患者延误诊疗等危害。
(3)与老化有关的危害
①外胶皮、弯曲操纵部件和电子图像部件等老化,可能会出现密封性能不良、操纵性能下降或图像清晰度性能下降,造成设备损坏或患者延误诊疗等危害;
②未规定内窥镜的使用期限或重复消毒灭菌次数,内窥镜超期使用,可能使临床使用风险增加。
三、电子泌尿系统内窥镜性能研究实验要求
1、化学和物理性能研究
应当明确产品化学/材料表征、物理和/或机械性能指标的确定依据、设计输入来源以及临床意义,所采用的标准或方法、采用的原因及理论基础。
1.1 光学性能可参考YY/T 1587、YY 0068.1的要求,至少包括以下指标:视场角、视向角(如适用)、照明镜体光效、亮度响应特性、信噪比、空间频率响应、静态图像宽容度、视场中心分辨率、景深等。
1.2机械性能应包括尺寸(工作长度、工作通道内径、插入部外径等)、外观、操控性能、吸引性能、弯曲性能、密封性能(重复性使用产品应关注)、与附件配合的性能等。硬性电子内窥镜的机械性能可参考YY 0068.2的要求。
1.3化学性能可参考YY/T 1587的要求,主要包括插入部分表面聚合物材料的溶解析出物的要求。
1.4内置LED照明部分的性能可参考YY 1081《医用内窥镜 内窥镜功能供给装置 冷光源》和《医用内窥镜冷光源注册技术审查指导原则》的要求,至少包括以下指标:红绿蓝光的辐通量比、红外截止性能、输出总光通量、防故障的安全措施等。
1.5安全性指标的验证包括电气安全指标和电磁兼容指标两大类。电气安全指标应当包括GB 9706.1、GB 9706.19及其他适用的国家标准和行业标准中的所有指标,电磁兼容指标应当包括YY 0505(YY 9706.102)、GB 9706.19第36章及其他适用的国家标准和行业标准中的所有指标。
2、电气系统安全性研究
应当开展电气安全性、机械和环境保护以及电磁兼容性的研究,明确适用的标准。
3、软件研究
电子泌尿系统内窥镜如含有软件组件,应关注是否已按照《医疗器械软件注册审查指导原则》的要求开展软件相关研究。
4、生物学特性研究
依据GB/T 16886.1《医疗器械生物学评价第1部分风险管理过程中的评价与试验》标准中的方法,对最终产品中与患者和使用者直接或间接接触的部分进行生物相容性评价,一般包括弯曲部、插入部、头端部、镜头部分、工作通道、吸引按钮、钳子管道开口阀/止液阀等,如在说明书中明确“使用者需佩戴手套操作”,可不对使用者接触的部分进行生物相容性评价。
生物相容性评价研究应明确(1)生物相容性评价的依据和方法;(2)产品所用材料及与人体接触的性质;(3)实施或豁免生物学试验的理由;(4)对于现有数据或试验结果的评价。
依据GB/T 16886.1附录A《生物学评价试验》中表A1 要考虑的评价试验,需要做的生物相容性评价试验为细胞毒性、迟发型超敏反应、皮内反应或刺激。
可根据《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号)进行生物学评价。
生物学评价内容包括:对医疗器械材料的定性与定量;医疗器械/材料与市售产品的等同性比较:比较材料和产品的用途是否等同;比较两者的生产过程(加工过程、灭菌过程、包装等)是否相同。
生物性能试验内容包括:
细胞毒性试验:按照GB/T 16886.5中规定的方法进行检验,应≤2级(定性评价)或无潜在毒性影响(定量评价)。
皮内反应或刺激:按照GB/T 16886.10中规定的方法进行检验,极性浸提和非极性浸提下应无皮内刺激反应。
迟发型超敏反应试验:按照GB/T 16886.10中规定的方法进行检验,极性浸提和非极性浸提下应无迟发型超敏反应。
材料名称相同并不代表材料相同,除非来自同一供应商(即材料的生产商,而非经销商或代理商)。不同的供应商材料的配方可能存在差异。
5、清洁、消毒、灭菌研究
(1)生产企业灭菌:应明确灭菌工艺(包括灭菌方式和相关参数)和无菌保证水平(SAL)并进行灭菌确认。
(2)终端用户灭菌:开发人应当明确灭菌工艺(包括灭菌方式和相关参数)及灭菌方法确定的依据;对可耐受两次或多次灭菌的产品,应当开展产品相关推荐的灭菌方法耐受性的研究。
(3)残留毒性:如灭菌使用的方法容易出现残留,应当开展研究明确残留物信息及采取的处理方法。
(4)终端用户消毒:应当明确消毒工艺(方法和参数)以及消毒方法确定的依据。
根据内窥镜的使用方式(例如自然腔道、经皮等)和是否为一次性使用等特性确定消毒或灭菌级别。
6. 产品稳定性研究
参照《有源医疗器械使用期限注册技术审查指导原则》,应对产品的有效期及包装开展研究。
重复性使用内窥镜的使用期限,是指在正常的使用、维护和保养情况下,产品的性能、安全能够符合预期的最长使用时间。内窥镜中电子元器件以及材料的老化、操作使用磨损(弯曲部弯折、连接部的插拔等)、消毒灭菌剂的腐蚀等均影响内窥镜的使用期限。开发人可从使用频率、消毒灭菌以及老化等方面对使用期限影响因素进行综合分析评估,参考《有源医疗器械使用期限注册技术审查指导原则》开展使用期限的验证研究,证明在规定的使用期限内产品性能和安全仍符合预期的要求。
一次性使用内窥镜的使用期限是指在正常的存储、运输环境下,产品的性能、安全、无菌屏障能够符合预期的最长使用时间。无菌屏障系统、内窥镜中电子元器件以及材料随着存放时间的老化等均影响内窥镜的使用期限。一次性使用内窥镜一般通过加速老化包装确认和产品性能确认来完成,可参照YY/T 0681.1《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》、YY/T 0681.2《无菌医疗器械包装试验方法 第2部分:软性屏障材料的密封强度》、YY/T 0681.4《无菌医疗器械包装试验方法 第4部分:染色液穿透法测定透气包装的密封泄漏》要求及试验方法开展加速老化试验,验证产品的无菌屏障系统,并在老化验证周期内,确认产品的光学性能、机械性能、化学性能、安全性能及无菌性能均符合预期使用要求。一次性使用内窥镜虽为一次性使用,但在一次泌尿系统手术中需要不断的进行弯曲来到达不同的位置,在验证产品性能同时应进行疲劳测试。
包装及包装完整性,应开展在使用期限内以及运输储存条件下保持包装完整性的研究。
环境试验应参考GB/T 14710-2009中气候环境Ⅱ组、机械环境Ⅱ组、运输试验第4章的要求开展研究。内窥镜一般为内窥镜图像处理装置供电,不适用电源适应性试验。
7.其他研究
产品结构组成中如包含镜体之外其他附件,应针对附件开展相关的研究,包括使用次数、消毒灭菌等。
电子膀胱肾盂内窥镜、电子膀胱内窥镜(均为非一次性使用的软镜)属于列入《免于临床评价医疗器械目录》(2021年第71号)(以下简称《目录》)产品,应按照《国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告》(2021年第73号)附件5《列入免于临床评价医疗器械目录产品对比说明技术指导原则》的要求进行对比,明确产品与《目录》所述产品具有等同性。
对于列入《目录》产品,开发人针对产品相关信息与《目录》所述内容进行对比,并将产品与已获准境内注册的《目录》中医疗器械进行对比。
对比结果应能证明产品与《目录》所述的产品具有基本等同性。若无法证明产品与《目录》所述的产品具有基本等同性,则应开展临床评价。

来源:嘉峪检测网


