今日头条
诺诚健华TRK抑制剂获批儿科临床。诺诚健华自主研发的第二代泛原肌球蛋白受体激酶(TRK)小分子抑制剂zurletrectinib(ICP-723)获国家药监局批准,即将在2岁-12岁、NTRK基因融合儿童肿瘤患者中开展临床试验。在已完成的Ⅰ期临床中,zurletrectinib治疗不同实体瘤NTRK基因融合阳性患者的总缓解率达到75%;Ⅱ期推荐剂量为8毫克。此前,Zurletrectinib已在成人和青少年(12周岁到18周岁)患者中开展临床研究。
国内药讯
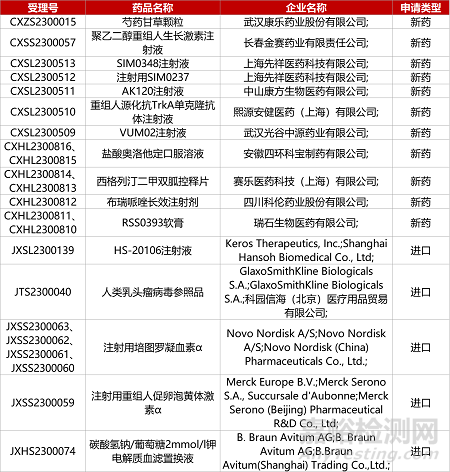
1.智飞四价流感疫苗报产。智飞生物旗下智飞龙科马生物的四价流感病毒裂解疫苗3.3类新药上市申请获CDE受理,用于预防H1N1、H3N2、B(V)、B(Y)株病毒感染引起的流行性感冒。在Ⅲ期临床中,该疫苗显示出良好的免疫原性和安全性,预防流行性感冒的有效性非劣效于对照疫苗,达到研究预设的终点指标。
2.DLL3/CD3双抗中国获批Ⅱ期临床。勃林格殷格翰DLL3/CD3双抗BI 764532获国家药监局批准开展一项II期临床,评估用于治疗复发性/难治性广泛期小细胞肺癌(ES-SCLC)和其他复发性/难治性神经内分泌癌患者的安全性与有效性。BI 764532通过结合CD3后激活T细胞并作用于表达有DLL3分子的癌细胞,从而达到治疗的目的。临床数据显示, BI 764532的客观缓解率(ORR)为18%,疾病控制率(DCR)为41%。
3.银诺长效GLP-1R激动剂获批肥胖临床。银诺医药自研人源化长效GLP-1R激动剂苏帕鲁肽(Supaglutide)获国家药监局临床试验默示许可,用于治疗肥胖症。今年1月,银诺医药宣布苏帕鲁肽用于治疗2型糖尿病的两项Ⅲ期临床(YN011-301、YN011-302)均达到主要终点,糖化血红蛋白相对基线降低可达2.1%,显著优于安慰剂组(P<0.001)。在美国,FDA已批准苏帕鲁肽开展非酒精性脂肪性肝炎(NASH)的临床试验。
4. 晶核PSMA靶向核素疗法国内获批临床。晶核生物1类化药“镥[177Lu]JH020002注射液”(JH02)获国家药监局临床许可,拟开发用于治疗前列腺特异性膜抗原(PSMA)阳性的转移性去势抵抗性前列腺癌(mCRPC)。JH02是一款靶向PSMA的放射性核素疗法(TRT),具有高选择性、高特异性、肿瘤高摄取等特点,且能够长时间地结合并滞留在肿瘤部位,具有更高的安全性和更优的疗效。今年6月,该产品已获得FDA临床批件。
5.翰森引进激活素A抑制剂报IND。Keros公司与翰森制药联合开发的1类生物药HS-20106注射液(KER-050)的临床试验申请获CDE受理。KER-050是一种“工程化的配体捕获体”,属于激活素受体IIA型(ActRIIA)融合蛋白,通过结合并抑制激活素A,来改善骨髓和恢复正常造血功能。该新药正在国外开展评估用于骨髓增生异常综合症(MDS)患者和骨髓纤维化(MF)患者血细胞减少(包括贫血和血小板减少)治疗潜力的II期临床。
6.正大天晴乙肝siRNA新药报IND。正大天晴1类化药TQA3038注射液的临床试验申请获CDE受理。TQA3038是一种靶向乙型肝炎病毒(HBV)的小干扰RNA(siRNA)药物,拟开发用于治疗慢性乙型肝炎。临床前研究结果显示,TQA3038可显著抑制AAV-HBV模型小鼠的感染指标;在大鼠和食蟹猴毒理试验中展现了良好的安全性和耐受性,具有较大的安全窗口。
国际药讯
1.洛替拉纳滴眼液获FDA批准上市。Tarsus公司新型滴眼液Xdemvy(lotilaner,0.25%,TP-03)获FDA批准上市,用于治疗蠕形螨性睑缘炎。lotilaner是一种通过选择性抑制螨虫的GABA氯离子通道来根除蠕形螨的分子。在两项临床(Saturn-1和Saturn-2)中,Xdemvy均达到主要终点和所有次要终点,分别有81%和89%患者达到疾病治愈(袖套状分泌物等级<2)。联拓生物拥有该新药的中国权益。
2.恩格列净获欧盟批准治疗慢性肾病。勃林格殷格翰与礼来开发的SGLT2抑制剂恩格列净(Jardiance)获欧盟批准新适应症,用于治疗慢性肾病。在III期试验EMPA-KIDNEY中,与安慰剂相比,恩格列净可降低肾病进展或心血管死亡的相对风险28%。此前,恩格列净已获批用于治疗2型糖尿病,以及用于降低心力衰竭成人患者心血管死亡和因心力衰竭住院的风险。
3.尼达尼布报儿童纤维化间质性肺病sNDA。勃林格殷格翰TKI抑制剂尼达尼布(Ofev)的补充新药申请 (sNDA)获FDA受理,用于治疗6至17岁儿童和青少年纤维化间质性肺病。在III期InPedILD研究中,尼达尼布在6~11岁患者中的AUC(稳态下血浆浓度-时间曲线下面积)为175µg*h/L(85.1),在12~17岁患者中为160µg*h/L(82.7),其儿童和青少年中暴露量与成人相当。如果获批,尼达尼布将成为这类肺病用于6-17岁年龄段治疗的首个药物。
4.CSF-1R单抗GVHD的II期临床积极。Syndax公司与Incyte公司联合开发的CSF-1R单抗axatilimab,在治疗接受过二线及以上治疗后进展的慢性移植物抗宿主病(GVHD)的II期AGAVE-201研究达到主要终点。不同剂量axatilimab(每两周1次0.3mg/kg,每两周1次1mg/kg或每四周1次3mg/kg)的客观缓解率分别为74%、67%和50%。最常见的不良事件与靶向抑制CSF-1R产生的效应相关,并与既往研究一致。预计将在年底向FDA提交BLA申请。
5.致幻蘑菇素神经性厌食症早期临床积极。COMPASS Pathways公司裸盖菇素COMP360治疗神经性厌食症的Ⅰ期临床积极结果发表在Nature Medicine期刊上。10例18-40岁之间的成年女性厌食症患者在心理辅导之余接受COMP360(25mg)单剂量治疗,在三个月随访期间,有4例患者的进食障碍评分显著下降,达到进食障碍精神病理学上的缓解;受试者没有报告严重不良反应,而且对COMP360的即时效果耐受良好。
6.病毒载体RSV疫苗III期临床失败。Bavarian Nordic公司基于5种抗原设计的RSV疫苗MVA-BN RSV在III期VANIR研究中未达到预设的研究终点。最终分析结果显示,MVA-BN RSV预防至少2种下呼吸道疾病(LRTD)症状发生的效力为59%,显著优于安慰剂组。然而,该疫苗预防至少2种LRTD症状发生的效力仅为42.9%,与安慰剂组的数据无统计学显著性差异。该公司决定终止MVA-BN RSV的开发计划,并结束与优锐医药的合作关系。
医药热点
1.基层“中医馆”“中医阁”建设有标准。近日,国家中医药局综合司和国家卫健委联合印发《社区卫生服务中心 乡镇卫生院中医馆服务能力提升建设标准》和《社区卫生服务站 村卫生室中医阁建设标准》。文件明确:中医馆应独立设置,使用面积不低于300平方米,包括中医诊室(含治未病室)3个及以上,中医治疗室2个及以上;中医类别医师占本机构医师总数的比例不低于25%,且主执业机构在本机构的中医类别医师不少于5名。
2.广东出台规定拟严控公立医院特需服务。7月25日,广东省医保局官方网站公示《广东省公立医疗机构特需医疗服务项目和价格管理暂行办法(公开征求意见稿)》,明确公立医疗机构特需病房床位数占比不得超过10%,医学影像、超声检查、检验类项目以及国家和省规定不实行市场调节价的项目都不列入特需服务。
3.法国八个省推出电子医保卡。据BFMTV新闻资讯台7月24日报道,法国正在推进各种证件的非物质化。现在,电子医保卡可以在八个省份使用,该应用程序预计将从2024年开始在全国逐步推行。电子医保卡并非强制使用,只是在实体医保卡之外为用户提供另一种选择。就医时,电子医保卡持有人可通过智能手机应用程序展示医保卡,并在就医的七天内查看所有医疗费用信息。
评审动态
1. CDE新药受理情况(07月26日)
2. FDA新药获批情况(北美07月24日)