您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-06-28 09:24
|
类别级别 |
原材料 |
辅料 |
|
1 |
这类原料为已获得上市许可的生物制品或药品无菌制剂,如人血白蛋白、各种氨基酸、抗生素注射剂等 |
这类辅料是已获得上市许可的生物制品或药品无菌制剂,如人血白蛋白、肝素钠和氯化钠注射液等 |
|
2 |
这类原料为已有国家标准、取得国家药品批准文号并按照中国现行《药品生产质量管理规范》生产的用于生物制品培养基成分以及提取、纯化、灭活等过程的化学原料药和药用级非动物来源的蛋白水解酶等 |
这类辅料为已有国家药品标准、取得国家药品批准文号并按照中国现行《药品生产质量管理规范》生产的化学原料药,如各种无机和有机的化学原料药 |
|
3 |
这类原料非药用,包括生物制品生产用培养基成分、非动物来源蛋白水解酶、用于靶向纯化的单克隆抗体,以及用于生物制品提取、纯化、灭活的化学试剂等 |
这类辅料是按照《药品生产质量管理规范》规范生产,取得国家药用辅料批准文号,或按照国家备案管理的非动物源性药用辅料。如用作稀释剂的各种糖类,用作抑菌剂的硫柳汞及软膏基质的单、双硬脂酸甘油酯等 |
|
4 |
这类原料主要包括已知具有生物作用机制的毒性化学物质,如甲氨蝶呤、霍乱毒素、金黄色葡萄菌素孔道溶血素、金黄色葡萄菌素肠毒素A和B以及中毒性休克综合征毒素,以及大部分成分复杂的动物源性组织和体液,如用于细胞培养的培养基中的成分牛血清、用于细胞消化或蛋白质水解的动物来源的酶以及用于选择或去除免疫靶向性成分的腹水来源的抗体或蛋白质。 |
这类辅料包括除上述1-3级以外的其它辅料,如用作疫苗赋形剂的动物来源的明胶等。非化学原料药或非药用辅料用作生物制品辅料、非注射用的化学原料药或药用辅料用作生物制品注射剂辅料时按第4级物料管控 |
|
级别 |
生产辅助物料 |
|
1 |
已批准的生物制品或药品,医疗器械等 |
|
2 |
表征充分的,旨在用于CGT生产的物料 |
|
3 |
实验室条件下生产的仅用于早期研发的试剂等 |
|
4 |
动物源性或细胞源性,细胞毒性的物料 |
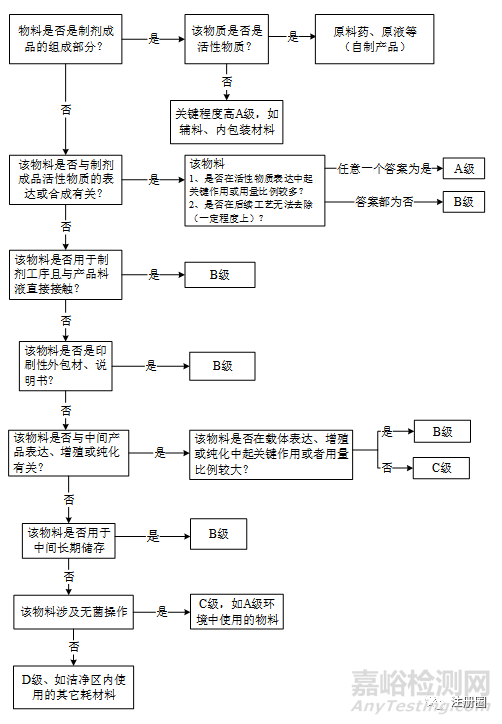
|
关键程度自身风险等级 |
高A(4分) |
中B(3分) |
较低C(2分) |
低D(1分) |
|
第1级(1分) |
II类物料(4) |
III类物料(3) |
IV类物料(2) |
IV类物料(1) |
|
第2级(2分) |
I类物料(8) |
III类物料(6) |
III类物料(4) |
IV类物料(2) |
|
第3级(3分) |
I类物料(12) |
II类物料(9) |
III类物料(6) |
IV类物料(3) |
|
第4级(4分) |
I类物料(16) |
I类物料(12) |
II类物料(8) |
IV类物料(4) |
|
项目 |
物料管理 |
供应商管理 |
|
早期研发 |
1、物料根据使用,功能实现需求筛选;2、尽量采用非人源或动物源的物料; |
1、保存供货或采购合同确保使用物料的合法来源,保存供货协议、发票等;2、收集供应商营业执照、生产许可类文件; |
|
产品IND申报立项 |
3、尽量选择符合药典标准的、官方登记备案的物料;4、每种物料给予物料代码,以能准确识别唯一物料;5、建立产品生产用物料清单,至少包括名称、生产商、来源(动物来源、化学合成、昆虫等)、风险等级以及物料用途等;6、原辅料及包装材料需经过评估经过相应的检查或检验,合格后方可使用;7、物料从采购、到货验收、放行、发放使用可追溯的全流程管理;8、收集、研究物料相关的技术资料。包括但不限于物料质量文件/质量标准、工艺文件,包括非动物来源、TSE/BSE申明,物料CoA、CoC、CoO、SDS或其它质量申明;9、原辅包表征检测并确定质量标准;10、执行系统性物料风险评估,确定物料风险等级,制定相适应的控制措施; |
3、供应商调研,了解企业概况,组织架构,质量管理水平;4、建立物料供应商档案;5、关键供应商签订简化版本质量协议; |
|
早期临床阶段 |
11、本厂根据需求检验放行,一般检安全性项目,动物或人源物料需有来源证明和外源因子检测。12、物料使用评价,评估物料性能是否满足预期用途,如包材执行密封性研究;13、明确生产用原材料,包括其成分、每种成分的来源、浓度和纯度等; |
6、签订质量协议,明确双方职责,物料质量需求;7、供应商初步审核,质量评价。 |
|
III期临床及报产阶段 |
13、原辅料包材全检放行,生产用原材料基于风险检验;14、物料稳定性研究报告或申明;16、物料的容器密闭系统评估,包材相容性、包装密封性研究及测试;17、评估物料批次间的变化对最终产品的影响。 |
8、建立并执行供应商筛选、资料审核或现场审计,合格供应商批准、持续性年度审核等管理流程;9、替代或备份供应商的选择与管理;10、供应商分类分级,评优管理,包括供货能力。 |

来源:注册圈


