今日头条
蔼睦引进眼用植入剂获批注册临床。蔼睦医疗宣布从Ocular Therapeutix公司引进的地塞米松眼用植入剂DEXTENZA获国家药监局批准开展Ⅲ期注册临床,用于评价眼科术后炎症和疼痛的疗效和安全性。Dextenza不含防腐剂,单次插入可持续释放地塞米松长达30天。该产品已在美国和澳门获批用于治疗眼科手术后的眼部炎症和疼痛,以及过敏性结膜炎有关的眼部瘙痒。
国内药讯
1.恒瑞HER2-ADC早期临床积极。恒瑞医药在AACR 2023会议上公布其HER2 ADC药物SHR-A1811用于晚期实体瘤后线治疗的最新临床试验数据。数据显示,SHR-A1811在HER2阳性乳腺癌患者中的ORR可达81.5%;在HER2低表达乳腺癌患者中的ORR可达55.8%。而在另一项针对HER2突变NSCLC后线治疗的研究中,SHR-A1811的ORR可达40%,mPFS可达10.8个月。研究中,SHR-A1811的安全性良好,其中间质性肺炎发生率为3.2%。
2.赛神Lp-PLA2抑制剂上Ⅰ期临床。赛神医药新型Lp-PLA2抑制剂SNP318在澳大利亚进入Ⅰ期临床试验,拟开发用于治疗中枢神经系统疾病。脂蛋白相关磷脂酶A2(Lp-PLA2)是一种酶,它可水解低密度脂蛋白(LDL)上的氧化磷脂,产生溶血磷脂酰胆碱(lysoPC)。在临床前研究中,该产品已被证明可以修复血管系统,包括血脑屏障和血视网膜屏障,具有治疗阿尔茨海默病和糖尿病性黄斑水肿的潜力。
3.汉康生技SIRPα融合蛋白获批临床。汉康生技创新融合蛋白HCB101获FDA临床许可,拟开发用于治疗晚期实体瘤及复发难治性非霍奇金淋巴瘤。HCB101是一款与IgG4-Fc连结的工程化SIRPα融合蛋白,旨在通过阻断巨噬细胞和癌细胞之间的“不要吃我”信号来触发巨噬细胞的吞噬活性。临床前数据显示,HCB101可成为一款比其它CD47单克隆抗体或SIRPα融合蛋白更为安全而且更有效的生物制剂。
4.康希诺二价新冠mRNA疫苗获批临床。康希诺生物二价新冠病毒mRNA疫苗获国家药监局临床许可,拟用于预防新冠肺炎。该产品由公司第一代广谱新冠mRNA疫苗和基于Omicron BA.4/5变体的新冠mRNA疫苗组成。在临床前研究中,二价新冠mRNA疫苗相较于单价新冠疫苗对原始毒株、Omicron BA.1、BA.2.75、BA.4/5和XBB.1具有更广谱的中和抗体反应,且具有良好的安全性。
5.过度嗜睡创新疗法在华获批临床。Axsome公司1类化药索安非托片(solriamfetol,Sunosi)获国家药监局临床试验默示许可,拟开发用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度思睡的成年患者的觉醒程度。Solriamfetol是一种双效多巴胺和去甲肾上腺素再摄取抑制剂,已在多项Ⅲ期临床TONES项目中显著改善患者的觉醒维持时间和嗜睡评分。2019年3月,FDA批准solriamfetol上市,治疗与发作性睡病或OSA综合征相关的白天过度嗜睡。
6.晟斯血友病B融合蛋白报IND。郑州晟斯生物申报的1类生物制品“注射用培重组人凝血因子IX-Fc融合蛋白”的临床试验申请获CDE受理。这是该公司研发的重组长效凝血因子产品,拟用于先天性九因子缺乏的血友病B患者的出血控制。值得一提的是,晟斯生物针对血友病布局的在研管线还有注射用重组人凝血因子VIII-Fc融合蛋白(晟斯107)和注射用重组人凝血因子Ⅶa-Fc融合蛋白(晟斯109)。
国际药讯
1.印度疟疾佐剂疫苗获批上市。印度血清研究所PvT Ltd(SIIPL)、Novavax公司与牛津大学开发的疟疾佐剂疫苗R21/Matrix-MTM获得加纳(Ghana)食品和药物管理局的批准上市,用于5至36个月的儿童预防罹患疟疾。在接种三剂主要疫苗后一年进行的R21/Matrix-M加强剂试验中,疫苗对疟疾的高效力呈现持续性,且继续达到WHO疟疾疫苗技术路线图的至少75%疫苗效力目标。
2.默沙东K药联合化疗报胃癌sBLA。默沙东PD-1疗法Keytruda的补充生物制品许可(sBLA)申请获FDA受理,与含氟嘧啶和铂类化疗药物联用,一线治疗局部晚期不可切除或转移性胃癌或胃食管交界处(GEJ)腺癌患者。PDUFA日期为2023年12月16日。在KEYNOTE-859试验中,中位随访为31.0个月时,Keytruda组合较单独化疗显著改善患者的总生存期,死亡风险降低22%(p<0.0001)。
3.罗氏Tecentriq组合肝癌III期临床积极。罗氏在AACR2023年会上公布PD-L1抑制剂阿替利珠单抗(泰圣奇®,Tecentriq®)联合贝伐珠单抗(安维汀®,Avastin®)用于切除或消融后复发风险高的肝细胞癌的III期临床IMbrave050最新数据。中位随访为17.4个月时,联合治疗可减少癌症复发风险28%(HR=0.72,95% CI:0.56-0.93;P=0.0120);目前总生存期(OS)尚不成熟(7%事件率)。药物的安全性与已知研究一致。
4.靶向CD22异基因CAR-T临床前研究积极。Sana Biotechnology公司在《自然-通讯》上发表其低免疫(HIP)修饰、靶向CD22的异基因CAR-T疗法SC262用于治疗人源化小鼠肿瘤模型的临床前积极结果。分析显示,SC262在肿瘤清除的持久性以及CAR-T细胞扩增和持久性方面明显优于未修饰的allo CAR-T细胞。Sana预计今年提交SC262的IND申请,拟开发用于曾接受过CD19靶向CAR-T细胞后失败的肿瘤患者的治疗。
5.默沙东108亿美元布局自免赛道。默沙东宣布将以108亿美元收购免疫治疗药物公司Prometheus Biosciences并获得其潜在“first-in-class”抗TL1A单抗药物PRA023。PRA023可与TL1A特异性结合,具有显著改变TL1A表达水平升高的溃疡性结肠炎(IBD)患者病情的潜力。2022年12月,PRA023在治疗溃疡性结肠炎和克罗恩病的两项Ⅱ期临床中获得积极结果。
6.NK免疫疗法公司获1200万美元融资。专注于脐带血来源开发下一代同种异体NK细胞的药物公司ImmuneBridge宣布完成超额认购的1200万美元的种子轮融资。此轮融资将主要用于建立针对适应症优化的NK细胞的筛选数据集,以证明其可制造性能够被规模化,并开展临床前研究,以用于治疗血液恶性肿瘤和实体肿瘤。此轮融资由Insight Partners和M Ventures共同领投。
7.AZ终止开发一款中后期GLP-1R/GCGR激动剂。阿斯利康宣布终止开发GLP-1R/GCGR激动剂cotadutide(每日1次),并将集中资源开发另一款GLP-1R/GCGR激动剂AZD9550(每周1次)。cotadutide是MedImmune(已被阿斯利康收购)开发的一种胃泌酸调节素类似物,目前已完成4项II期研究。在一项针对伴2型糖尿病的超重或肥胖患者的IIa期研究中,cotadutide组患者体重显著减轻(-3.84kgvs-1.70kg;P=0.0008),HbA1c水平亦显著下降(-0.9%vs-0.6%)。
医药热点
1.5位青年科学家被聘为学部委员。在4月15日上午召开的中国医学发展大会上,来自中国科学院动物研究所的刘光慧,南京医科大学的胡志斌,深圳医学科学院、清华大学的颜宁,武汉大学的宋保亮,上海交通大学的樊春海5位50岁以下的科学家被选聘为新一届的中国医学科学院学部委员,他们的研究领域涵盖衰老和再生医学、分子流行病学、结构生物学和生物化学。
2.北京胸科医院领导班子调整。2023年4月12日上午,北京胸科医院召开干部会议,宣布北京市医院管理中心党委对医院领导班子的调整决定。北京市医院管理中心党委会研究决定任孙树学同志为北京市结核病胸部肿瘤研究所(首都医科大学附属北京胸科医院)副所长(副院长)职务。孙树学表示,在未来的工作中,要尽快转变角色,主动汇入市属医院发展的大潮,敢于担当,为医院的发展贡献力量。
3.中国上市药企研发费用50强。 根据企业披露数据集东方财富choice数据,行业媒体《E药经理人》发布中国上市药企研发费用50强榜单。2022年中国上市药企研发费用前5强排序分别为百济神州(114.25亿元)、恒瑞医药(52.99亿元)、中国生物制药(44.54亿元)、复星医药(43.02亿元)和石药集团(39.87亿元)。
评审动态
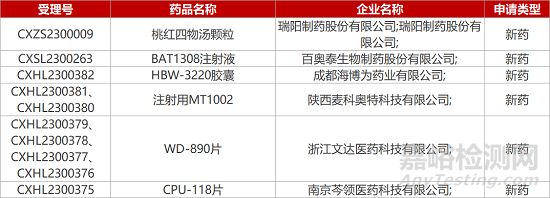
1. CDE新药受理情况(04月17日)
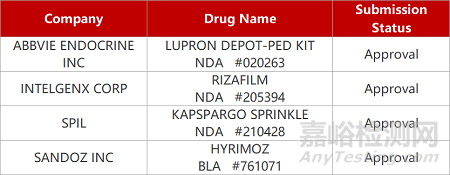
2. FDA新药获批情况(北美04月14日)