【摘要】
目的:初步评估新型柔性、双臂、主从操作的消化内镜微创手术机器人——DREAMS(dual‑arm robotic endoscopic assistant for minimally invasive surgery)系统辅助内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)的可行性。
方法:选用新鲜剥离的健康猪胃作为模型,设计不同大小的类圆形病变10个(胃窦和胃体各5个),由2名内镜医生(甲和乙)独自完成内镜下剥离操作,观察DREAMS系统辅助下的剥离效果(黏膜下剥离速度)、安全性(肌层损伤、穿孔发生率)和操作性能(抓取效率:用每个病变需要夹钳夹取的次数来评估)。
结果:10例机器人辅助下的ESD均顺利完成,10个病变均实现整块切除,病变直径(22.34±2.39)mm,剥离时间(15.00±8.90)min,剥离速度(141.79±79.12)mm2/min,平均每个病变需要夹取4.2次,共有4例(40.0%)ESD出现肌层损伤,无一例穿孔发生。
结论:初步动物实验结果显示,DREAMS系统辅助ESD安全、可行。
与内镜黏膜切除术(EMR)相比,内镜黏膜下剥离术(ESD)能够切除直径>2 cm的病灶,且具有更高的完整切除率和较低的原位复发率,已成为早期胃肠道肿瘤的标准治疗方式。然而,应用传统单通道内镜进行ESD手术难以形成“操作三角”,不能为ESD提供充足的手术视野;同时,现有手术器械自由度较少,使得ESD技术要求高、手术时间长,存在较高的出血和穿孔风险。以上因素限制了ESD在世界范围内的大规模推广和应用。
充分的视野暴露与精巧、灵活的手术器械是高效、安全ESD手术的关键。良好的对抗牵引力是视野暴露的有效手段。近年来,体位牵引、金属夹联合丝线牵引、金属夹联合弹力圈牵引等多种方式被应用于临床,这些辅助牵引方法在一定程度上改善了黏膜下剥离视野,但是其在牵引力大小和方向的控制、黏膜下层张力的调节和牵引位置的改变等方面仍存在局限性。随着人工智能和高端医疗器械的发展,将机器人技术与微创手术技术相结合是解决上述问题的潜在方法。通过模拟外科手术实现“双臂”操作,消化内镜机器人一方面可以提供高效的对抗牵引,另一方面多自由度、精准控制的手术器械提高了手术操作的灵活性,保证了手术质量,有望降低ESD的技术要求。
近年来,多种消化内镜机器人被研发出来,但是仍存在一些问题,如尺寸较大、技术垄断等。针对这种情况,本中心自主研发了一种新型柔性、双臂、主从操作的消化内镜微创手术机器人——DREAMS(dual‑arm robotic endoscopic assistant for minimally invasive surgery)系统,对其进行了充分的应用前测试,并初步评估了其在离体猪胃ESD术中的剥离效果、安全性和操作性能。
材料与方法
一、DREAMS系统总体描述
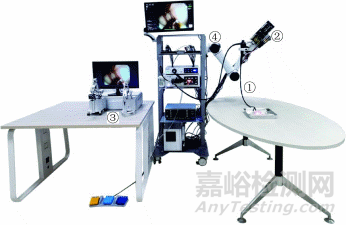
DREAMS系统是一种柔性、双臂、主从操作的内镜机器人系统,由柔性双通道内镜、柔性手术执行器(从手)、操作主手、六自由度定位臂和控制系统组成(图1)。整个系统均为自主研发,针对消化道狭长、多曲的特点,结合消化内镜手术操作要求和医生的操作习惯进行设计,进入人体部分尺寸小、长度大,与软组织交互部分刚柔相济,兼具安全性和有效性。
注:①为柔性双通道内镜;②为柔性手术执行器;③为操作主手;④为六自由度定位臂
图1 DREAMS(dual‑arm robotic endoscopic assistant for minimally invasive surgery)系统整机展示
二、机械结构
1.柔性双通道内镜:柔性双通道内镜具有成像、吸引、副送水、充气、冲洗镜头的功能,通过操作手轮,可实现蛇管上、下、左、右四个方向的摆动,摆动角度可达上210°、下90°、左100°、右100°。前端部外径11.8 mm,集成有双工作通道、超细双照明光纤、微型CCD成像镜头、水气喷嘴和副送水口,其中工作通道分别为3.8 mm 和2.8 mm,兼具尺寸小、工作通道大的特点。插入部有效工作长度>1 030 mm,可以覆盖食管、胃、结肠。图2为柔性双通道内镜实物图。
注:A指示的是上下摆动;B指示的是左右摆动;①为内径2.8 mm工作通道;②为超细双照明光纤;③为副送水口;④为水气喷嘴;⑤微型CCD成像镜头;⑥为内径3.8 mm工作通道
图2 柔性双通道内镜组成及功能展示
2.柔性手术执行器:柔性手术执行器即从手(图3),分为左手和右手。左手为夹钳,集成于柔性操作臂末端。右手为电刀,集成于柔性并联腕关节末端。
注:1~6为左从手各部件,其中1为轴向平移,2为旋转,3为外展,4为内收,5为俯仰,6为夹钳开合;7~9为右从手各部件,其中7为前进,8为偏转,9为俯仰
图3 柔性手术执行器组成及功能展示
柔性操作臂(含末端夹钳)共由五个连杆串联构成,形成6个自由度:轴向平移、旋转、外展、内收、俯仰(提拉)、夹钳开合。柔性操作臂的轴向平移和旋转自由度是通过长距离弹簧管从内镜工作通道入口处传递至柔性操作臂基座实现的,平移范围-55~55 mm,可以覆盖病变组织的直径为20~30 mm。柔性操作臂的外展和内收自由度采用绳索驱动的方式实现,运动范围均为0~60°。通过外展和内收自由度可形成操作三角,避免柔性操作臂连杆遮挡黏膜下视野。柔性操作臂的俯仰自由度旋转轴与外展/内收自由度旋转轴垂直,其运动范围为-60~60°,用来实现对黏膜的提拉,最大提拉高度约为17 mm。末端夹钳采用单边开合的方式,从而减小夹钳开合与外展/内收自由度的耦合。柔性操作臂的外径为3.5 mm,可以顺利通过内径3.8 mm的内镜工作通道。
柔性并联腕关节采用并联式结构,利用四根记忆合金镍钛丝连接基座和末端连杆形成2个自由度:偏转和俯仰,最大弯曲角度均可达90°。电刀集成于柔性并联腕关节末端连杆上,其到柔性并联腕关节旋转轴的直线距离约为14 mm,在偏转自由度作用下,电刀最大可覆盖横向28 mm的病变组织。为了增大电刀的纵向覆盖范围,柔性并联腕关节还具有轴向平移自由度,其运动范围为-39~39 mm。柔性并联腕关节的外径为2.5 mm,可以顺利通过内径2.8 mm的内镜工作通道。
3.操作主手:操作主手为串联式结构,分为左手和右手,分别控制左右从手的运动。操作主手具有3个位置自由度和3个姿态自由度(图4),3个位置自由度用于控制从手的空间位置,3个姿态自由度用于控制从手的姿态,此外,左主手还具有第7个自由度,用于控制左从手末端夹钳的开合。
注:1~3为位置自由度;4~6为姿态自由度;7用于控制左从手末端夹钳开合
图4 操作主手组成及功能展示
4.六自由度定位臂:六自由度定位臂用于承载双通道内镜及柔性手术执行器,其运动可以利用控制面板实现,也可以通过自由拖拽实现。与操作主手类似,六自由度定位臂为串联式结构,具有3个位置自由度和3个姿态自由度(图5)。

注:1~3为位置自由度;4~6为姿态自由度
图5 六自由度定位臂组成及功能展示
三、控制系统
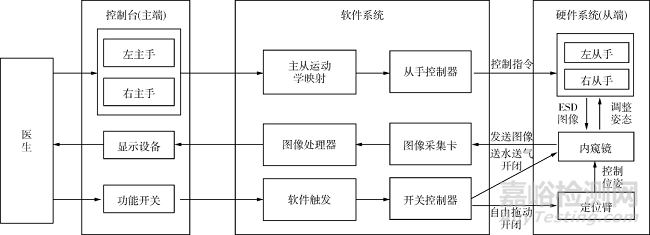
消化内镜微创手术机器人采用主从操作的控制方式,其控制系统主要包括三个部分:控制台(主端)、软件系统和从端硬件系统。主端控制台包括左右主手、显示设备和若干功能开关。首先,内镜通过图像采集卡和图像处理器将目标图像反馈至控制台的显示设备。然后,医生根据内镜反馈的图像控制定位臂自由拖动的功能开关,调整定位臂末端执行器(内镜)的位置和姿态,使其定位到目标组织。之后,医生通过操纵主手控制从手运动。此时,主手的控制指令发送至软件系统,在完成主从映射之后,从手各关节的控制指令发送至从手控制器(Galil,DMC4183),从而实现对从手的控制。此外,在ESD手术过程中,当出现烟雾、出血等情况时,医生可以通过控制台的功能开关打开内镜的送水、送气、吸引功能,快速实现对镜头的清洗,提高内镜视野的清晰度。机器人系统的工作模式如图6所示。
注:ESD指内镜黏膜下剥离术
图6 机器人系统工作示意图
四、DREAMS系统应用前测试
1.生物相容性测试:DREAMS系统与人体接触部分均采用生物相容性良好的材料制备。为了保证DREAMS系统的生物安全性,在应用前对其接触人体部分进行了生物相容性测试。DREAMS系统接触人体的部分主要包含柔性双通道内镜的插入部和柔性手术执行器的插入部。参考标准ISO 10993—1:2018,根据其接触人体的性质和时间,选择细胞毒性、皮内反应和皮肤致敏。按照GB/T 16886.10—2017中规定的试验方法进行取样、测试。
2.电气安全测试:为了保证DREAMS系统的电气安全性,在应用前对整机进行了电气安全测试。依据GB 9706.1—2007,开展接地电阻、漏电流和电介质强度测试。
五、动物实验
1.离体猪胃模型:选用新鲜剥离的健康猪的胃作为模型。为了保证胃壁的柔软和导电性,研究者将猪胃保存于室温环境中,并用生理盐水冲洗。为了充分验证机器人的可操作性,研究者设计不同大小、不同部位的类圆形病变10个:5个病变位于胃窦,直径为15~20 mm,按实验先后顺序编号1~5;5个病变位于胃体,直径为20~25 mm,按实验先后顺序编号1~5。将离体猪胃放于提前准备好的托盘中,保证人工病变位于重力低位。由1名内镜医生预先完成黏膜下注射和环切。
2.手术机器人辅助ESD手术过程:机器人辅助黏膜下剥离由2名操作者(编号:甲和乙)完成。实验开始前,2名操作者接受为期1 d的机器人辅助ESD培训,包括1 h的ESD步骤讲解、1例传统ESD操作观摩和4 h的机器人操作练习。实验应用的高频发射器为华博A350(中国)。主要步骤如下:(1)安装和调试机器人;(2)操纵机器人左手夹持黏膜边缘,暴露黏膜下视野,操纵机器人右手进行黏膜下剥离;(3)剥离完成后,利用左从手夹钳将切下的病变组织取出;(4)向胃内充气,观察有无漏气,以判断有无穿孔;(5)观察剖面。
3.结局指标和相关定义:主要结局指标为黏膜下剥离速度,次要结局指标包括肌层损伤率、穿孔率以及机器人的抓取效率。黏膜下剥离速度由切除黏膜面积(mm2)/黏膜下剥离时间(min)计算得来,切除黏膜面积按照圆形或椭圆形的面积公式计算,黏膜下剥离时间为开始黏膜下剥离至整个病变切除的间隔时间。机器人的抓取效率用每个病变需要夹钳夹取的次数来评估。
结 果
一、DREAMS系统应用前测试结果
生物相容性测试显示其不会导致皮肤过敏和皮内反应,无潜在的细胞毒性,具有良好的生物相容性。电气安全测试结果显示接地阻抗、漏电流及电介质强度均满足国家标准。
二、DREAMS系统在离体猪胃ESD中的有效性和安全性
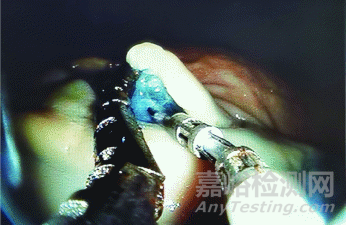
本研究成功完成了10例机器人辅助ESD手术(图7),10个病变均实现整块切除,病变直径(22.34±2.39)mm,剥离时间(15.00±8.90)min,剥离速度(141.79±79.12)mm2/min,平均每个病变需要夹取4.2次,共有4例ESD出现肌层损伤,无穿孔发生,具体情况见表1。
图7 DREAMS系统辅助下离体猪胃的内镜黏膜下剥离术,图中左从手夹持黏膜边缘并提拉黏膜,暴露手术视野,右从手进行黏膜下剥离
表1 两名操作者DREAMS系统辅助离体猪胃内镜黏膜下剥离术的完成情况
|
操作者 |
实验先后顺序编号 |
病变部位 |
病变直径 |
剥离时间 |
病变面积 |
剥离速度 |
是否发生 |
是否发生穿孔 |
|
(mm) |
(min) |
(mm2) |
(mm2/min) |
肌层损伤 |
|
甲 |
1 |
胃窦 |
24.83 |
15.98 |
1 935.90 |
121.15 |
是 |
否 |
|
2 |
胃窦 |
23.24 |
13.57 |
1 695.91 |
124.97 |
否 |
否 |
|
3 |
胃窦 |
22.03 |
12.33 |
1 523.91 |
123.59 |
否 |
否 |
|
4 |
胃窦 |
23.36 |
10.83 |
1 713.47 |
158.21 |
否 |
否 |
|
5 |
胃窦 |
25.7 |
8.98 |
2 073.94 |
230.95 |
否 |
否 |
|
乙 |
1 |
胃体 |
16.38 |
39.73 |
842.48 |
21.21 |
是 |
否 |
|
2 |
胃体 |
21.36 |
17.72 |
1 432.62 |
80.85 |
是 |
否 |
|
3 |
胃体 |
21.25 |
12.03 |
1 417.91 |
117.86 |
是 |
否 |
|
4 |
胃体 |
22.39 |
13.85 |
1 574.12 |
113.65 |
否 |
否 |
|
5 |
胃体 |
22.81 |
5.02 |
1 633.73 |
325.44 |
否 |
否 |
讨 论
近年来,我国消化道肿瘤的发病率和死亡率明显升高,人们逐渐开始重视消化道肿瘤的早诊、早治。及时将消化道早癌安全有效地切除是改善患者生活质量的保障。与EMR相比,ESD可以切除直径>2 cm的病变,且拥有更高的完整切除率和更低的原位复发率;与外科手术相比,ESD具有更小的创伤、更少的手术费用和更短的住院时间等优点,已经成为消化道早癌的标准治疗方式。然而,利用传统的单通道内镜和手术器械进行ESD操作时,内镜医生每次只能应用一个手术器械,且手术器械自由度低、缺乏力感知,医生通过操纵内镜完成病变切除时手术精度低,存在较高的出血、穿孔风险,大大限制了其在偏远地区及某些西方国家的推广和应用。
在外科手术中,医生能够进行双手操作,通过双手配合形成操作三角,手术视野清晰、手术操作灵活。通过消化内镜机器人模拟外科的手术模式是降低ESD技术要求、减少并发症、缩短学习曲线的有效手段。目前,能够完成离体ESD操作的消化内镜机器人以新加坡的EndoMASTER系统、法国的STRAS系统和美国的FLEX系统为代表。EndoMASTER系统由主从手系统和相对独立的三通道内镜系统组成,其两条机械臂通过内镜的两个工作通道到达操作部位,其末端执行器包括电刀和抓钳,抓钳负责提拉病变黏膜,辅助暴露手术视野。STRAS系统是基于Anubiscope平台发展而来的,由一条专用的内窥镜和两条操作臂组成,其两条操作臂通过内镜头端两侧专用的通道伸出,伸出后向内弯曲可形成操作三角,避免对镜头的遮挡。FLEX系统主要应用于头颈部手术,于2017年获得FDA批准用于消化系统ESD手术,该系统的内镜外侧面设计有两个外挂的工作通道,用于两条机械臂的通过。上述机器人均已通过离体实验验证,可以不同程度降低ESD操作难度,缩短手术时间和学习曲线,增加手术安全性。EndoMASTER系统更是通过人体试验进一步证实了其安全性和有效性。尽管如此,目前的消化内镜手术机器人仍存在许多不足,如尺寸较大或工作通道外置,增加了进镜时黏膜损伤的风险,又如整体长度不足,仅能到达直肠和乙状结肠,无法进行近端结肠和上消化道的手术。
本中心研发的消化内镜微创手术机器人有效地解决了上述问题,与现有的消化内镜手术机器人相比,具有以下优点:(1)直径小,外观光滑。本机器人内镜系统与传统内镜相似,无外置工作通道。前端部外径为11.8 mm,与现有检查内镜相似,不会额外增加黏膜损伤的风险。(2)整体长度超过1.3 m,可以覆盖食管、胃、结肠。(3)根据左右从手不同功能,设计不同结构。左从手为夹钳,集成于刚度可变的柔性臂。一方面可以根据手术需要改变刚度,低刚度时顺应柔软、狭长的消化道,高刚度时可承载组织的牵拉力。另一方面,多自由度柔性臂可通过外展和内收形成操作三角,便于手术视野的暴露。右从手为电刀,集成于尺寸小、运动范围大的腕关节,控制简单,覆盖病变范围广。本研究首先通过生物相容性测试和电气安全测试验证了DREAMS系统的生物安全和电气安全,并进一步通过离体猪胃实验证明了DREAMS系统可以辅助操作者安全地完成ESD手术操作,且具有缩短学习曲线趋势。
主从遥控操作引起的末端手术器械与软组织之间交互作用力的感知缺乏是目前手术机器人系统普遍存在的问题。由于缺乏力感知,操作力难以控制,过大的操作力容易对组织造成额外的损伤。利用视觉反馈可以在一定程度上弥补这一缺点,操作者可以通过观察组织形变来估计施加力的大小,但是仍存在力觉信息估计不准确、对操作者和成像系统要求高等问题。将触觉传感器和触觉反馈算法集成到手术机器人系统是实现精准力感知和力反馈的可靠方法。然而,受到操作空间狭小、末端执行器尺寸严格受限的影响,技术难度极高。目前,本系统已经完成微型力传感器的研发和力反馈算法的构建,第二代机器人将实现力感知和力反馈功能的集成。
本研究及机器人系统仍存在一些不足。首先,该研究仅完成10例ESD手术,且机器人仅在黏膜下剥离阶段应用。考虑到黏膜下剥离是ESD手术过程中难度较大、并发症较多的步骤,验证机器人在该步骤的有效性和安全性尤为重要。今后还需要样本量更大的随机对照研究验证机器人在ESD全过程中的应用效果。其次,内镜系统未实现主从控制,手术过程中需要一名助手配合进行内镜微调。设计与传统双通道内镜相似的内镜系统,不改变医生原有的内镜操作习惯,可以在很大程度上促进机器人系统的推广和应用。第二代机器人将根据内镜的结构特点和医生的操作习惯,设计内镜自动控制系统,医生通过操作主手实现对内镜的控制,节省人力,提高手术效率。最后,内镜系统仅设计两个工作通道,ESD手术过程中如使用其他器械需要进行器械替换,延长手术时间。为了在保证机器人使用效果的前提下最大程度上减少内镜系统尺寸,本机器人在设计时仅设计两个工作通道。第二代机器人将综合考虑机器人的尺寸和使用效率,对工作通道的数量和排布进行进一步设计和优化。
总之,本研究介绍了一种新型消化内镜微创手术机器人——DREAMS系统,并对其进行了多方位的应用前测试和初步应用评估,初步结果显示,DREAMS系统操作精准、安全有效,在ESD手术中可有效改善黏膜下剥离视野,降低黏膜下剥离难度,具有较高的手术安全性。但未来还需要更多随机对照试验对其进行进一步评估和验证,在应用反馈中推陈出新,实现DREAMS系统的不断优化和迭代。