某注射剂一致性评价CDE发补中指出“请结合多批次自制样品和参比制剂的检测结果,合理拟定有关物质检查项下的限度要求”。个人认为注射剂有关物质限度制定应考虑自制品及参比配伍实验的测定结果,不能仅考虑样品稳定期间的测定结果,本文从国内外的法规文件要求及案例分析两方面入手进行阐述,不足或错误之处望同行批评指正。
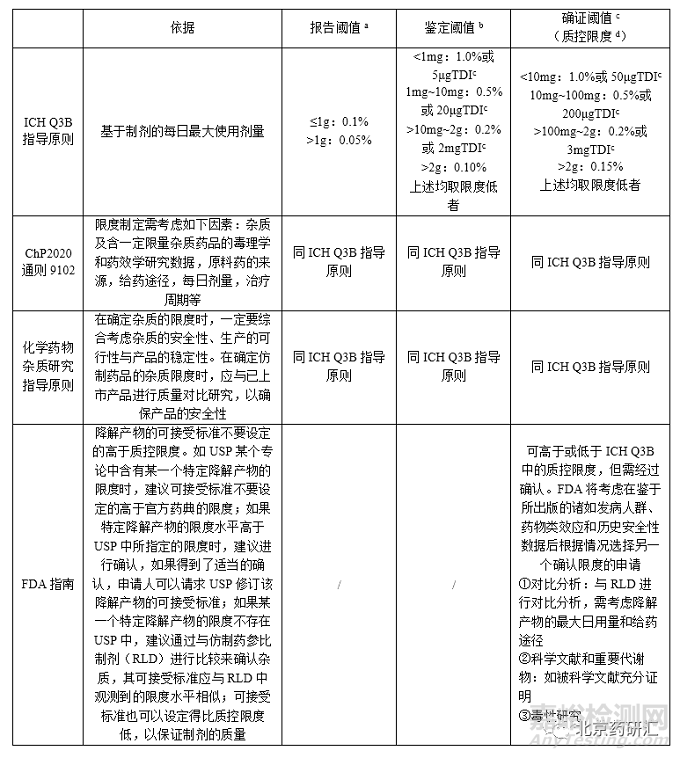
一、现行法规文件中涉及有关物质限度制定的文件主要有:ICH Q3B、《中国药典》2020年版通则9102“药品杂质分析指导原则”、化学药物杂质研究的技术指导原则、FDA指南“仿制药(原料药)中的杂质研究”等。上述文件对制剂中杂质的限度制定对比如下。
表1各国文件对制剂中的杂质限度制定对比
注:a报告阈值是指超出此阈值的杂质均应在检测报告中报告具体的检测数据。
b鉴定阈值是指超出此阈值的杂质均应进行定性分析,确定其化学结构。
c确证阈值是指超出此阈值的杂质均应基于其生物安全性评估数据,确定控制限度。
质控限度是指质量标准中一般允许的杂质限度,如制定的限度高于此限度,则应有充分的依据。
TDI是指药品杂质的每日总摄入量。
ICHQ3B主要是指针对创新药杂质限度制定提供了依据,ChP2020通则9102 《药品杂质分析指导原则》、《化学药物杂质研究指导原则》和FDA指南《仿制药中的杂质研究》为仿制药杂质限度制定提供了路径,但具体到注射剂类,并没有明确规定。
二、案例解析
注射用阿莫西林钠克拉维酸钾(1.2g)
该品种在中国药典和英国药典中均有收载,各国药典标准中的有关物质限度对比如下。
表 2 注射用阿莫西林钠克拉维酸钾各国药典标准杂质限度对比
注:本品最大日服用剂量为阿莫西林钠3g。
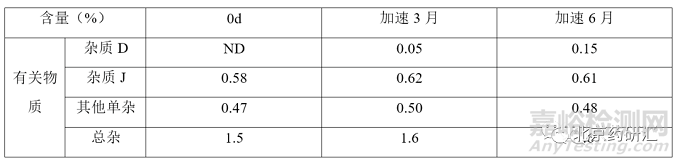
各国药典标准中单杂最严限度为不得过2.5%,杂质D和杂质J限度均为不得过5%,总杂最严为不得过7.0%;该品种加速稳定性期间数据如下:注:本品最大日服用剂量为阿莫西林钠3g。
表 3 注射用阿莫西林钠克拉维酸钾参比制剂稳定性数据
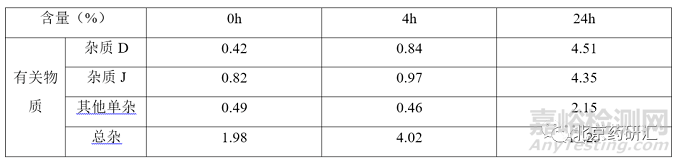
根据参比制剂稳定性数据可知,杂质含量与限度要求相差甚远,该品种效期末配伍稳定性数据如下表所示
表 4 注射用阿莫西林钠克拉维酸钾参比制剂配伍稳定性数据
由表3可知,注射用阿莫西林钠克拉维酸钾各国药典中杂质限度的制定应该是考虑到临床配伍的实际应用。
三、讨论
通常注射剂质量研究中会提前考察原辅料相容性、影响因素、加速等,但配伍研究却比较滞后,往往是申报前才完成,一但出现配伍研究比参比差的情况,后果将不堪设想。因此建议在注射剂小试研究阶段就开展参比及自制品的配伍实验,重点关注其降解杂质,并对其机理进行探究,确保注射剂有关物质限度制定的合理性及临床用药的安全性。
四、参考文献
[1] ICH Q3指导原则
[2] ChP2020版通则9102“药品杂质分析指导原则””
[3] CDE《化学药物杂质研究指导原则》
[4] FDA工业指南-简化新药申请:仿制药中的杂质研究