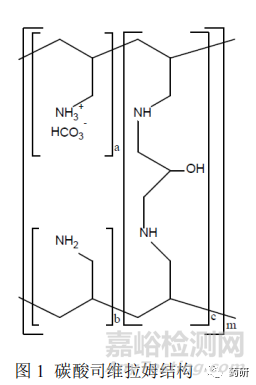
司维拉姆是一种非吸收性的磷酸盐结合剂,是丙烯胺化合物的交联聚合体,含多个胺根,各通过一个碳原子连接到聚合体主链上。口服后在胃肠道内水合膨胀成数倍于原体积的凝胶,胺根以质子化的形式存在,通过离子键和氢键与磷酸分子相互作用结合消化道中的磷酸根,降低血清中的磷酸根浓度,被聚合物结合的磷酸盐不能吸收入体内,以粪便方式排出。临床上用于控制正在接受透析治疗的慢性肾病成人患者的高磷血症[1]。
早期临床使用的磷酸盐结合剂主要为铝剂或钙剂,包括氢氧化铝、碳酸铝、碳酸钙和醋酸钙。由于钙剂和铝剂在体内均能吸收,在降血磷的同时会引起并发症和不良反应,如长期使用铝剂导致铝在全身蓄积,损伤中枢神经系统、骨骼等,出现铝相关性骨病、痴呆和甲状旁腺功能低下等症状;使用钙剂可致长期钙超载,发生高钙血症、软组织和血管钙化、甲状旁腺功能过度抑制、无力性肾性骨营养不良等[2]。
司维拉姆不含铝、钙和其他金属,全身无吸收,安全性较高。Genzyme 公司原研研发的盐酸司维拉姆于1998 年首次在美国获批上市,由于其盐酸基团易引起代谢性酸中毒及血碳酸氢盐水平的下降,目前临床已较少使用[3]。其后又研发了碳酸司维拉姆片,采用碳酸根替代氯离子作为平衡离子,已于 2007 年在美国获得批准上市,商品名为 Renvela,目前已在 50 多个国家和地区批准上市,于 2013 年获准进口我国。在国家药品监督管理局第 22 批参比制剂目录中,Genzyme 公司原研进口的碳酸司维拉姆片被列为参比制剂。国外已有多个碳酸司维拉姆仿制制剂上市,剂型有片剂和口服干混悬剂。
美国食品药品监督管理局(U. S. Food and Drug Administration ,FDA)在 2015 年 9 月发布了碳酸司维拉姆个药指南[4],为碳酸司维拉姆仿制药研发提供了建议。该指南主要包括两部分,分别为活性成分(ActivePharmaceutical Ingredients, API)等同性研究建议以及生物等效性研究建议。本研究基于 FDA 发布的碳酸司维拉姆个药指南以及相关文献和审评经验提出了一些思考,旨在为国内碳酸司维拉姆仿制药的药学研发提供参考。
一、碳酸司维拉姆原料药药学研发探讨
碳酸司维拉姆是一个高度交联的聚合物,属化学药物范畴,不是单一分子,其分子式由一定比例范围的结构单元表示,见图 1。其没有明确的相对分子质量,目前被定义为非生物复杂药[5]。司维拉姆全身无吸收,通常以体外磷结合试验替代人体生物等效性研究。由于其胃肠道局部作用的特性,以及本身聚合物的复杂性,仿制药研发中保证物质基础一致,即自研 API 与参比 API 的等同性至关重要。FDA 碳酸司维拉姆个药指南建议从合成工艺和理化性质表征两方面来进行 API 等同性研究。
a,b – 伯胺基团数 a+b=9;
c – 交联基团数 c=1;
m – 很大的数目,以表示延伸的聚合物网状结构。
1.1 合成路线研究
FDA 鼓励申请人采用与参比 API 相同的合成路线,即聚丙烯胺盐酸盐与环氧氯丙烷交联来生产碳酸司维拉姆,应该向监管机构提供生产工艺和工艺过程控制信息。若采用不同的合成路线,则需要联系仿制药办公室取得同意,并且可能需要指南以外的特性研究来证明 API 的等同性。可以看出,FDA 指南旨在建议仿制药申请人通过工艺路线的一致性使 API 的等同性从源头得到保证。尽管 FDA 提供了碳酸司维拉姆的简要合成工艺路线,但在实际研发和生产中,需要进行更为详细的研究和工艺过程控制。
1.1.1 起始物料研究 如上所述,可选用聚丙烯胺盐酸盐和环氧氯丙烷作为碳酸司维拉姆的起始物料。聚丙烯胺盐酸盐为丙烯胺盐酸盐的聚合物,从完善质量控制的角度,可将聚丙烯胺盐酸盐的合成工艺纳入碳酸司维拉姆的注册工艺中,对聚合反应参数进行详细的研究和控制,影响聚合效果的影响因素通常有单体浓度、引发剂种类、反应时间及温度等[6];常用的自由基聚合反应引发剂有 2,2’-偶氮二丁基脒二盐酸盐、2,2'-偶氮双[2-甲基-N-(2-羟乙基)丙酰胺][7]、偶氮二异丙基咪唑啉盐酸盐[8]等。聚丙烯按盐酸盐的聚合度越高,分子量越大,交联生成的碳酸司维拉姆骨架越稳定;聚合物分子量过小易产生可溶性低聚物杂质,影响产品安全性。
1.1.2 生产过程控制 聚丙烯胺盐酸盐与环氧氯丙烷交联后产物为盐酸司维拉姆,经一定的工艺处理后生成碳酸司维拉姆,再经干燥、粉碎得到目标产品。环氧氯丙烷的投料量直接决定碳酸司维拉姆的交联度。由盐酸司维拉姆生产碳酸司维拉姆的过程,先采用强碱处理得到游离的司维拉姆碱基,然后水洗除去水溶性杂质,可通入二氧化碳气体生成碳酸司维拉姆[9];也可采用碳酸或碳酸盐经离子交换生成碳酸司维拉姆[10]。
根据碳酸司维拉姆大分子聚合物的特性,建议将影响其关键质量属性(critical quality attributes,CQAs)的交联反应、成碳酸盐反应(质子化)、干燥、粉碎等步骤作为关键工艺步骤。对影响产品交联程度的工艺参数如交联反应物料投料比、反应温度和时间,影响碳酸盐含量的工艺参数质子化反应程度,影响产品纯度的水洗参数,影响产品粒度分布的粉碎参数等作为关键工艺参数进行控制。以上为笔者根据相关文献分析的碳酸司维拉姆工艺控制的一般性考虑,在实际生产研发中,生产企业应根据对工艺的理解和掌握程度进行更为细致和全面的研究,以确保生产工艺的可行性和稳健性。
1.2 理化性质表征
与普通的小分子化合物结构确证不同,FDA建议将自研碳酸司维拉姆原料药与从参比制剂中提取的API进行背对背比较研究,至少采用各三批样品用以评价 API 的等同性和生产工艺的稳定性。
对比研究推荐的检测指标和手段包括:①交联度(即交联氨基与总氨基的比例):建议采用 C13 固态核磁共振光谱法(13C SSNMR),通过定量峰面积分析 API 的交联度;②质子化程度(碳酸盐含量):建议采用热重分析法(TGA);③总可滴定胺:建议采用滴定法;④粒径分布;⑤元素分析:结果应该包括 C、H、N元素;⑥溶胀指数:应该报告溶胀指数范围。同时,鼓励申请人进行更多的理化性质表征研究,包括但不限于傅里叶变换红外光谱(FTIR)、拉曼光谱、X-射线衍射(XRD)和差示扫描量热法(DSC)等。通过以上理化性质对比研究来证明自制 API 与参比 API 结构式和分子式的一致性。
从制剂中提取复杂的 API 具有一定的难度,水洗、干燥、粉碎等提取操作可能会改变司维拉姆的粒径分布、溶胀指数等。因此需要在了解参比制剂处方的基础上进行充分的提取研究,在去除辅料的同时还需确保 API 结构不被破坏,或采用适当的措施来消除提取操作对理化性质表征的影响。
1.3 原料药质量研究
1.3.1 有关物质 以烯丙基胺作为起始物料,可能引入的杂质包括烯丙基氯、二烯丙基胺、三烯丙基胺等,应结合起始物料的制备工艺分析相关杂质残留对终产品质量的潜在影响,对起始物料进行全面的质量控制。
不同制备方法引入的工艺杂质可能不同,根据目前通常采用的工艺路线,一般包括起始物料烯丙基胺残留,交联试剂环氧氯丙烷残留,聚合反应引发剂残留,中间体聚丙烯胺盐酸盐残留等。仿制药研发中应结合产品的合成路线,以及对生产工艺的理解针对性地进行工艺杂质分析和研究。
司维拉姆的降解杂质通常包括可溶性低聚物,聚合反应引发剂的降解产物等。可溶性低聚物即为低相对分子质量的聚丙烯胺盐酸盐,在制备司维拉姆时未完全交联产生,也可能为降解杂质。
1.3.2 粒径分布 粒径分布为考察自研 API 与参比 API 等同性的关键指标,同时其对药品的安全性和有效性均具有重要影响。司维拉姆是一种大小不等的高度交联的聚合物,无明确的相对分子质量,每个微粒都可视作一个分子。由于相对分子质量等于粒子本身的质量,其相对分子质量分布是粒径分布的函数[9]。粒径过小其可溶性低聚物偏高,对产品的安全性产生影响。若粒径过大则会对制剂过程产生影响,且粒径过大比表面积越小会影响司维拉姆结构中氨基与磷酸盐的结合能力,进而影响药品的有效性。
1.3.3 交联度 交联度是大分子聚合物的关键质量属性,采用 C13 固态核磁共振光谱法进行分析具有较高的精确度,但由于实验室检测能力和成本问题,通常不作为放行质量标准的日常检测手段。大分子交联聚合物一般难以以分子形式存在于溶剂中,但是能发生一定程度的溶胀,溶胀度取决于聚合物的交联度,因此溶胀指数可用于交联度的间接控制。美国药典碳酸司维拉姆标准草案以及欧盟公布的碳酸司维拉姆原研品审评报告[9]中,均显示对溶胀指数进行了控制。
1.3.4 其他 司维拉姆结合磷酸根的能力来源于聚合物骨架支链上的可离子化胺,因此可滴定胺作为含量检测质量指标。其他一般的质量研究项目包括性状、干燥失重、炽灼残渣、元素杂质、无机杂质、碳酸盐含量等。
二、碳酸司维拉姆片药学研发探讨
在保证仿制碳酸司维拉姆原料药与参比制剂原料药等同的基础上,进行仿制制剂的药学研发相对更容易成功。
2.1 处方工艺研究
化学药品仿制药的研发,应在对参比制剂充分调研的基础上,确定目标产品质量概况(quality targetproduct profile,QTPP)和 CQAs。根据碳酸司维拉姆片原研相关文献[9],其处方中包含的辅料有微晶纤维素、硬脂酸锌、氯化钠、水和欧巴代(薄膜包衣)。主要生产步骤包括:配料和润湿、研磨和混合、压片、包衣、印字。与普通口服固体制剂重点关注的体外溶出不同,碳酸司维拉姆片剂处方工艺研究中应重点考察处方工艺变量对片剂崩解时限和硬度的影响,此外也应关注混合均匀性、脆碎度、有关物质等。文献表明[11],在片剂处方中加入一价阴离子源如氯化钠,可显著提高货架期稳定性,防止崩解时间随片剂在正常贮藏条件下随时间而增加。
2.2 制剂质量研究
碳酸司维拉姆全身无吸收,片剂口服后崩解速度是影响产品发挥作用的关键,因此应对崩解时限进行研究和控制,作为常规检测项目,并在稳定性研究中持续考察。
碳酸司维拉姆片中潜在的杂质包括原料药引入杂质、降解杂质可溶性低聚物等,应在原料药全面的质量控制基础上对制剂中潜在的杂质进行分析研究,制定合理的控制策略。
可滴定胺在一定程度上可反映出产品与磷酸盐的结合能力,作为产品有效性的关键质量属性应进行严格控制。此外,应建立适宜的检测方法对磷酸盐结合能力进行研究和控制,佐证可滴定胺限度控制的合理性。
2.3 体外研究
碳酸司维拉姆属于胃肠道局部作用药物,FDA 发布的碳酸司维拉姆片个药指南和欧洲药品管理局(European Medicines Agency, EMA)发布的胃肠道局部应用、局部作用产品治疗等效性论证的等效性研究指南[12]中,均推荐以体外磷结合研究作为生物等效性评价的替代方法。FDA 指南推荐的体外研究包括平衡结合研究和动力学结合研究。
2.3.1 体外平衡结合研究 该项研究是评估生物等效性的关键性研究。应将自制制剂和参比制剂,在 pH4 和pH7 条件下采用酸预处理或不处理的方式,于至少 8 种不同浓度的磷酸盐溶液中进行孵育,每种磷酸盐溶液中应包含 80mmol·L-1 的氯化钠和 100 mmol·L-1 的 N,N-双(羟乙基)-2-氨基乙磺酸(BES)。试验应该在37℃条件下进行。每一项结合试验应重复至少 12 次。
2.3.2 体外动力学结合研究 该项研究用以支持关键性的平衡结合研究。应将自制制剂和参比制剂,在 pH4和 pH7 条件下采用酸预处理或不处理的方式,于 2 种不同浓度的磷酸盐溶液中孵育至少 8 个不同的时间长度。磷酸盐的浓度应选择相应平衡研究中的最高和最低浓度。试验应该在 37℃条件下进行。每一项结合试验应重复至少 12 次。
三、总结与讨论
碳酸司维拉姆作为新型的磷结合剂,目前国内较少有仿制药获准上市。碳酸司维拉姆是一种高度交联的聚合物,其研究思路与普通小分子化合物存在区别,建议仿制药与参比 API 采用相同的工艺路线,对工艺参数和过程控制等进行重点深入的研究,并与参比 API 进行全面的理化性质表征对比,以确保物质基础的一致性。对于碳酸司维拉姆片仿制药的研发,应基于质量源于设计(quality by design,QbD)的理念,以 CQAs为重点考察指标对处方工艺进行开发,结合碳酸司维拉姆自身特性提出科学的质量控制策略,确保仿制药工艺稳健性和质量可控性。