您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2023-03-16 08:27
从混淆与交叉污染两个层面,对无菌粉针剂产品共线生产的风险进行评估与分析。以产品的工艺风险评估为例,使用潜在失效模式与影响分析(FMEA)风险评估工具,对高风险点采取必要的控制措施,使得风险控制在可接受范围内。风险评估完成后应设置风险回顾周期,以回顾风险控制措施的落实执行情况。
Part1 引言
2010年版《药品生产质量管理规范》提出了质量风险管理的要求,应当根据科学知识及经验对质量风险进行评估,以保证产品质量。
此外,根据GMP第四十六条第一款要求:应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告。
针对我国目前药品生产企业存在的多产品共线、生产设施、系统、设备共用的问题,ISPE基准指南7《基于风险分析的制药产品生产》提出了“初始暴露原理”这一观点。
初始暴露原理,即暴露/交叉污染如何产生的,应考虑以下四个基本因素:
(1)混淆,即错误的物料;
(2)清洁(残留),不充分的清洁;
(3)机械转移过程,将残留风险从一件产品转移到另一产品;
(4)空气转移,即空气中的粉尘接触产品、设备。这四个基本因素归纳起来便是混淆与交叉污染。
因此,本文将从混淆与交叉污染两个层面,对无菌粉针剂产品共线生产的风险进行评估与分析。
Part2 无菌粉针剂产品共线生产风险评估的目的
根据无菌粉针剂产品的特性、工艺和预定用途等因素,无菌粉针剂产品共线生产风险评估的目的是:评估多产品无菌制剂生产使用的厂房、设施及设备共用的可行性,对多品种共线生产可能发生混淆、污染与交叉污染的风险点进行识别,提出降低混淆、污染与交叉污染风险的措施,并加以文件标准化。
另外,因根据风险评估的结果,指导药品生产活动的相关验证。
Part3 无菌粉针剂产品共线生产风险评估与分析
3.1 产品特性的风险分析
根据《药品生产质量管理规范》要求,对于生产特殊性质的药品,如高致敏性药品(如青霉素无菌制剂),必须采用专用和独立的厂房、生产设施和设备;生产β-内酰胺结构类的无菌制剂,必须使用专用设施(如独立的空气净化系统)和设备,并与其他药品生产区严格分开。
对于共线生产的无菌药品,应对它们的产品特性进行分析和识别,从产品的剂型、性状、活性成分、水中溶解度、LD50、致敏性以及共线生产产品之间是否有直接或间接的配伍禁忌等多方面综合评估,选择溶解度差、毒性及致敏性强的产品进行清洁验证,采用合适的清洁方法,防止设备、零部件、取样工具等之间的交叉污染。对于存在配伍禁忌的药品,可考虑采用单独的配液系统、灌装(分装)零部件,在清洁程序结束后应进行必要的检验,符合要求后才能供其他产品生产使用。
3.2 产品工艺的风险评估与分析
以无菌粉针剂产品(分装工艺)为例,其工艺流程如图1所示,主要的工艺点包括:原料药的取样、玻璃瓶的清洗干燥灭菌、胶塞的清洗灭菌、分装及分装工器具的清洗灭菌、铝盖的清洗灭菌及轧盖、贴签包装,应对每一个工艺点可能产生混淆、污染与交叉污染的风险点进行识别。
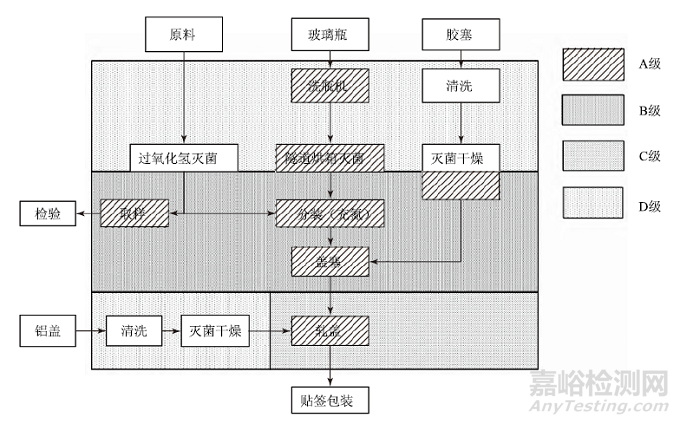
图1 无菌粉针剂产品工艺流程
对于识别的风险点,可使用风险评估工具———潜在失效模式与影响分析(FMEA)进行风险分析。FMEA认为每一个潜在失效模式的风险系数可以通过对潜在风险的严重性、发生的可能性和可检测性这三个属性进行衡量,这三个属性的综合评价指标则为风险系数(Risk Priority Number,简称为RPN),其计算方法为:风险系数(RPN)=严重性(S)×可能性(O)×可检测性(D)。严重性、可能性、可检测性评分标准如表1所示。

表1 严重性、可能性、可检测性评分标准
通过计算风险系数,对风险等级高的风险点制定必要的控制措施,使风险降低至可接受范围。风险系数接受标准:RPN≤10。
对于无菌粉针剂产品共线生产各工艺点的风险评估,其风险系数评估结果如表2所示。
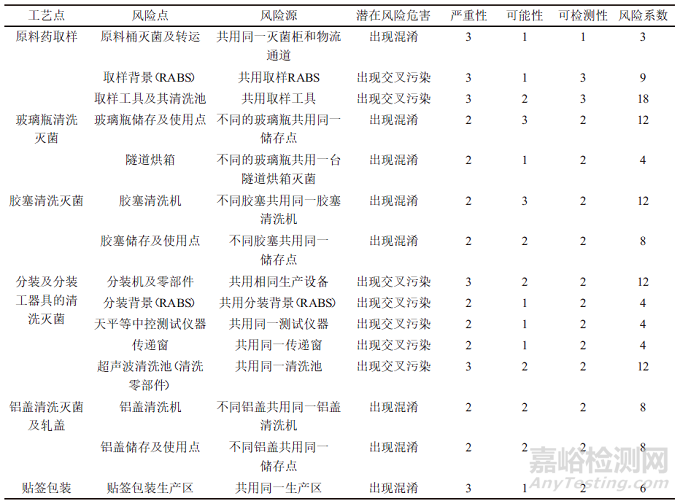
表2 无菌粉针剂产品共线生产各工艺点的风险系数评估结果
对于风险等级高的风险点,首先应制定必要的风险控制措施,然后进行二次FMEA分析,二次FMEA分析的残余风险应在可接受范围内,对于采取的风险控制措施应进行必要的文件标准化,使制定的风险控制措施落实到位。二次风险系数评估结果如表3所示。
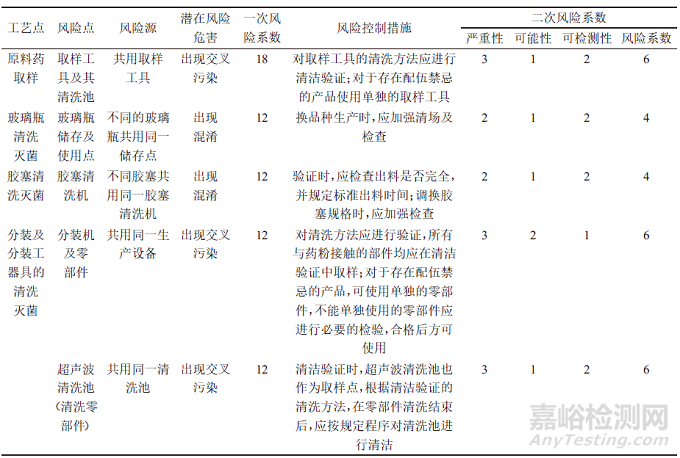
表3 无菌粉针剂产品共线生产各工艺点的二次风险系数评估结果
3.3 公用设备、设施及人/物流的风险分析
3.3.1 空调系统的风险分析
利用空调系统,可以使空气的湿度、温度、洁净级别及压差达到所需状态。空调系统在共线生产中,应对新风、回风、排风系统及布局进行风险分析。
(1)由于回风和排风系统中可能会引入飘在空气中的药粉,所以在风险评估时应重点考虑排风口及新风口位置是否靠得太近,从而引起污染与交叉污染;
(2)带有回风的房间在取样、生产不同产品时,应有足够的自净时间,以防止引起污染与交叉污染;
(3)洁净室室内压力应保持高于外部压力,可通过调节回风量和排风量进行压差调整,确保洁净室压差符合要求,防止物料及人员进出时,由于气流倒吸引起污染与交叉污染。
3.3.2 人/物流的风险分析
对于生产区域的人/物流,应规定合理的流向,两者应合理区分,防止混淆、污染与交叉污染的产生。
若洁净区不同生产线的工作衣集中清洗,在不同生产线工作时,工作衣存在交叉污染的风险;同一洁净区不同生产线的物流通道若相同,则可能存在混淆的风险。
3.3.3 其他公用系统的风险分析
其他公用系统包括纯化水系统、注射用水系统、蒸汽系统、压缩空气系统、氮气系统。其主要风险点为:
(1)循环型公用系统,使用过程中若产生负压,可能通过系统引起交叉污染;
(2)单向正压系统,在停机、开机过程中可能引起交叉污染;
(3)负压系统,在停机过程中可能引起交叉污染。
因此,无菌粉针剂生产企业应该确保各公用系统在使用过程中均为正压,纯化水系统、注射用水系统的送水输送泵应该采用由回水压力反馈信号控制的变频驱动,保证在用水高峰时段系统能够保持正压状态。
Part4 风险回顾
在完成风险评估后,应当设置风险回顾周期,主要回顾风险控制措施的落实执行情况:有无违反可接受限度的情况发生;有无影响原来控制措施落实的因素,如设备变更、控制系统变更对原有控制措施产生影响;控制措施落实是否引入新的风险。如在生产活动中有相关偏差产生,应立即进行事件回顾。
Part5 结语
无菌粉针剂产品共线生产的风险评估应包括产品特性的风险分析,产品工艺的风险评估与分析,公用设备、设施及人/物流的风险分析,通过风险评估,对多品种共线生产可能发生混淆、污染与交叉污染的风险点进行识别,并提出降低混淆、污染与交叉污染风险的措施,从而确保产品质量及用药安全。
参考文献
[1] 药品生产质量管理规范:卫生部令第79号[A].
[2] 贾晓艳,秦淑亮.浅析多产品共线的风险评估[J].机电信息,2013(29):18-21

来源:制药工艺与装备


