近年来,心衰治疗正处于一个发展和变革的时代。对新机制、新药物的研究如火如荼,使多机制、多通路早期联合治疗的新理念正在不断巩固。
沙库巴曲缬沙坦,是首个血管紧张素受体脑啡肽酶抑制剂(ARNI)类药物,也是全球首款心衰治疗领域的突破性创新药物。
资料显示,沙库巴曲缬沙坦是一种心血管系统用药,临床上主要用于治疗慢性心力衰竭。本品是由沙库巴曲(脑啡肽酶抑制剂)和缬沙坦(血管紧张素受体拮抗剂)组成的复方制剂,通过LBQ657(前药沙库巴曲的活性代谢产物)抑制脑啡肽酶(中性肽链内切酶;NEP),增加脑啡肽酶所降解的肽类水平(例如利钠肽)。同时通过缬沙坦阻断血管紧张素II的1型受体(AT1),在心力衰竭患者中沙库巴曲缬沙坦钠可产生心血管和肾脏作用,此时还可抑制血管紧张素II依赖性醛固酮释放。
据了解,沙库巴曲缬沙坦由瑞士诺华研发,原研产品沙库巴曲缬沙坦钠片于2015年7月获得FDA批准上市,为全球首款治疗心衰创新药。2017年7月,沙库巴曲缬沙坦钠片首次获批进入国内市场,2019年通过谈判纳入全国医保乙类目录,2021年成功续签,并新增原发性高血压适应症。
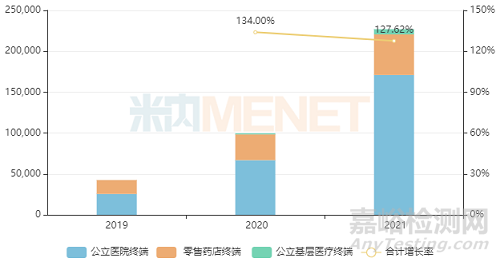
米内网数据显示,原研产品沙库巴曲缬沙坦钠片2021年全球销售额达35.48亿美元。且该产品近年来在中国三大终端6大市场的销售额增速均达三位数,2021年首次突破20亿元,同比增长127.62%,市场潜力十足。
近年来中国三大终端6大市场沙库巴曲缬沙坦钠片销售情况(单位:万元)
(来源:米内网数据)
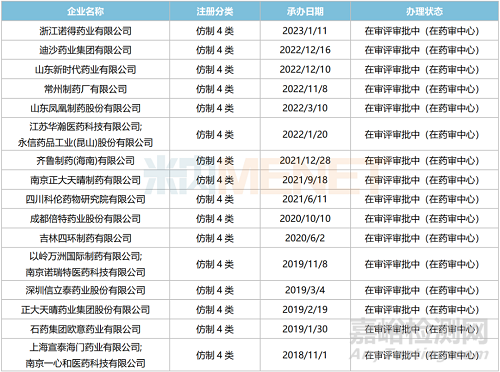
此外,米内网数据显示,目前国内有超10家企业以仿制4类提交沙库巴曲缬沙坦钠片上市申请,其中上海宣泰海门/一心和最早报产,其上市申请于2018年11月获得CDE承办受理,目前正处于第二轮资料发补。此外,石药欧意、正大天晴、信立泰等企业的产品处于第一轮资料发补。
沙库巴曲缬沙坦钠片新分类报产情况
(来源:米内网数据)
随着我国人口老龄化加剧,冠心病、高血压等慢性病的发病率逐年上升,心衰作为心血管疾病“最后的战场”,其患病率及死亡率一直居高不下。
据悉,我国成年人心衰患病率达1.3%。截至2021年底,我国60岁以上的老年人口已达2.67亿,而心衰的发病率和患病率均随年龄增加, 80岁以上人群心衰患病率可达近12%。随着我国人口老龄化加剧,冠心病、高血压、糖尿病、肥胖等慢性病的发病呈上升趋势,医疗水平的提高使心脏疾病患者生存期延长,导致我国心衰患病率呈持续升高趋势。根据弗若斯特沙利文公布的数据,2019年我国心衰患者人数约为1067.8 万人,预计2030年达到1614.0万人。
目前,药物治疗是防治慢性心衰的一线疗法,而沙库巴曲缬沙坦是目前指南中推荐的一线药物。临床研究表明,沙库巴曲缬沙坦比传统的ACEI或者ARB药物的疗效更为显著和持久,可以明显减少慢性心衰患者的死亡率,明显改善患者的生活质量。
然而,在采用标准治疗方案情况下,心力衰竭仍是致命的临床顽疾,心衰治疗市场仍存在巨大而未被满足的临床需求。
药品进口备案不断优化,国内患者有望更快获得进口新药
近日,广东省药监局印发《药品监督管理局关于优化药品进口备案工作的指导意见》的通知。《意见》中提了优化药品进口备案流程、推动大湾区药品医疗器械监管创新、持续强化药品进口备案监管等内容。
其中,对于进口业务量大、信用记录良好的进口单位,《意见》明确首次申请进口备案时应现场核验《药品注册证书》(或者《医药产品注册证》)(正本或者副本)原件。上述进口单位后续申请同一进口药品备案的,无需前往口岸局现场提供《药品注册证书》原件。
进口药品发生处方工艺、质量标准、生产场地等质量安全性相关事项变更的,应按首次进口办理。进口单位申请生物制品以及首次进口药品进口备案,经抽样检验符合标准规定的,药品口岸监管机构出具检验报告以及启封文书后,允许进口单位直接解封上市。
此外,还明确了进口备案工作时限要求。各口岸局应严格执行《药品进口管理办法》有关规定,在备案材料受理后1个工作日出具《进口药品通关单》。
据了解,广东省这几年其实一直在不断优化药品进口备案工作,在2022年11月印发的《广州市全面加强药品监管能力建设具体措施》中,就提出过优化完善药品进口备案、第一类医疗器械备案、普通化妆品备案的技术核查机制和决策机制等内容。
而除了广东省,还有不少省市近年来在推进药品监管同时,也在不断优化完善药品进口备案。如2022年9月,海南省出台了《海南自由贸易港药品进口便利化若干规定》,于12月1日起施行。《若干规定》坚持推进药品进口通关便利化和强化药品质量事中事后监管理念,取消进口药品通关单、调整备案时间、优化通关流程,并免费为企业提供通关凭证,同时强调企业主体责任,强化药品安全监管措施。
2021年3月12日,海口市市场监督管理局发布《关于进一步优化<进口药品通关单>备案行政审批的公告》(以下简称《公告》),明确自当日起,海口市办理的《进口药品通关单》备案行政审批事项可实行全流程互联网“不见面审批”。《公告》提出,海口市办理的《进口药品通关单》备案行政审批事项,审批过程中可不收取纸质材料,转而由申请人根据申请事项登录相关行政审批系统,进行网上申报,按照要求上传电子扫描材料即可。
2018年,重庆获批设立了“首次进口药品和生物制品口岸”,成为继北京、上海、广州后,第四个可进口首次在中国境内销售的药品和生物制品的城市。
业内认为,对于进口药品注册管理的不断优化,可以使中国患者在临床研究阶段就接触到更多新的药品;同时,也将加速进口新药中国上市进程,使得患者在第一时间接触到新药成为可能。当然,在加速进口新药上市速度的同时,我国对于药品控价方面的经验积累也或将助力进口新药可及性的增强。