近期,纽约州立大学石溪分校Donghui Zhu教授课题组在期刊 Bioactive Materials 上发表研究论文。为了提高纯锌的低机械强度和不均匀局部降解行为,考虑其在降解和生物相容性方面的改进潜力,该研究设计并制备的Zn-Fe 合金显著提高了力学性能并促进了均匀降解,显示出优异的抗菌性能和体内皮下和股骨组织中的生物相容性。综上所述,Zn-Fe 合金可能是用于各种心血管、伤口闭合和骨科应用的生物可吸收医疗植入体的理想候选材料。
1、研究内容简介
可生物降解材料制成的生物可吸收植入体可以临时支撑受伤的组织,然后在组织恢复过程中慢慢降解,当组织恢复后完全降解无需二次手术。与可降解聚合物相比,可降解的金属,包括镁 (Mg)、铁 (Fe) 和锌 (Zn),具有更高的机械强度,适用于承重组织应用。锌具有中等降解速率和显著的生物学作用,因此被认为是心血管和骨科应用中最有希望的植入体候选材料。尽管如此,纯锌的机械强度仍然低于临床应用标准。此外,由于纯锌植入体的局部降解行为,它们在降解过程中的机械完整性会进一步降低,从而可能导致植入手术失败。
为了提高纯锌的低机械强度和不均匀局部降解行为,合金化是解决这些困难的最有效方法之一。在筛选候选合金元素时,考虑其在降解和生物相容性方面的改进潜力,我们提出铁作为 Zn 的合金元素,并研究了体外和体内这些合金在皮下和股骨组织中的性能。
为了研究 Zn-Fe 合金微观结构的影响,根据之前对 Zn-Fe 二元体系中的相图的详细研究,选择了 0.4 %和 2.5%(质量百分比)的 Fe 来获得两种具有不同百分比金属间化合物的可降解Zn-Fe合金。众所周知,塑性变形加工技术可以显著提高金属的机械性能,包括机械强度和韧性。因此,在本研究中,我们进一步挤压 Zn-Fe合金以获得足够的机械性能以用于不同需要的医疗应用场景中, 例如心血管、伤口闭合和骨科应用。此外, 实验探索了大鼠中体内的两种模型: 皮下植入和股骨植入。这两个体内植入位置提供了锌合金植入体在软组织和硬组织中的综合评估以应用于不同的生物医学应用。
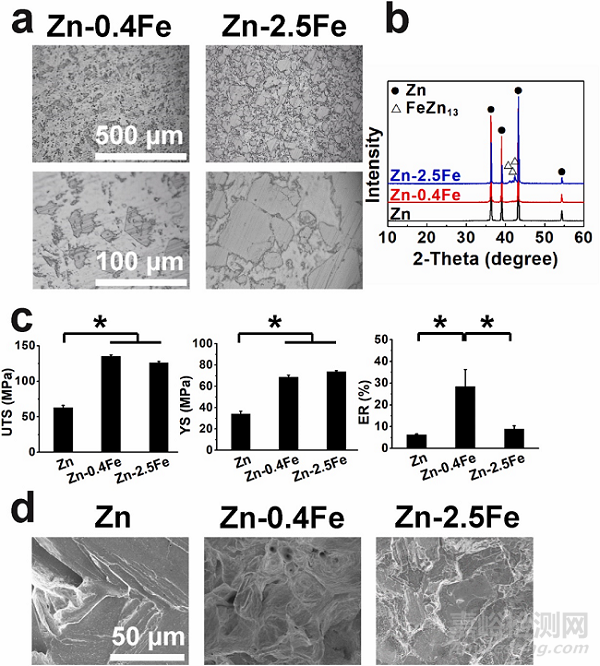
图1. 挤压态 Zn-Fe 合金的显微组织和力学行为。(a) 微观结构(b) XRD 图谱,η-Zn 和 FeZn13相分别在 Zn-0.4Fe 和 Zn-2.5Fe 合金中占主导地位。(c)力学性能。UTS:极限抗拉强度,YS:屈服强度,ER:断裂伸长率。两种合金都显示出显著提高的机械强度, 而 Zn-0.4Fe 合金的伸长率(~30%)明显高于纯 Zn(8%)和 Zn-2.5Fe 合金(~10%)。(d)拉伸试验后的断裂形貌。
纯 Zn 呈现带解理面的解理断口形貌,而Zn-0.4Fe合金呈现带河纹的凹坑断口形貌。然而,随着 FeZn13的增加,Zn-2.5Fe合金表现出具有河流纹路的脆性断裂形貌。
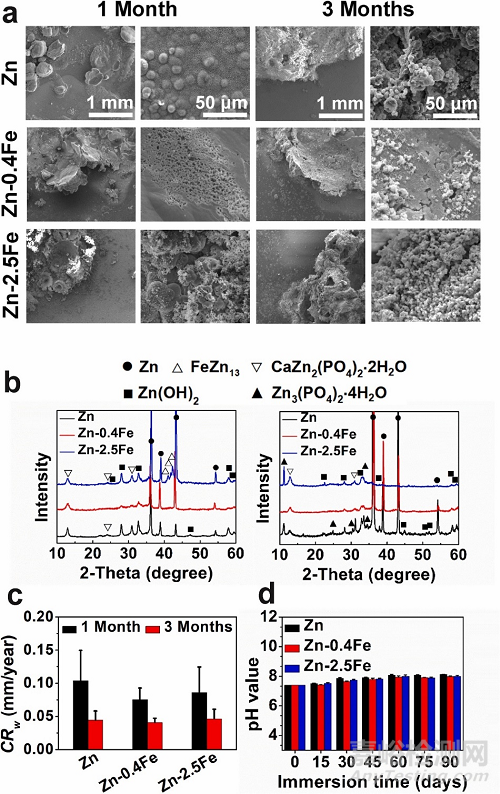
图2. Zn 和 Zn-Fe 合金在Hanks模拟体液中浸泡1个月和3个月的腐蚀降解行为。(a)表面形貌,(b) XRD 图谱,(c) 腐蚀速率,(d) pH 值随浸泡时间的演变。
锌在长达 1 个月的时间内表现出均匀的降解形貌,但在 3 个月的浸泡过程中转变为局部降解并出现腐蚀点。少量的铁添加将降解模式改变为更均匀的降解模式。1个月后其表面出现均匀分布的小凹坑,3个月后在降解表面形成由腐蚀产物组成的薄膜。然而,随着合金中 Fe 含量的增加,降解模式变为严重的局部降解。
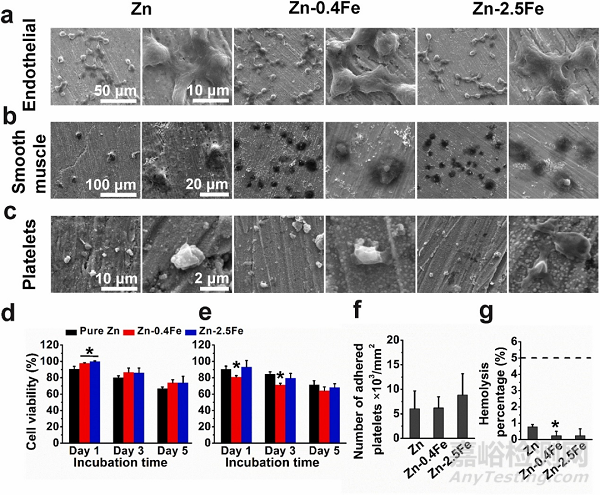
图3.Zn 和 Zn-Fe 合金的细胞相容性和血液相容性。(a) 内皮细胞、(b) 平滑肌细胞和 (c) 血小板的粘附形貌、(d) 内皮细胞和 (e) 平滑肌细胞的细胞活性、(f) 粘附血小板的数量和 (g) 溶血百分比。* p < 0.05,表示与纯锌组相比的差异比较。
与纯Zn相比,两种 Zn-Fe 合金对内皮细胞表现出更高的细胞活性,而Zn-0.4Fe合金对平滑肌细胞的细胞活性降低。所有Zn表面上粘附的血小板数量也相似,在 Zn-2.5Fe 合金上略有增加。两种合金的溶血率均低于纯锌的溶血率,但均远低于溶血极限(5%),表明它们具有良好的血液相容性。
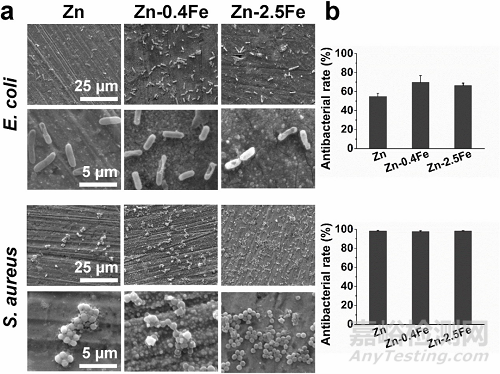
图 4. 纯锌和锌铁合金与大肠杆菌和金黄色葡萄球菌一起培养24 小时的抗菌性能。(a) 细菌粘附在样品表面的 SEM 图像。(b) 培养基中的抗菌率。
我们之前对纯锌和不锈钢材料的可比抗菌研究所述,两种细菌污渍很容易聚集在不锈钢表面形成厚厚的生物膜。在所有锌材料的表面上有少量细菌粘附并且没有生物膜形成。这些材料上甚至有一些破碎的大肠杆菌细胞。所有的Zn材料对金黄色葡萄球菌表现出比大肠杆菌更高的抗菌率。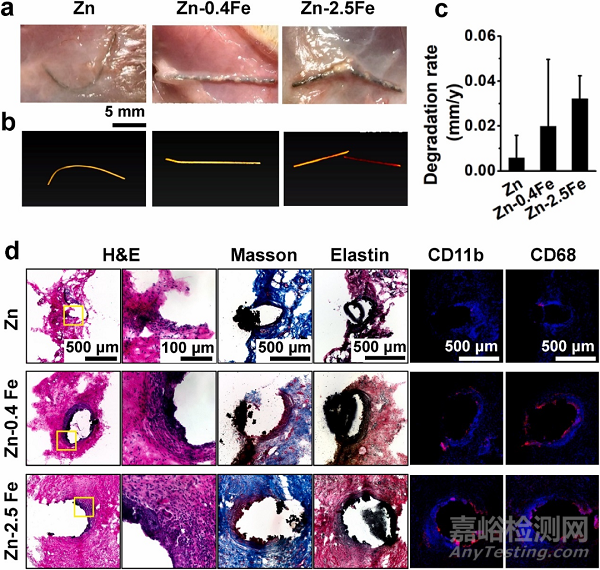
图 5.(a) 宏观视图,(b) 显微 CT 扫描图像,和 (c)体内降解速率,以及 (d) 植入大鼠皮下组织3个月后植入体的H&E、Masson、弹性蛋白和免疫荧光染色(CD11b 和 CD68)。
组织学染色显示所有植入体周围都有纤维化包裹(图 5d)。Masson 和 Verhoeff 染色还分别显示了这些 Zn 植入体的胶原蛋白和弹性蛋白的形成。CD11b 和 CD68 的免疫染色显示单核细胞/巨噬细胞的聚集。植入3个月后,对纯锌丝植入体几乎没有免疫反应。对 Zn-Fe 合金,尤其是 Zn-2.5Fe 合金有更强的免疫反应,这可能与植入体与周围组织界面处形成的大量降解产物有关。
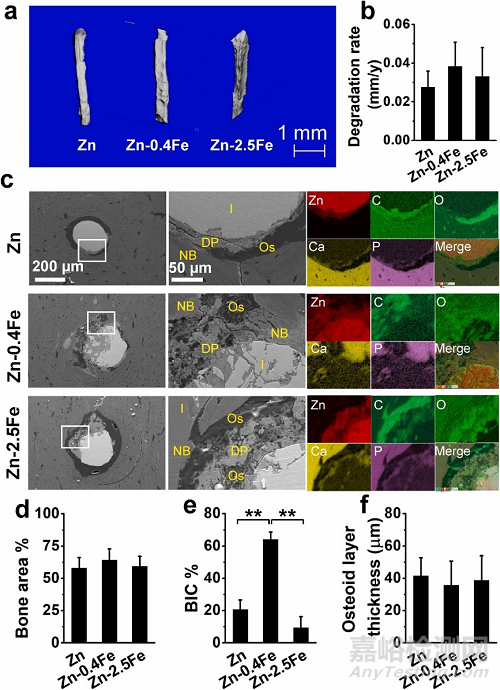
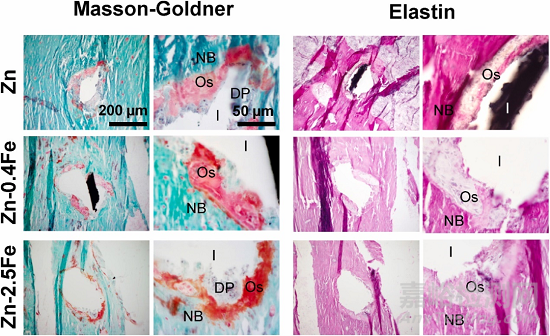
图 6. 纯 Zn 和 Zn-Fe 合金植入股骨组织 3 个月后的体内降解和骨形成。(a) 显微 CT 扫描图像,(b) 降解速率,(c) 横截面 SEM 图像和 EDS 元素图谱,(d) 新骨面积百分比,(e) 骨-植入体接触比 (BIC),和 (f) 类骨质层厚度。I:植入体,DP:降解产物,OS:类骨质层,NB:新生骨。
EDS图谱中Ca、P含量较少(图6c),Masson-Goldner染色呈砖红色,以及弹性蛋白染色呈浅红色(图7),这些都对应类骨质组织,即在成熟骨之前形成的未矿化骨基质。Zn-0.4Fe合金在横截面上具有松散的降解产物和更深的腐蚀,其显著更高的骨-植入体接触比(BIC)表明其更好的骨整合能力。尽管 Zn-2.5Fe 合金也有较厚的降解产物层和类似的类骨质层厚度,但类骨质层确实覆盖了大部分植入体表面,从而显著降低了 BIC 值。
图 7.纯 Zn 和 Zn-Fe 合金丝植入大鼠股骨组织 3 个月后Masson-Goldner 和 Elastica van Gieson染色。Masson-Goldner染色中绿色为成骨组织, 类骨质呈砖红色,而在弹性蛋白Elastica染色中粉红色为成骨组织, 浅红色对应类骨质组织。I:植入体,DP:降解产物,OS:类骨质层,NB:新生骨。
与体外细胞相容性相比,体内植入可以直接显示宿主和组织对锌材料的反应。所有 Zn 材料周围都有皮下纤维化包裹组织,但 Zn-Fe 合金最初更强的巨噬细胞活性可能有利于免疫调节和促进愈合过程(图 5)。与纤维化包裹组织形成类似,类骨质层也出现在股骨植入中。Zn-Fe 合金的降解产物会破坏类骨质组织层的覆盖,从而与类骨质组织混合(图 6c)。利用降解产物中高含量的钙和磷,类骨质组织可以矿化为新形成的骨组织。Zn-0.4Fe 合金的均匀降解行为可能有利于这种生物矿化过程,因此诱导了更高的骨整合。
以上结果表明,Zn-Fe 合金中均匀分布的第二相显著提高了力学性能并促进了均匀降解,从而增强了它们的生物相容性。均匀分布在 Zn-0.4Fe 合金中的硬而细的 FeZn15相提供了机械强度和延展性的光学组合以及均匀的降解行为。尽管所有 Zn 材料都表现出相似的腐蚀速率、体外细胞粘附、体内纤维化包封和类骨质形成,但 Zn-0.4Fe 合金表现出更好的血液相容性和体内骨整合。此外,这些 Zn-Fe 合金显示出优异的抗菌性能。综上所述,Zn-Fe 合金可能是用于各种心血管、伤口闭合和骨科应用的生物可吸收医疗植入体的有希望的候选材料。