台湾行政院卫生著食品药品管理局(Taiwan FoodandDrugAdministration,简称TFDA),http://www.wiselinkchina.com/taiwan/负责监管在台湾上市的医疗器械,换言之,所有本土和境外医疗器械制造商希望在台湾上市其医疗器械,必须获得TFDA的注册批准
為有效控管醫療器材之安全、效能及品質,醫療器材管理法從醫療器材商、生產源頭控管、上市前把關、上市後監督及產品通路及法規諮詢輔導,建立完善的醫療器材全生命週期(Total product life cycle)品質管理政策。各項說明如下:
醫療器材定義:
依據醫療器材管理法第三條,本法所稱醫療器材,指儀器、器械、用具、物質、軟體、體外診斷試劑及其相關物品,其設計及使用係以藥理、免疫、代謝或化學以外之方法作用於人體,而達成下列主要功能之一者:
診斷、治療、緩解或直接預防人類疾病。
調節或改善人體結構及機能。
調節生育。
醫療器材分類分級:
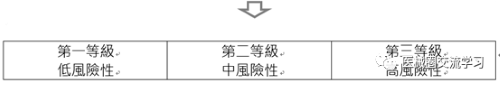
另依據醫療器材分類分級管理辦法,醫療器材依功能、用途、使用方法及工作原理,視其應用科分為16大類,並依風險程度,分為以下三個等級:第一等級(低風險性)、第二等級(中風險性)及第三等級(高風險性)。
分類類別類別名稱:
臨床化學及臨床毒理學
血液學、病理學及基因學
免疫學及微生物學
麻醉科學
心臟血管醫學科學
牙科學
耳鼻喉科學
胃腸病科學及泌尿科學
一般、整形外科手術及皮膚科學
一般醫院及個人使用裝置
神經科學
婦產科學
眼科學
骨科學
物理醫學科學
放射學科學
若無法判定產品是否屬醫療器材,可向我们知汇wiselink提出醫療器材屬性管理查詢申請。
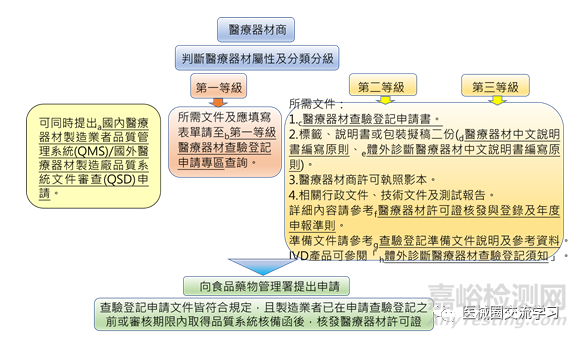
醫療器材登錄:
醫療器材上市後安全:醫療器材上市後管理,主要為確保市售醫療器材之品質與安全,部分特定高風險醫療器材須執行安全監視,醫事機構並應協助配合辦理。業者亦應主動監控上市後產品之風險管理,進行必要矯正預防措施。
有關醫療器材定期安全監視報告、醫療器材嚴重不良事件通報及主動通報醫療器材安全危害警訊等相關規定或繳交方式,可至醫療器材上市後安全專區查詢。
醫療器材商:
欲製造、販賣或供應醫療器材者,應先取得醫療器材商許可執照。
醫療器材商包含醫療器材製造業者或販賣業者,其可執行業務分述如下:
醫療器材製造業者:
一、從事醫療器材製造、包裝、貼標、滅菌或最終驗放。
二、從事醫療器材設計,並以其名義於市場流通。
醫療器材販賣業者:
經營醫療器材之批發、零售、輸入、輸出、租賃或維修之業者。醫療器材製造業者或販賣業者,應向所在地衛生局辦理登記,詳細規定請參考醫療器材商及其技術人員管理專區。
醫療器材流向管理:依醫療器材來源流向資料建立及管理辦法,經中央主管機關公告一定風險等級之醫療器材,醫療器材商及醫事機構應建立與保存產品直接供應來源及流向之資料;另經中央主管機關公告之品項,前項建立及保存之資料應向中央主管機關申報。前述「應建立與保存來源及流向資料之醫療器材」及「應申報來源及流向資料之醫療器材品項」,其品項範圍、資料建立與保存方式、保存年限、申報內容、方式及其他應遵行事項之辦法,請至醫療器材來源流向暨單一識別系統(UDI)專區查詢。








