今日头条
上海和径EED抑制剂获批临床。和径医药宣布,该公司与上海科技大学合作开发的新型胚胎外胚层发育蛋白(EED)抑制剂HJM-353已分别获得FDA和NMPA的临床批准,计划尽快在中美同步在晚期血液肿瘤和实体瘤患者中开展Ⅰ期临床。HJM-353旨在通过阻断三甲基化的组蛋白H3第27位赖氨酸(H3K27me3)与EED的结合,破坏了H3K27me3-EED-EZH2的相互作用,从而实现对PRC2整体活性的抑制。
国内药讯
1.阿斯利康「依库珠单抗」新适应症报产。阿斯利康依库珠单抗注射液新适应症的上市申请获CDE受理,推测适应症为视神经脊髓炎。依库珠单抗是一款“first-in-class”C5补体抑制剂,通过抑制补体级联反应终端的C5蛋白,降低炎症反应。该新药已获FDA批准用于阵发性睡眠性血红蛋白尿症、非典型溶血性尿毒症综合征、抗乙酰胆碱受体抗体阳性的全身型重症肌无力以及视神经脊髓炎谱系疾病。
2.云顶新耀引进肾病新药拟纳入优先审评。云顶新耀从Calliditas公司引进的布地奈德迟释胶囊(Nefecon)的新药上市申请获CDE拟纳入优先审评,用于治疗原发性免疫球蛋白(IgA)肾病。值得一提的是,该药此前已被CDE纳入突破性治疗品种。在关键Ⅲ期NefIgArd试验A部分中,Nefecon较安慰剂降低患者27% (P=0.0003) 的尿蛋白肌酐比。Nefecon已在欧美获批上市,是全球治疗IgA肾病的首个靶向药。
3.信达KRAS抑制剂拟纳入突破性治疗品种。信达生物从劲方医药引进的KRAS G12C抑制剂1类新药GFH925(IBI351)片获CDE拟纳入突破性治疗品种,用于至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌(NSCLC)患者。在Ⅰa期研究中,IBI351在55例可评估患者中,客观缓解率(ORR)为50.9%,疾病控制率(DCR)为92.7%。信达拥有该新药在大中华区的开发和商业化权利。
4.博瑞GLP-1R/GIPR激动剂获批减肥临床。博瑞医药1类化药BGM0504注射液获国家药监局临床许可,拟开发用于超重或肥胖症的治疗。BGM0504是一款GLP-1/GIP受体双重激动剂,可激动GIP和GLP-1下游通路,产生控制血糖、减重和治疗NASH等生物学效应,展现多种代谢疾病治疗潜力。今年10月,礼来同靶点药物Mounjaro(tirzepatide)减肥适应症被FDA授予快速通道资格,预计明年获批上市。
5.驯鹿BCMA靶向CAR-T获FDA临床许可。驯鹿生物宣布全人源BCMA嵌合抗原受体自体T细胞注射液CT103A已获FDA批准,即将在美国开展针对复发/难治性多发性骨髓瘤的临床试验。CT103A以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a铰链和跨膜、4-1BB共刺激和CD3ζ激活结构域。今年6月,伊基仑赛注射液(CT103A)针对上述适应症的上市许可申请已获CDE纳入优先审评。
6.德琪与默沙东达成全球临床合作。德琪医药CD73小分子抑制剂ATG-037拟联合默沙东PD-1抑制剂帕博利珠单抗(Keytruda)开展Ⅰ期剂量探索(STAMINA-001)研究,评估单药和联合用药治疗局部晚期或转移性实体瘤的安全性和初步疗效。在临床前研究中,ATG-037单药以及与免疫检查点抑制剂或化疗联用均显示出积极的抗肿瘤活性。德琪医药将负责试验的开展。
7.纽福斯联手Apellis开发眼科基因疗法。纽福斯宣布与全球补体药物公司Apellis达成战略合作,共同开发基于补体调节治疗地图样萎缩(GA)/干性老年性黄斑变性(dAMD)的基因治疗研发项目。Apellis开发的靶向补体C3的聚乙二醇化双环肽疗法pegcetacoplan(Empaveli®)用于治疗GA/dAMD的适应症开发已完成Ⅲ期临床试验,并已获得FDA优先审评资格,有望成为全球首个针对该疾病的补体治疗药物。
国际药讯
1.NASH药物奥贝胆酸重新报NDA。Intercept公司宣布已重新向FDA递交其FXR激动剂奥贝胆酸(OCA)的新药申请,用于治疗因非酒精性脂肪性肝炎(NASH)导致的肝硬化前期伴有肝纤维化。FXR通常在肠与肝脏中表达,是胆酸、炎症反应、纤维化与代谢通路的关键调节分子。在III期临床中,奥贝胆酸较安慰剂使患者实现肝纤维化程度至少改善1级且NASH情况没有恶化的比例更高(22.4%vs9.6% p<0.0001),该结果与Intercept在2019年公布的结果一致。
2.礼来布局多肽偶联药物。礼来与PeptiDream公司将利用后者专有的肽发现平台系统(PDPS)技术,针对礼来选择的靶标,共同发现和开发创新多肽偶联药物(PDC)。根据协议,PeptiDream将负责肽创建和优化工作,确定高亲和力的环状肽,从而能够向特定细胞和组织输送有效载荷;礼来将负责有效载荷的创建和优化工作,以及后续PDC产品的开发。该项交易总额超12.35亿美元。
3.FDA拒绝批准帕罗伐汀用于治疗FOP。益普生收到FDA针对帕罗伐汀(palovarotene)用于治疗进行性肌肉骨化症(FOP)的新药申请发出的完整回复函。FDA要求益普生提交额外的临床数据。Palovarotene是一款选择性视黄酸受体γ (RARγ)激动剂,通过作用于骨形态发生蛋白(BMP)I型受体ACVR1/ALK2,抑制其下游通路异常激活,以抑制异位骨化。在III期MOVE研究中,palovarotene将患者的异位骨化比率下降了62%。
4.BCL-2抑制剂联合治疗CLL临床前研究积极。来自俄亥俄州立大学的研究团队在Journal of Hematology & Oncology杂志上发表的最新研究论文显示,罗氏与艾伯维联合开发的“first-in-class”BCL-2抑制剂Venclexta(venetoclax)联合新一代BTK可逆抑制剂Nemtabrutinib,可作为venetoclax与ibrutinib的替代方案,用于慢性淋巴细胞白血病(CLL)的临床治疗。Venclexta能够选择性地靶向结合一些血液癌症和实体瘤细胞上高度表达的BCL-2蛋白并抑制其活性,从而恢复肿瘤细胞凋亡的过程。Venclexta已获得FDA多个突破性疗法认定。
医药热点
1.新冠肺炎更名 实施乙类乙管。12月26日,国家卫健委发布公告和《关于印发对新型冠状病毒感染实施“乙类乙管”总体方案的通知》,将新型冠状病毒肺炎更名为新型冠状病毒感染;自2023年1月8日起,解除对新型冠状病毒感染采取的《中华人民共和国传染病防治法》规定的甲类传染病预防、控制措施,不再纳入《中华人民共和国国境卫生检疫法》规定的检疫传染病管理;明年1月8日起,对新型冠状病毒感染实施“乙类乙管”,不再对入境人员和货物等采取检疫传染病管理措施。
2.全面排查并取消医保不合理限制。国家医保局印发《关于全面排查并取消医保不合理限制的通知》,要求各地医保部门全面深入排查医保不合理限制。《通知》明确,要重点排查医保在协议管理、预算管理、审核结算、考核评价、基金监管等方面是否存在不合理限制和要求,导致医疗机构在为参保人员提供医疗服务过程中产生不方便甚至损害参保人员利益的行为。
3.国家卫健委:重症床位资源总体充足。12月27日,国家卫健委医政司司长焦雅辉在新闻发布会上通报,在床位资源方面,我国二级以上医疗机构总床位数是561.6万张,近期床位使用率在60%左右浮动。截止到12月25日全国重症医学的床位总数是18.1万张,也就是10万人有12.8张,其中三级医疗机构的重症医学床位数是13.34万张,可转换ICU的床位是10.48万张,二级以上医疗机构重症床位的使用率平均是在50%左右波动,全国重症床位资源总体充足。
评审动态
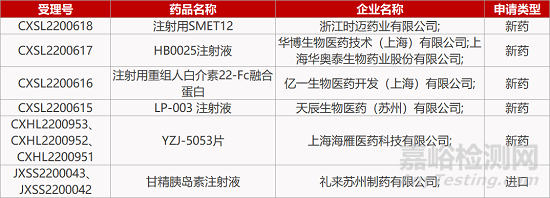
1. CDE新药受理情况(12月27日)
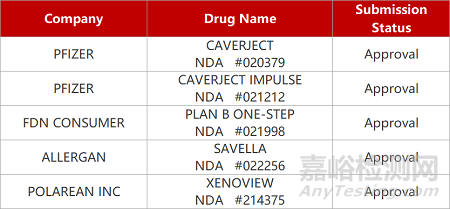
2. FDA新药获批情况(北美12月23日)