细菌内毒素是是革兰氏阴性菌的细胞壁成分,当细胞死亡或自溶后便会释放出内毒素,如果被大量注射进入血液时可引起发热、微循环障碍、内毒素休克及播散性血管内凝血等反应——又叫“热原反应”。因此,在注射剂中需严格控制细菌内毒素。
二 如何制定化学药品注射剂细菌内毒素限度
化学药品注射剂细菌内毒素限度制定思路:
①根据《中国药典2020年版》1143 细菌内毒素检查法中公式L=K/M计算得出限度,其中L为供试品的细菌内毒素限值,K为人每千克体重每小时最大可接受的内毒素剂量,M为人用每千克体重每小时的最大供试品剂量;
②结合《中国药典2020年版》9251 细菌内毒素检查法应用指导原则要求;
③查找各国药典(如美国药典、英国药典、日本药典)以及进口注册标准收载的该产品细菌内毒素要求。
综上,选择最严格的细菌内毒素要求作为本品的限度值。
三 化学药品注射剂细菌内毒素带入途径
(1)原辅料本身的细菌内毒素
在注射剂中细菌内毒素贡献占比最大,需要根据产品的细菌内毒素来计算控制原辅料的细菌内毒素。
(2)直接接触产品的内包材
直接接触产品内包材如西林瓶、胶塞、安瓿等,在生产使用时会要求除去细菌内毒素并进行验证,验证标准是内毒素能够降低3个log值。在产品细菌内毒素贡献占比较小。
(3)从容器、用具、管道和装置等带入
按照GMP规定对生产时所有接触药品的工器具等需按照要求进行清洗,并用适宜的方法除去细菌内毒素和灭菌并进行清洗验证。在产品细菌内毒素贡献占比较小。
(4)保存时间
药液在配制生产中有可能微生物会增长进而引起细菌内毒素增加,因此需要对生产时限进行考察并进行验证,还有药品在稳定性放置期间也有可能使细菌内毒素增加,也需进行考察。
综上,在药学研发过程中我们需要重点控制原辅料带入的细菌内毒素,其他带入途径可按照现行GMP要求在生产中进行控制,原辅料带入的细菌内毒素越低,成品的细菌内毒素就越低。
四 对于化学药品注射剂细菌内毒素限度较高的产品如何控制
对于注射剂细菌内毒素限度较高的产品来说,我们采取产品组分的贡献结合生产线的贡献来综合评估控制策略,其中原辅料贡献占比最大,我们会通过产品的细菌内毒素计算控制原辅料的细菌内毒素。
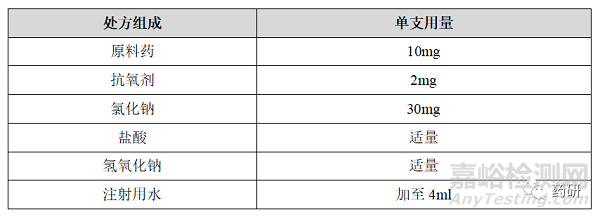
如假设某注射剂产品规格为4ml:10mg,制定的产品细菌内毒素是80EU/ml,其单支处方组成如下:
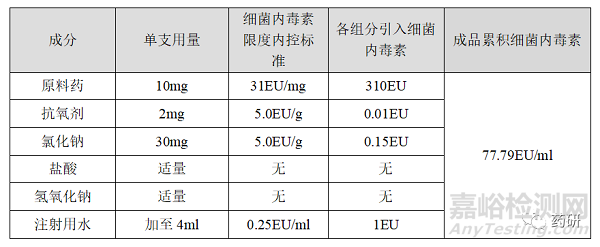
对于注射用水可以按照中国药典要求进行细菌内毒素为0.25EU/ml,盐酸和氢氧化钠分别为强酸和强碱会破坏细菌内毒素,不需进行控制,氯化钠和抗氧剂细菌内毒素可结合辅料供应商实际情况进行制定,可控制为5.0EU/g。对于原料药来说,可用产品的细菌内毒素减去辅料、内包材、工器具贡献的细菌内毒素得到,因此,一般会控制原辅料的细菌内毒素贡献值低于产品的细菌内毒素,如本品最大可控制原料药细菌内毒素为31EU/mg,可有效降低制剂中细菌内毒素超标的风险,各组分的细菌内毒素控制水平如下表:
综上,控制原辅料带入的细菌内毒素进而控制成品的细菌内毒素水平。
五 对于注射剂细菌内毒素限度较低的产品如何进行控制
对于注射剂细菌内毒素限度较低的产品我们如果按照上述方法去计算和控制原辅料的细菌内毒素,便会发现得到的原辅料细菌内毒素限度非常低,按照常规的生产条件,根本无法有效的控制住每批的原辅料细菌内毒素,那这时我们就需要通过其他手段去控制注射剂细菌内毒素。
之前制剂生产厂家会在生产过程中加入活性炭来去除细菌内毒素,但由于活性炭有可能会增加引入新的杂质和不溶性微粒的风险等,影响注射剂产品质量。国家药监局药审中心在发布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中提到注射剂生产中建议不使用活性炭。
现目前在注射剂中常用超滤进行去除细菌内毒素。超滤是切向过滤,与常规的垂直过滤不同,液体切向流过膜表面时,流体产生的跨膜压差使部分药液压过滤膜,截留部分则在系统内循环回流,且切向过滤对膜表面一直进行冲刷,不易堵塞滤膜。超滤原理就是依靠分子量不同来去除细菌内毒素,化药原辅料常规分子量在几百到几千道尔顿,而细菌内毒素分子量通常为几十万道尔顿,分子量相差甚大,由此可有效的去除细菌内毒素。
超滤可以加在原辅料生产工序中,也可以在制剂端加超滤工序,需要根据实际情况选择。比如加在制剂端,可以根据各国药典要求结合生产厂家实际情况,设置原辅料的细菌内毒素要求,再根据注射剂产品细菌内毒素筛选合适的超滤系统。超滤系统类型有中空纤维膜柱和平板膜包等,进口的生产厂家有颇尔,赛托利斯等,国产的生产厂家有杭州科百特等。
六 小结
细菌内毒素是注射剂中重要的关键质量属性,最有效的就是控制原辅料本身带入的细菌内毒素水平,但有时对原辅料细菌内毒素要求太高,通过常规生产手段不能达到,这时,最常见的就是在原辅料或者制剂生产过程中添加超滤工序,如果超滤加在制剂端,还需要做相容性研究,比如化学兼容性、提取实验、重复使用研究等。对于细菌内毒素,还需特别注意其不能通过湿热灭菌去除。若有不妥之处,还请指教!