您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-18 10:59
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
宿州科越双靶点补体获批Ⅱ期临床。科越医药双功能抗体融合蛋白KP104获NMPA临床许可,拟开展Ⅱ期临床用于治疗阵发性睡眠性血红蛋白尿症(PNH)。KP104能特异性地同时抑制补体旁路和末端途径,具有潜力可治疗单靶点疗法不足以治疗的补体介导的疾病。该新药目前正在多项Ⅱ期临床中评估用于治疗IgA肾病(IgAN)、C3肾小球病(C3G)、继发于系统性红斑狼疮(SLE-TMA)的血栓性微血管病和PNH的潜力。KP104用于治疗PNH已获得FDA授予的孤儿药资格。
国内药讯
国际药讯
1.全球首款现货型T细胞疗法获CHMP支持。Atara公司与Pierre Fabre开发的即用型同种异体T细胞疗法Ebvallo(tabelecleucel)获欧洲药品管理局人用药品委员会(CHMP)推荐批准,用于治疗两岁以上儿童和成人复发或难治性Epstein-Barr病毒阳性移植后淋巴增生性疾病。在关键III期ALLELE研究中,该药的总体ORR达到50%(19/38,95% CI:33.4,66.6)。如果获批,Ebvallo将成为全球首款获批的现货型T细胞疗法。
2.葛兰素史克RSV疫苗Ⅲ期临床成功。葛兰素史克针对老成人的呼吸道合胞病毒(RSV)候选疫苗的关键Ⅲ期临床达到主要终点。该疫苗包含重组亚基预融合RSV F糖蛋白抗原 (RSVPreF3) 与葛兰素史克专有的AS01佐剂。数据分析显示,疫苗在60岁以上人群针对RSV下呼吸道疾病(RSV-LRTD)的总体有效性达到82.6%;在70-79岁的老年人中的保护效力达到93.8%(95%CI,60.2-99.9)。该疫苗总体耐受性良好。葛兰素史克计划今年下半年提交上市申请。
3.遗传性肌萎缩疗法Ⅱ期临床积极。BridgeBio公司创新口服疗法BBP-418(ribitol)治疗肢带型肌营养不良2i型(LGMD2i)患者的Ⅱ期临床最新结果积极。12个月治疗数据显示,BBP-418可使患者的αDG糖基化增加,患者的肌酸激酶(CK)水平与基线相比下降超75%;患者的NSAD评分与10MWT步行检测亦有所改善。未观察到治疗相关严重不良事件与剂量限制性毒性。两家公司预计明年启动BBP-418的Ⅲ期临床试验。
4.礼来口服小分子GLP-1R激动剂早期临床积极。礼来在EASD2022年会上公布非肽类口服GLP-1R激动剂LY3502970治疗2型糖尿病的I期临床研究结果。84天的治疗结果显示,LY3502970组患者的最大血药浓度(Cmax)范围为60 ng/mL至236 ng/mL,血药浓度达峰时间(tmax)中位数为4~8小时。患者的HbA1c降幅1.5%~1.8%(安慰剂组降幅0.4%),减重1.6kg~5kg(安慰剂组体重增加0.5kg)。未报告与临床相关的肝脏异常或药物相关的严重不良事件。
5.礼来布局创新代谢疾病疗法。礼来与Nimbus公司将利用后者强大的药物发现引擎和基于结构的药物设计专长,合作开发和商业化新型AMPK激动剂,以用于代谢性疾病的治疗。根据协议,Nimbus公司将负责AMPK激动剂的药物发现工作,而礼来将负责合作产品的全球开发和商业化活动。Nimbus公司将根据包含研究、开发和商业化过程中的里程碑,可能获得总金额高达到4.96亿美元的款项。
6.日本富士终止「法匹拉韦」新冠III期研究。日本富士宣布已停止其广谱抗流感药物法匹拉韦片(Avigan)用于治疗尚未接种疫苗的COVID-19患者的III期临床开发。由于疫苗接种率提高和奥密克戎变异株的重症率下降,该项试验只招募了84例受试者。临床数据分析显示Avigan的疗效不佳,该公司目前已撤回相应适应症的上市申请。2020年,Avigan曾在治疗非重症COVID-19患者的III期临床达到主要终点,显著缩短病毒转阴时间(中位缓解时间:11.9天vs14.7天,p=0.0136)。
医药热点
1.医保局:暂未考虑将种植牙纳入医保支付。国家医疗保障局日前发布《对十三届全国人大五次会议第6184号建议的答复》,针对将种植牙纳入医保支付范围的建议给出相关答复。国家医保局表示,当前我国基本医疗保险制度立足于保障参保人的基本医疗需求,种植牙属于更高层次的医疗需求,暂时未考虑将种植牙纳入医保支付范围。
2.厦门大学附属中山医院全面开放周末门诊。厦门大学附属中山医院日前推出一系列线上线下门诊惠民举措。自10月15日起,厦大中山医院在原有“无假日门诊”基础上增开“周末门诊”,重点提高对一些患者需求量高的“热门科室”和“热门专家”的周末出诊率,安排周六和周日每个科至少有专家门诊和普通门诊开放。同时,中山医院大力提高医技检查效率,加快检查报告出具时间。超声、影像(CT检查)实行“错峰预约”,磁共振检查增加周末及夜班班次,超声科增加午间超声开诊。医技项目除磁共振检查外,力争做到“当日开单、当日检查、当日出结果”。
3.传奇生物创始人范晓虎重返学术界。应用免疫学与免疫细胞治疗领域领军人物、南京传奇生物创始人范晓虎离开工业界,获任西安交通大学基因与细胞治疗研究院院长。根据西安交通大学第一附属医院官网,10月15日上午,传奇生物创始人、前首席科学官范晓虎特聘教授签约仪式暨西安交通大学基因与细胞治疗研究院揭牌仪式举行,会上为范晓虎教授颁发西安交通大学基因与细胞治疗研究院院长聘书。
评审动态
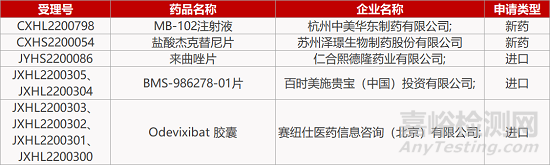
1. CDE新药受理情况(10月17日)

来源:药研发


