您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-29 11:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.传奇BCMA CAR-T获批日本上市。日本厚生劳动省批准传奇生物开发的BCMA-CAR-T疗法Carvykti(西达基奥仑赛,Cilta-cel)上市,用于治疗既往接受过至少三种治疗(包括免疫调节药物、蛋白酶体抑制剂和抗CD38抗体)并且末次治疗出现疾病进展的复发或难治性多发性骨髓瘤(R/R MM)成人患者。在一项Ⅰb/Ⅱ期研究中,cilta-cel达到96.9%(95%CI,91.2-99.4 n=97)的总缓解率(ORR)和67%(95%CI,56.7-76.2)完全缓解率。该疗法已获FDA和欧盟批准上市。
2.辉瑞PDE-4抑制剂新适应症在华报产。辉瑞克立硼罗乳膏(舒坦明,Eucrisa,Staquis )新适应症的上市申请获CDE受理,推测用于3个月及以上儿童和成人特应性皮炎患者。克立硼罗是一款小分子、非激素、非甾体类抗炎的外用磷酸二酯酶4 (PDE-4)抑制剂,由辉瑞收购Anacor公司所得。2020年7月,克立硼罗软膏在中国获批上市,用于治疗2岁及以上的轻重度特应性皮炎患者。
3.施维雅EGFR抗体组合报Ⅲ期临床。国家药监局受理施维雅(SERVIER)递交的抗体组合疗法futuximab/modotuximab(S95026)的Ⅲ期临床试验申请,该试验将联合曲氟尿苷替匹嘧啶片为既往接受过标准治疗和抗EGFR治疗的KRAS/NRAS和BRAF野生型转移性结直肠癌患者提供三线或后续治疗选择。S95026由2种抗EGFR单克隆抗体组成,可靶向EGFR上的非重叠表位,诱导EGFR快速内聚化和降解。该项试验将纳入包括中国、美国、日本、欧盟以及澳大利亚等共500例患者。
4.翰森引进植物来源骨关节炎新药。翰森制药与KiOmed公司就后者一款已在欧盟上市的膝骨关节炎创新产品KiOmedine vs One达成合作许可协议。KiOmedine vs One是一款植物来源KiOmedine CM壳聚糖产品,单次注射后,患者骨关节炎症状缓解至少可持续6个月。据协议,翰森制药将获得该新药用于骨关节炎相关适应症在中国大陆、澳门及台湾的开发、注册及商业化独家授权。KiOmed将获得预付款和开发、注册和商业化最高6600万欧元的里程碑潜在付款,以及产品的销售分成。
5.再鼎引进FIC宫颈癌ADC。再鼎医药宣布与Seagen公司就后者“first-in-class”抗体偶联药物Tivdak(tisotumab vedotin-tftv)达成独家合作和许可协议,获得Tivdak在中国内地、香港、澳门和台湾的开发和商业化权益。2021年9月,FDA已加速批准Tivdak上市,用于治疗接受化疗治疗后出现进展的复发或转移性宫颈癌患者。根据协议,Seagen将获得3000万美元的预付款,开发、注册及商业化里程碑潜在付款以及Tivdak的销售分成。
国际药讯
1.参天EP2激动剂获FDA批准上市。FDA批准参天制药与UBE公司开发的0.002%的Omlonti滴眼液(Omidenepag Isopropyl)上市,用于降低原发性开角型青光眼或高眼压症患者的眼压。Omlonti是全球首款选择性前列腺素E2受体(EP2)激动剂,已于2018年在日本获批上市。该新药可同时增加小梁网和葡萄膜巩膜的房水外流以发挥降低眼内压的效应。在美国开展的III期研究显示,Omlonti在降低眼压方面非劣于标准疗法噻吗洛尔。
2.首款CRISPR/Cas9基因编辑疗法申请上市。Vertex公司与CRISPR公司联合开发的自体CRISPR/Cas9基因编辑疗法exagagglogene autotemcel (exa-cel,CTX001),日前已启动向FDA递交滚动上市申请,用于治疗输血依赖性β-地中海贫血(TDT)和严重镰状细胞病(SCD)。如果获批,将成为FDA批准的首款CRISPR药物。此前公布的CLIMB-111、CLIMB-121和CLIMB-131研究的实验数据显示,在44例TDT患者中,有42例在随访为1.2~37.2个月时,不再依赖输血,平均总血红蛋白水平超过11 g/dL;在31例SCD患者中,随访为2.0~32.3个月时,所有患者均未出现血管闭塞性危象,平均胎儿血红蛋白占比40%。
3.卫材/渤健Aβ抗体达Ⅲ期临床终点。卫材和渤健联合开发的Aβ抗体lecanemab在治疗轻度阿尔茨海默病和阿尔茨海默病导致的轻度认知障碍(MCI)患者的Ⅲ期临床Clarity AD达到主要终点。与安慰剂组相比,lecanemab治疗组18个月后患者的认知和功能能力的评分量表CDR-SB的临床衰退减缓27%。在意向治疗群体中代表着评分值差异为-0.45(p=0.00005)。该试验同时达到所有关键性次要终点。此前,FDA已受理该新药的BLA申请并授予其优先审评资格。
4.罗氟司特改良型制剂银屑病III期临床积极。Arcutis公司罗氟司特(0.3%)泡沫制剂治疗银屑病的关键III期ARRECTOR研究达到主要终点和所有次要终点。与安慰剂组相比,罗氟司特泡沫制剂组第8周时,患者达到头皮皮肤症状清除或几乎清除的IGA评分基础上改善2%的比例更高(67.3%vs28.1%,P<0.0001),达到身体皮肤症状清除或几乎清除的IGA评分基础上改善2%的比例也更高(46.5%vs20.8%,P<0.0001)。药物的总体耐受性良好。此前,Arcutis开发的罗氟司特(0.3%)乳膏已获FDA批准上市,适应症为斑块状银屑病。
5.大麻解毒药ANEB-001最新临床数据积极。Anebulo公司大麻素受体拮抗剂ANEB-001用于治疗急性大麻素中毒(ACI)的II期临床B组前两队列数据积极。B组口服21mg四氢大麻酚受试者接受ANEB-001(10mg或30mg)或安慰剂治疗。与安慰剂相比,ANEB-001治疗组受试者视觉模拟量表(VAS)评分高分者的数量减少(p<0.001),VAS警觉性量表改善(p<0.01),并且服用四氢大麻酚导致的身体摇摆减少(p<0.01);而且药物的不良事件是轻度和短暂的。
6.赛诺菲拟用CRISPR技术改良NK细胞疗法。赛诺菲与诺奖得主Jennifer Doudna博士创建的基因编辑公司Scribe达成合作协议,将利用Scribe专有的CRISPR平台进行离体NK细胞疗法的开发。根据协议,Scribe公司一系列定制的CasX编辑器(XE)将会协助赛诺菲扩展其NK细胞疗法在癌症治疗方面的运用。Scribe将获得2500万美元的预付款,以及开发与商业化高达10亿美元的里程碑后期款项。
医药热点
1.河南:市级中医院要达三级。河南省日前印发《河南省“十四五”中医药发展规划》提出,力争到2025年,建设3个以上国家(中医)区域医疗中心,市级公立中医医院全部达到三级中医医院建设标准,县级以上综合医院、专科医院实现中医药科室标准化设置,妇幼保健机构设置中医妇科、儿科。根据《规划》,河南省还将培养中医药学科领军人才20名、拔尖人才100名、青苗人才1000名,并建设一批基层名老中医药专家、中医学术流派传承工作室。
2.湖北省中西医结合医院开设动物致伤门诊。9月26日,湖北省中西医结合医院开设动物致伤门诊,为武汉三甲医院首家,将为市民提供动物致伤后的伤口处置、重症抢救、疫苗接种等一站式诊疗。该院动物致伤专科门诊以急诊外科为依托,设有专门就诊区、伤口处置室(配备专用伤口冲洗机)、免疫接种室、留观区、住院病房、急诊清创室、急诊ICU,并24小时开诊。
3.第三批高值医用耗材集采平均降价84%。9月27日,国家组织骨科脊柱类耗材集中带量采购开标大会召开,通过线上开标的方式产生拟中选结果。此次集采根据颈椎、胸腰椎手术的需要,覆盖颈椎固定融合术、胸腰椎固定融合术、椎体成形术、内窥镜下髓核摘除术、人工椎间盘置换术5种骨科脊柱类耗材,形成14个产品系统类别。首年意向采购量共109万套,占全国医疗机构总需求量的90%,涉及市场规模约310亿元。本次集采平均降价84%,按约定采购量计算,预计每年可节约费用260亿元。
评审动态
1. CDE新药受理情况(09月28)

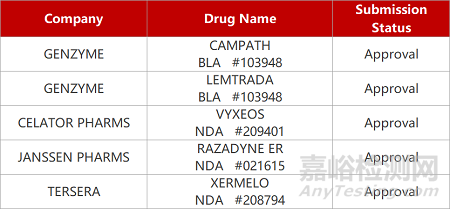

来源:药研发


