您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-27 20:44
虽然药物设计的发展一日千里,创新药概念的产生与实践催生了新药的不断涌现,但制药行业仍然存在很多滞后的领域亟待完善,药物手性对于药效和毒性的影响便是其一,至今并没有取得完全通透的了解。
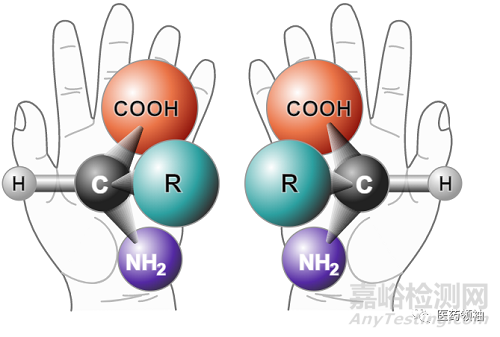
本文有关药物手性影响的讨论涉及两种构型异构体(Configurational Isomer): 非对映体异构体(diastereomer)和对映异构体(enantiomer)。其中非对映异构体又分为顺反异构(Cis-Trans isomer)和包含手性中心的非对映异构。值得注意的是,对于异构体的划分有不同的标准,比如有的模式将顺反异构从非对映异构中单独划分出来。简单地说,非对映异构体指的是那些不呈镜像对称的空间异构体(空间异构 Stereoisomer/Spatial isomer相对于结构异构 Constitutional isomer/structure isomer,指的那些原子-原子连接和键长相同,但原子三维空间排列方式不同的异构体),而对映异构是呈镜像对称的空间异构体。
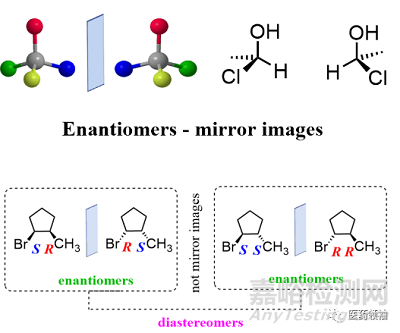
手性在药物领域的影响可能比我们现在想象的更为重要。目前上市药物中,56%的药物含有手性中心,其中88%的手性药物是以外消旋物(racemate)的形式存在的。所谓外消旋物,指的是两种对映异构体 (enantiomers)按照1:1的比例组成的混合物,表面上没有旋光活性(相互抵消)。之所以出现这种外消旋药物占主体现象,根本的原因是在药物分子的合成过程发生各种机理的消旋反应,导致手性中心采取两种不同的构型(R/S构型),如果比例为1:1,则可以导致外消旋物混合物的产生。由于拆分外消旋物可能会给药物生产增加很大的成本,而且大多数外消旋药物,其中的一种enantiomer是具有药效的,而另一种没有药效但也没有毒性(这样的最初认识是否正确,正是这篇文章讨论的内容)。因此制造商在药物生产过程中,并没有执着地将没有活性但也没有毒性的enantiomer拆分出来。
01 但外消旋药物果真是安全有效的吗?
药物手性对药性和毒性的影响
错误的对映异构体产生毒性、致畸性、致癌性的例子并不罕见。为什么空间异构体,在不影响原子-原子连接模式的情况下,仅仅改变了原子的空间布局,就会产生截然不同的药性与毒性?
药物作用的靶点蛋白,它们本身也都是手性分子,由具有手性中心的氨基酸残基组成,因此蛋白受体对于药物分子的识别自然会涉及到原子的空间布局。三维空间中,当药物分子的原子与对应的蛋白受体的原子被带至空间临近的区域,它们之间将会通过相应的非共价结合(如果药物为共价药物,则引发反应并形成新共价键)作用在一起,通过正确的装配方式完成药物与受体蛋白的结合,从而实现了药物的活性作用。但如果药物的手性发生变化,原子的三维空间布局受到了改变,有可能影响到它们与受体蛋白对应部分的结合,从而使药物分子无法与受体蛋白形成有效结合(受体蛋白的空间结构不会发生变化),导致药性消失。这解释了为什么外消旋物中,通常只有一种对映异构体具有药物活性的原因。
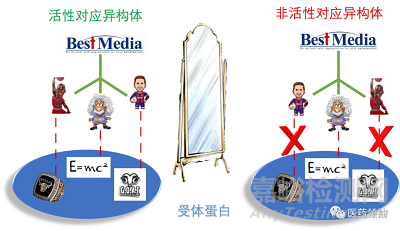
除了不具备药效之外,某些药物的错误对映异构体甚至还具有毒性,沙利度胺(Thalidomide)就是一个惨痛的教训。沙利度胺是联邦德国药厂格兰泰(Grünenthal GmbH)1957年10月投入欧洲市场的,随后在日本上市。
沙利度胺对中枢神经系统作用,具有一定的镇静催眠作用,能够显著抑制孕妇恶心和晨吐等妊娠反应,该药因此也被形象地称为“反应停”。但沙利度胺并没有被FDA批准在美国上市,他们认为沙利度胺在动物模型与人体实验结果存在巨大差异,因而判定从动物实验得到的毒理学数据并不可靠,因而不允许在美国上市。
沙利度胺上市后,欧洲孕妇的流产率和海豹肢症(Phocomelia)畸胎率上升。研究发现,沙利度胺会影响新生儿身体的多个部位,包括四肢,视力,听力,内脏和大脑。患者的手可能直接附着在肩膀上,脚可能附着在骨盆上,手指也可能丢失或融合在一起,被称为“海豹肢症”。
后续的毒理学发现,沙利度胺外消旋物中的R-(+)沙利度胺对映异构体是有药效而安全的,而S-(-)沙利度胺对映异构体则具有明显的致畸性。沙利度胺事件估计在全世界导致了约1.2万名畸形儿。
1961年11月起,沙利度胺陆续在各国被强制撤回,该事件被称为“反应停事件”。该事件让科学界意识到药物的立体异构体在人体内有不同的生理活性,也对人们认识药物不良反应以及建立完善的药品审批和不良反应检测制度起到了重要作用。
沙利度胺的复杂性不仅仅在于对映异构体的药性和致畸性差异,更为复杂的是,它的两种对映异构体可以在体内进行快速相互转换。白蛋白,羟基、磷酸盐和氨基酸似乎介导了这种作用。因此,即便服用或注射了沙利度胺单一对映体,随后在体内发生的手性转换仍然可能导致毒性。沙利度胺的相似物lenalidomide(来那度胺)也具有类似的手性转换特质。

尽管存在着致畸性的危险,但沙利度胺这个曾经“臭名卓著”的药物目前已经被赋予了新的使命:被用于治疗多发性骨髓瘤(multiple myeloma)和其它血液癌症(blood cancers)。科学家们已经发现了沙利度胺以两个 “锌指结构” 转录因子( “zinc-finger” transcription factors)为靶点的作用机制,而这两个转录因子此前曾被视为无成药性靶点(undruggable targets)。
除了沙利度胺的致畸性之外,错误的对映异构体也可能在以下领域产生影响:临床效果,受体蛋白结合、代谢及清除、毒理、致癌性和致突变性。详细内容可以参考相关综述文献。
FDA手性药物指南
让我们看看FDA在药物手性这件事情上是什么态度。随着对映异构体的不同药效和毒性成为药物有效性和安全性领域的关注点,以及手性药物开发技术和检测技术与时俱进,FDA 于 1992 年制定了关于手性药物的初步指南。
该指南涉及了对于生产控制(清除非对映异构体杂质),产品稳定性(药物储存过程中发生的消旋化反应),手性差异导致的药代动力学评估和量化(不同的剂量反应曲线),并准确评估药代动力学在动物模型与人类之间的差异。这份指南指出,在进行手性药物药理学、毒理学和临床研究前,药物的手性组成成分必须已知,无论是单一enantiomer/diastereomer(错误enantiomer/diastereomer杂质)还是外消旋物(enantiomer 的准确比例)。
FDA认为,尽管发现一些外消旋体药物存在问题,但开发外消旋体的普遍做法很少导致公认的不良后果。虽然现在制备纯化的对映异构体在技术上是可行的,但外消旋体的开发仍然是合适的。然而,在这类产品开发中应考虑以下因素:
A 应使用适当的生产工艺和控制程序来确保产品在立体异构方面的特性、强度、质量和纯度。制造商应将这些规范和测试通知药典。
B 如果对映异构体的性能不同,不使用手性测定的药代动力学评估会产生误导。因此,药代动力学样品中单个立体异构体的量化技术应该尽早开发使用。
当前外消旋体作为新药的情况已经比较少见,部分原因是对映异构体混合物的特征和毒性研究带来的负担。单一对映异构体或非手性药物如今在新批准的药物中占主导地位。
此外,以前授予专利保护并批准的外消旋药物成为了 “手性转化”(chiral switch)的目标,将最初的外消旋药物转化为单一有效的对映异构体,或对映异构体对(在原药为非对映体混合物的情况下)。华丽转身后的药物可以享受额外的数年市场独占权(market exclusivity)。经济杠杆(例如市场份额)和优化的临床特征成为了“手性转化”策略的成功推手。
诸多原始手性混合药物,例如埃索普唑esomeprozole、左氧氟沙星levofloxacin和依他普仑escitalopram已经接受了手性转化。有趣的是,原本的外消旋兽药美托咪定medetomidine,在经过手性转化之后摇身变为(S)-右美托咪定 (S)-dexmedetomidine,成为了人类用药。

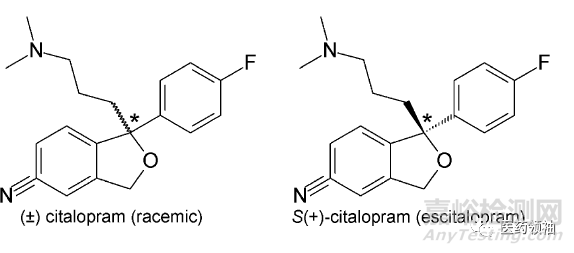
外消旋西酞普兰citalopram,和手性转化后的S-西酞普兰(新名称为依他普仑escitalopram)。
抗病毒类似物(阿巴卡韦、去羟肌苷、拉米夫定、司他夫定、阿糖腺苷、齐多夫定等)作为单一异构体进行研究与生产,使得它们的环取代模拟“天然”核苷(腺苷、胞苷、鸟苷、胸苷等)。这些单一异构体新药的开发,以及成功的手性转化案例,都来源于错误异构体的无药效,甚至在体内具有毒性、致畸性、致癌性等明显副作用(例如左旋多巴和左甲状腺素)产生的推动力。
对于手性药物,申请的CMC部分应包含必要的信息,以确保原料药和成品药的特性、质量、纯度和强度。此外,在处理手性原料药和成品药时,应考虑以下因素:
A 原料药与成品药
对映异构体和外消旋药物,应包括立体化学特异性鉴定和/或立体化学选择性测定方法。对照控制应基于物质的制造方法和稳定性特征。
B 稳定性
对映体原料药和制剂的稳定性检测,应包括一种或多种能够评估原料药和制剂的立体化学完整性的方法。然而,一旦证明不发生立体化学转化的降解,则可能不需要立体选择性测试。
C 标签
标签应包括一个唯一的既定名称和具有适当立体化学描述符的化学名称。
D 药理
单个对映体的药理活性,应针对主要药理作用和任何其他重要药理作用进行表征,包括效力、特异性、最大作用等。
E 药代动力学
为了监测体内相互转化,每种异构体的药代动力学特征应在动物中进行表征,然后与在I期临床中获得的临床药代动力学特征进行比较。
F 毒理学
通常对外消旋体进行毒性研究就足够了。如果在临床试验中发生与药理特性预测的毒性不同的毒性,则应对单个异构体重复进行毒性研究,以确定是否只有一种对映异构体负责毒性。如果可以通过开发正确的单一异构体来消除重要的毒性,则通常需要这样做。
G 杂质限度
确定前临床阶段使用的药物中所有异构体成分、杂质和污染物的浓度并设定上限,以此为基础进行接下来的临床实验。临床试验中使用的立体异构体产品中杂质的最大允许含量不应超过非临床毒性研究中评估的材料中的含量。

来源:医药领袖


