您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-25 23:24
摘要 目的:进一步完善我国突破性治疗药物程序并发挥其在药品注册体系中的作用。方法:通过梳理美国食品药品管理局(FDA)突破性治疗认定(BTD)、欧洲药品管理局(EMA)优先药物计划(PRIME)和我国国家药品监督管理局(NMPA)突破性治疗药物程序和案例,进一步探索优化我国突破性治疗药物程序在药品注册体系中的发展方向。结果与结论:FDA、EMA和NMPA的药品注册体系中均具有突破性药物治疗程序。FDA自2012年7月实行加快程序中的突破性治疗认定,通过大量案例积累了相对完善的管理经验,EMA的PRIME专人专管的政策支持以及明确的资格申请数据要求,均具有借鉴意义。我国突破性治疗药物法规于2020年落地实施后,至今也积累了一定案例。通过对FDA、EMA和NMPA关于BTD的法规对比,为我国突破性治疗药物程序实施提供建议。
一 背景介绍
根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)[1]的相关要求,结合我国药品注册审评工作实践,2020年7月1日起实施的《药品注册管理办法》[2]明确了对突破性治疗药物认定范围,随后为了规范突破性治疗药物认定工作的有序开展,国家药品监督管理局配套发布了《突破性治疗药物审评工作程序(试行)》(简称《工作程序》)[3],明确了突破性治疗药物适用范围、适用条件和工作程序。国家药品监督管理局同时也强调一种药物获得突破性治疗并不意味着可以依据不完整的临床研究资料获得批准上市。
通过梳理美国与欧洲药品监管机构在突破性治疗药物认定方面的程序,分析其在药品注册体系中的作用,结合目前国内实施的突破性治疗药物审评工作程序和要求,以期能够进一步完善我国认定突破性治疗药物的程序和要求,进一步加快临床急需创新药上市,体现“以患者为中心”的药品注册体系导向。
二美国FDA药物突破性治疗认定
2.1 相关背景
2012年7月,美国《食品药品管理局安全和创新法》(Food and Drug Administration Safety andInnovation Act,FDASIA)第902条引入了突破性治疗认定(Breakthrough Therapy Designation,BTD)[4],这是美国FDA继快速通道(Fast Track)、优先审评(Priority Review)和加速批准(AcceleratedApproval)加快审批模式后的互相补充,与快速通道不同,突破性治疗认定的药物需要有初步的临床试验数据支持,并与现有治疗手段相比具有更显著的临床疗效,是对快速通道、优先审评和加速批准的有力补充[5]。通过加强药物研发期间与FDA审评人员的沟通互动,加速产品的研发,但是审评人员并不会改变审评的标准,申请人需提供产品主要的有效性证据[6]。美国FDA的案例显示,BTD认定的药物较非BTD认定的药物,研发至上市时间平均短2.5年,在创新药物临床可及性方面体现了较为明显的优势[7]。
2.2 FDA BTD认定标准
根据FDA 2014年5月发布的《严重疾病药物和生物制剂加速审批程序技术指南》(Guidance forIndustry:Expedited Programs for Serious Conditions-Drugs and Biologics)(以下简称“指南”)[8],以及 21 U. S. Code§356要求[9],突破性治疗药物的认定需同时满足两个条件:一是适应症为严重的或危及生命的疾病;二是有初步临床证据显示在某一临床终点上明显优于现有治疗药物。同时,该临床证据尚处于初步认定阶段,与所有药物一样,FDA将审查后续提交的完整数据,以支持被指定为突破性疗法的药物的批准和确定这些药物在批准上市前是否安全有效。
2.3 FDA BTD认定程序
2.3.1 突破性治疗申请的提交
根据FDA药品评价和研究中心(Center for DrugEvaluation and Research,CDER)发布的《药品审评质量管理规范:突破性治疗认定药品和生物制品的管理》(Good Review Practice:Managementof Breakthrough Therapy-Designated Drugs andBiologics)[10],申请人可以将突破性治疗药物认定申请与IND(Investigational New Drug)一同提交,或在IND提交后提交,但是建议不晚于Ⅱ期临床试验会议结束。
如果申请人没有要求突破性治疗认定,FDA也可能提示申请人考虑提交认定申请,但需要满足下列条件:①在审评申请人提交的数据和信息后,审评机构认为该药品研发项目可能符合突破性治疗认定的标准;②如认定BTD后,药品研发项目和审评能从认定中受益。
2.3.2 FDA的反馈
FDA将在收到突破性治疗认定申请之后60日内作出反馈[8]。
①认定函(Designation Letter)
如果FDA认为药物研发项目适用突破性治疗路径对研发项目进行审评,将向申请人发出认定函。认定函包括三部分内容:a. 明确针对特定严重症状的治疗,对相应药物申请适用突破性治疗程序;b. 解释FDA将与申请人进行密切合作,为后续研发提供指南,包括FDA会提出建议,申请人若想更快获得批准,应提供怎样的证据;c. 对申请人提出警示,要求其药物研发项目持续符合突破性治疗认定的标准[8]。
②拒绝认定函(Nondesignation Letter)
如果FDA确定,药物研发项目不符合突破性治疗的认定标准,将向申请人发出拒绝认定函。拒绝认定函将明确不准予突破性治疗认定,并说明决定的理由。拒绝认定函可能包括对申请人后续研究的建议,包括新的突破性治疗认定申请需要哪些内容[8]。
2.4 获益
被认定突破性治疗药物的主要获益最早是从Ⅰ期临床开始,一是FDA审评小组对突破性治疗认定药物的研发计划进行密集指导,有助于品种高效研发;二是承诺高级管理者和有丰富经验的审评员参与,以及提供跨学科审核支持;三是可以滚动提交资料[8]。
(1)最早从Ⅰ期临床开始对突破性治疗认定药物的研发计划进行密集指导
如前所述,突破性疗法认定通常意味着与现有治疗手段相比,该药物的效果会很突出。在这种情况下,突破性疗法的开发计划可能比其他旨在治疗正在研究的疾病的药物要短得多。然而,FDA指出,压缩药物开发计划仍必须产生足够的数据,以证明该药物是安全和有效的,以符合法定的批准标准。省略药物开发计划中对此类确定所必需的部分可能会显著延迟,甚至不批准上市。
申请人可以通过多种方式设计有效的临床试验。FDA将寻求确保被认定为突破性疗法的产品的申请人收到及时的建议和互动交流,以帮助申请人尽可能有效地设计和实施药物开发计划。在这些互动过程中,FDA可能会建议或申请人可以提出替代临床试验设计或使用数据监测委员会的中期分析。这些试验设计可能导致较小的试验或更有效的试验,这些试验需要更少的时间来完成,并且可能有助于最大限度地减少接受可能不太有效的治疗的患者数量(即对照组接受可用的治疗),这种方法在罕见疾病的研究中可能作用更大。
FDA 审评小组和申请人将在整个药物开发过程中会面和互动,以解决不同开发阶段的问题和其他重要问题。此外,申请人应为药物开发的其他方面(例如制造)做好准备。
(2)承诺高级管理者和有丰富经验的审评员参与以及会提供跨学科审核支持
FDA通过让高级管理人员、经验丰富的审评人员和监管健康项目管理人员参与积极、协作、跨学科的审查来加快突破性疗法的研究和审评。在适当的情况下,FDA还会为审评小组指定一名跨学科项目负责人,以促进对药物开发计划的有效审查。跨学科项目负责人将作为审评团队成员之间的科学联络人[例如医学、临床药理学、药理学-毒理学、化学制造和控制 (Chemical Manufacturing andControl,CMC)、合规性、生物统计学],便于协调内部活动、通过监管健康项目管理人员与申请人沟通交流。
(3)滚动提交资料
如果 FDA 在对申请人提交的临床数据进行初步评估后确定突破性治疗产品可能有效,则 FDA可以考虑在申请人提交完整申请之前审查上市申请的部分内容。
2.5 BTD认定的撤销
《药品审评质量管理规范:突破性治疗认定药品和生物制品的管理》(Good Review Practice:Management of Breakthrough Therapy-DesignatedDrugs and Biologics)[10]提到考虑撤销BTD认定的几种情形:一是临床数据不再显示相比于现有治疗有显著提高;二是相同适应症的其他药物获得批准上市并且认定突破治疗药物临床获益没有很大提高;三是认定突破治疗药物不遵循研发计划。
“指南”[8]也规定了突破性治疗认定撤销的程序。程序中规定审评部门通知申请人撤销后,允许申请人递交额外的数据或者要求开会讨论,该数据经过CDER内部讨论,仍然不符合突破性认定,审评部门需要发送官方信告知撤销的理由。
由此可见,该管理规范中充分发挥了CDER在突破性治疗认定药物后的主导地位,并且非常强调申请人与官方审评机构的沟通交流,只有做到加快交流的频率和申请人信息共享才能设计更高效的临床试验,提高审评机构的审评效率,最终达到加快药品上市的目的。
2.6 FDA BTD产品情况
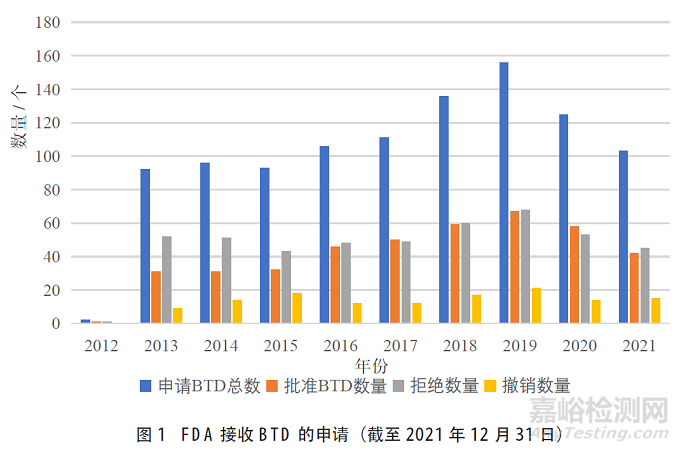
根据FDA官网数据信息[11],截至2021年12月31日,自2012年7月9日FDA CDER开始实行BTD以来共收到1041份BTD认定申请(见图1)。然而,这些申请中只有大约40% 被认定BTD。
图1中也可看出近几年来FDA药物认定BTD数量与拒绝数量基本持平,每年均有十几个BTD认定被撤销,表明FDA在不断加强提升申请评估能力的同时还一直保持着对已认定药品的密切关注,对于申报后期不符合认定条件的药品,应当立即撤销其认定资格。
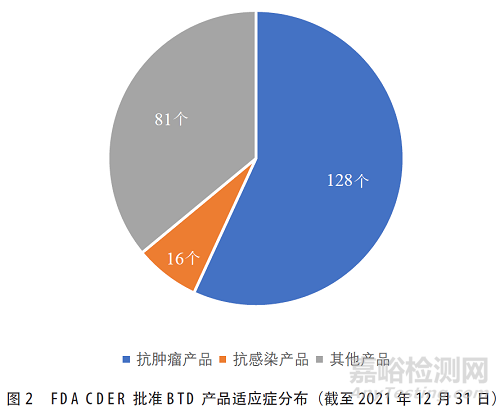
根据FDA官网信息[11],自FDA 2012年实行BTD以来,截至2021年12月31日,CDER共批准225个BTD产品上市,批准比例约为BTD认定数量的
54%,其中抗肿瘤产品128个(56.9%)、抗感染产品16个(7.11%),以及其他适应症产品81个(36.0%)(见图2)。
三欧洲PRIME计划
3.1 相关背景
优先药物计划(Priority Medicines,PRIME)是2016年3月欧洲药品管理局(European MedicinesAgency,EMA)推出的一项药品审评制度[12],旨在通过优化和支持药物开发,促进医疗需求尚未满足的疾病,该审评制度只适用于计划通过集中程序在欧盟申请的药品上市许可申请[13]。
PRIME与FDA的BTD程序有同样的目标,均是为了提高患者对创新药的可及性,但两者建立在不同的国家基本法律基础上,因此相互比较和协调较为困难[14]。2016年,基于保密性协议,EMA和FDA开始周期性交换PRIME和BTD程序的入选标准,并且强烈建议申请人通知官方是否递交了PRIME或者BTD申请以及结果。如果想成功进行全球研发和临床研究,EMA建议申请人申请并行科学咨询(Parallel Scientific Advice,PSA),该项目提供了一种机制,可以在新医药产品(药物、生物制品、疫苗、先进疗法)开发阶段与申请人同时就关键问题进行科学讨论[13]。
3.2 PRIME认定标准
P R I M E 认定标准与E M A 的药品加速审评(Accelerated Assessment)标准相同,针对具有重大公共卫生利益的医药产品,尤其是从治疗创新的角度。PRIME主要包括两点:一是存在未满足临床需求,例如没有令人满意的诊断、预防或治疗方法,或者该药品具有重大治疗优势;二是说明具有提高公共健康存在潜在的未被满足的临床需求,例如引进新的治疗或者改善了现有治疗。
3.3 PRIME认定程序
3.3.1 PRIME资格申请的提交
EMA建议申请人可以在探索性临床试验研究阶段根据患者的初步临床证据的可用性,提交PRIME的申请,以证明该药物具有良好的活性及其在很大程度上解决未满足医疗需求的潜力,根据EMA发布的“PRIME:Analysis of the first 5 years’experience”[15],此类申请占96%。特殊情况下,一些小型企业的申请人满足以下条件时可以在研发早期递交申请,一是相关模型的非临床数据提供了早期疗效;二是首次人体临床研究表明适当暴露可以达到预期的药物治疗效果[13]和耐受性。
3.3.2 PRIME资格申请的资料要求
根据2 0 1 8 年7 月实施的“ E n h a n c e d E a r l yDialogue to Facilitate Accelerated Assessment ofPriority Medicines”[13],规定了PRIME申请在不同的研发阶段的技术资料要求。申请人需要讨论从公共卫生角度证明重大利益的证据强度,例如提供产品有潜力满足未满足的医疗需求的证据。潜在未满足医疗需求的假设应该是合理的,并且在可能的情况下,基于对产品的药理学以及药理作用与临床结果的关系的合理理解。除了临床疗效数据外,申请中还应包括在非临床和临床环境中获得的所有可用安全性数据的摘要。如果产品正在开发其他适应症,则应包括非常简短的说明,应与主要请求PRIME直接相关的数据明确分开。
3.3.3 PRIME申请的审查
EMA收到申请后,将会确认申请是否符合P R IME计划的范围,以及申请的格式和内容是否足以支持对申请进行审查。由科学建议工作小组(Scientific Advice Working Party,SAWP)对 PRIME资格申请进行审查,审查报告或建议会被转送到SAWP和人用药品委员会(Committee forMedicinal Products for Human Use,CHMP),为其最后决策提供参考。对于先进治疗产品(AdvancedTherapy Medicinal Products,ATMP),先进治疗委员会(Committee for Advanced Therapies,CAT)也将审查相关申请,并向 CHMP提供建议。因此,如果 EMA认为申请可接受,将会任命 1名 SAWP审查员和1名 EMA科学干事;对于ATMP,还会任命1位CAT审查员。同时,申请人会被告知申请开始进入审查程序。CHMP将在申请审查开始起的 40日内发布最终结果。申请提交截止日期和程序时间表将以标准日历的方式发布在 EMA网站上[14]。
3.3.4 PRIME资格申请的结果
CHMP作出决策之后,申请人将会收到一封解释评估结果的信,信中会说明接受或拒绝进入PRIME计划的理由。如果需要进一步了解接受或拒绝的理由,申请人可联系EMA,但是审查报告不会与申请人共享。建议授予PRIME资格的药物概况将刊载于CHMP月报。EMA也将发布已经被授予PRIME资格的药物信息,包括活性物质的名称或国际非专利药品名(International Nonpropietary Namesfor Pharmaceutical Substances,INN)、药物的类型(化学药、生物制品或先进治疗产品)、适应症、支持PRIME资格申请的数据类型和申请人的类型[来自中小企业(Small and Medium Enterprises,SMEs)、学术机构的申请人或其他]。当 CHMP推荐药物进入PRIME计划时,也会同时确认其进入集中审评程序的资格。对于被拒绝PRIME资格的药物,将发布类似的信息,但不包括活性物质的名称或INN,以避免在药物研发的早期阶段对其优势产生负面影响。在后续的集中上市许可中,P R IME资格和相关信息将在欧洲公共评估报告(European Public Assessment Report)中提及。目前,EMA尚未建立被拒绝PRIME资格后的上诉机制,但是,申请人如果认为有新的证据或数据支持其药物的PRIME资格,可再次提交新的申请。EMA将任命不同的SAWP审查员和 EMA科学干事来审查这一新的申请。EMA会成立 1个监督小组,由CHMP成员和来自CAT、孤儿药委员会 ( Committeefor Orphan Medicinal Products,COMP)、儿科药委员会(Paediatric Committee,PDCO)与药物警戒风险评估委员会(Pharmacovigilance Risk AssessmentCommittee,PRAC)的代表组成,以确保PRIME计划的一致性,并监督实施结果和指南更新,以反映所取得的成绩与经验[13]。
3.4 PRIME程序的终止
当EMA发现产品不能满足未满足的临床需求或者出现新的数据不再满足PRIME的标准,EMA会通知申请人提供符合PRIME的说明供官方评估,而且申请人也可以放弃PRIME的研发计划。
3.5 获益
获得P R I M E 认定的药物的主要获益:一是尽早从EM A 的C H M P 或CAT任命一名审评员(Rapporteur),在药品上市许可申请(MAA)之前提供持续支持和帮助;二是与CHMP/CAT审评员、来自相关EMA科学委员会和工作组的多学科专家组以及EMA工作人员举行首次启动会议,以提供总体研发计划的初步指导、讨论未来建议的关键研发步骤和注册策略的开放性讨论;三是设定EMA专门的联络人,负责协调整个研发计划提供的支持,就总体研发计划、重大发展里程碑和关键问题提供科学建议,并可能涉及其他利益相关者[如卫生技术评估(Health Technology Assessment,HTA)机构和患者];四是在申请上市许可时确认加速评估的可能性。
申请人递交PRIME申请后,如被认定PRIME,EMA会指定一个SAWP成员和一个EMA科学人员并且会通知申请人开始启动程序。第30天会在SAWP全体会议上讨论和建议。在第40天,CHMP采纳最终的建议。药物确认符合PRIME之后,相关工作程序如下:①同时确认产品符合集中程序申报标准;②一个月时间内指定审评员,如果是新技术治疗药物,指定CAT审评员(CAT Rapporteur)和CHMP协调员(CHMP Co-ordinator);③EMA专门联络人;④首次会议,会议目的是促进申请人与多学科专家评估团队和EMA之间的初步互动。虽然参与者不会围绕已确定的主题进行详细的科学和技术讨论,但在启动会议期间,目的是就如何最好地解决任何已确定的问题或确定潜在的其他问题,就下一步行动达成一致。在会议上,将介绍该产品的开发计划和监管策略。将通过相关监管程序收到互动建议(例如提交科学建议请求、儿科调查计划的时间点)。此外,本次会议还可以讨论监管方面的问题;⑤科学咨询,将在科学建议程序的背景下提供科学指导,在科学建议程序中,将能够收到关于研发计划以及上市许可申请的重大问题或特定关键问题的意见;⑥定期更新。首次会议后,如果申请人确定了一个值得与监管机构进一步讨论的主题,应联系专职联络员,后者将就解决该问题的适当方式提供建议;⑦ 加速评估程序。评估获得PRIME的产品是否会受益于加速评估程序,会在提交上市许可申请前2~3个月得到正式确认[14]。
3.6 EMA PRIME申请情况
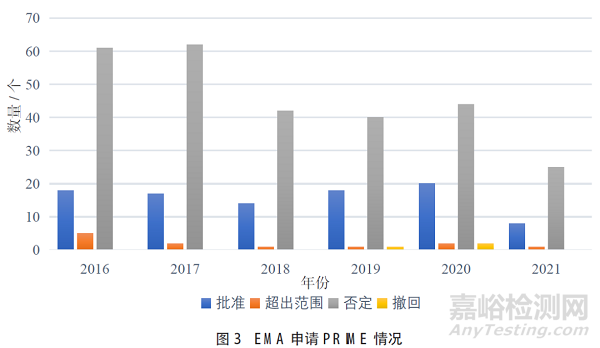
根据EMA发布的“PRIME:Analysis of the first5 years’experience”[15],截至2021年6月30日申请PRIME情况如图3所示,此期间内获得EMA认定PRIME药物共有95个,比例少于PRIME申请总数的30%。其中24个认定PRIME的产品递交上市申请,21个产品EMA完成了审评程序,其中18个产品(85.7%)获得了上市批准,1个产品(4.8%)上市失败,2个产品(9.5%)撤回上市申请。
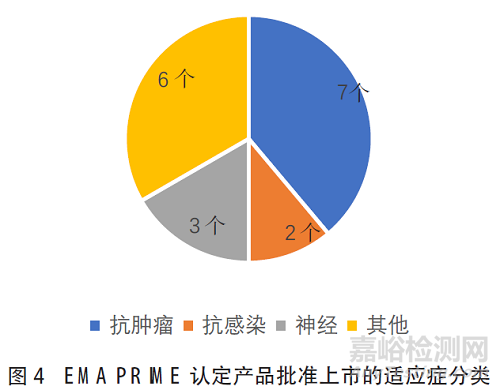
在获得上市许可的18个产品中,抗肿瘤产品7个(38.9%)、抗感染产品2个(11.1%)、神经方面适应症3个(16.7%)、其他适应症产品6个(33.3%),如图4所示。
四我国现行的突破性治疗的实施现状
4.1 相关背景
2020年7月1日新的《药品注册管理办法》开始实施,其中包括了突破性治疗药物程序、附条件批准程序、优先审评审批程序和特别审批程序四种药品加快上市注册程序,2020年7月8日国家药品监督管理局发布了《突破性治疗药物审评工作程序》(以下简称《工作程序》)等三个药品加快上市程序的配套工作程序文件[3]。
4.2 突破性治疗药物程序适用范围
根据《药品注册管理办法》突破性治疗药物标准为药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
4.3 突破性治疗药物纳入程序
4.3.1 突破性治疗申请
《工作程序》中明确指出临床试验期间申请人在国家药品监督管理局药品审评中心(以下简称“药审中心”)网站(www.cde.org.cn)上的申请人之窗提出申请(按适应症分别提交),申请人提出申请纳入突破性治疗药物程序的时间节点通常不晚于(中国)Ⅲ期临床试验开展前。
4.3.2 突破性治疗申请的审核
药审中心根据该品种拟定的适应症(或者功能主治),对申请人提交的突破性治疗药物程序申请进行审核,必要时,可以组织召开专家咨询委员会论证。
药审中心应当在接到申请后45日内将审核结果反馈申请人。因品种特性,确需延长审核时限的,延长的时限不超过原审核时限的二分之一,经药审中心负责人批准后,由项目管理人员告知申请人延期时限及原因。
4.3.3 公示纳入
药审中心对拟纳入突破性治疗药物程序的品种具体信息和理由予以公示,包括药物名称、申请人、拟定适应症(或者功能主治)、申请日期、拟纳入理由等。公示5日内无异议的即纳入突破性治疗药物程序;对公示品种提出异议的,应当在5日内向药审中心提交书面意见并说明理由;药审中心在15日内另行组织论证后作出决定并通知各相关方。在纳入突破性治疗药物程序前,申请人可以提出撤回申请,并书面说明理由。
4.4 获益
药审中心对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。申请人做好准备工作后提出与药审中心进行沟通交流的申请。药物临床试验期间的沟通交流包括首次沟通交流、因重大安全性问题/重大技术问题而召开的会议、药物临床试验关键阶段会议以及一般性技术问题咨询等,药审中心予以优先处理。对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。
4.5 突破性治疗终止程序
对纳入突破性治疗药物程序的药物临床试验,申请人发现不再符合纳入条件时,应当及时向药审中心提出终止程序。药审中心发现不再符合纳入条件的,应当告知申请人,申请人可以在10日内向药审中心提交书面说明,由药审中心组织论证,在30日内作出决定后通知申请人。对于申请人未在10日内向药审中心提交书面说明的,或者经论证作出决定不符合纳入条件的,药审中心应当及时终止该品种的突破性治疗药物程序。
4.6 突破性治疗药物在我国申报情况
截至2021年12月31日,药审中心共收到410个突破性治疗药物程序申请,共有62个申请纳入突破性治疗药物程序,审核通过率约为15%,远低于美国FDA 40%的BTD认定比例和欧洲PRIME约30%的认定比例。
突破性治疗申请审核不通过的原因主要包括两类,一是法规原因,例如境外已经获批的适应症;已完成新药上市申请前(pre-NDA)沟通交流并同意递交NDA;同一个申请包含多个适应症;二是数据原因,主要包括样本量过少、数据不稳健;当前数据不能体现疗效突出;人群定义不清晰以及无临床研究数据。在《抗肿瘤新药突破性治疗药物认定的标准及考虑》[16]中,提到另外两条不通过的原因:一是未提供可靠的历史数据,尤其对于非随机对照研究产生的数据;二是潜在安全性风险影响了临床优势的评价。
在410个突破性治疗药物程序申请中,抗肿瘤药物的申请为60.00%(246个),与美国BTD中抗肿瘤产品比例接近(56.90%),其次是神经系统疾病药物和皮肤五官药物各占6.10%,循环系统疾病药物5.85%,其他占21.95%。其中37个已获得FDA的BTD认定,3个已获得EMA的PRIME资格认定(同时也获得了FDA的BTD认定)。
五 美欧相关制度对我国突破性治疗药物程序的启示
我国突破性治疗药物程序与美国BTD和欧盟PRIME的法规对比见表1。

我国突破性治疗药物的实施目前尚处于初级阶段,借鉴FDA的BTD和EMA的PRIME的相对成熟的管理,对我国突破性治疗药物程序的实施建议如下。
5.1 明确突破性治疗药物申请递交数据要求
《工作程序》中要求申请人在申请表中列明可根据该药物符合的突破性治疗药物程序的适用情形,简要阐述尚无有效防治手段,或者与现有治疗手段相比有明显临床优势的临床证据,同时说明现有治疗手段、药物临床试验设计、对照药的选择、研究人群、临床终点、研究结果和统计分析结果等。EMA则细化了PRIME不同的研发阶段包括早期临床和临床研发阶段的技术要求,为申请人提供详细指导,一定程度可以避免由于申请数据不足被否决的可能性,避免审评资源的浪费。
更加明确突破治疗药物申请递交技术资料要求可以指导申请人提出申请,提高突破性治疗药物申请的通过率,并且可以提升申请人与监管机构的沟通交流,有利于加快药物批准上市。建议我国的突破性治疗药物申请的技术资料在实践中不断积累,逐步明确、完善突破性治疗药物所需的技术资料要求。在明确突破性治疗药物申请递交数据要求的前提下,发挥申请人的主体责任,提高递交资料的成熟度和完整性。
5.2 制订并公开突破性治疗药物审评管理规范
FDA BTD审评管理规范,对于突破性治疗认定的标准、程序、审评团队成员职责等都有详细的规定,而且信息公开透明,起到了为申请人和审评人员提供明确的指导和互相监督的作用。
建议我国药品监管机构参考FDA BTD制定并公开突破性治疗药物的详细认定标准及程序,为申请人和审评人员提供明确的指导。同时充分发挥项目管理员职能,促进审评团队与申请人之间沟通交流。
5.3 充分发挥审评人员在突破性治疗药物认定和管理中的主导作用
FDA在审核申请人递交的pre-IND申报资料时,要求主动发现产品符合BTD条件并主动告知申请人。并在产品认定BTD之后,除了CDER和申请人正式会议之外的沟通,项目管理人员在30日内通过电话会议、信息询问和邮箱作为工具进行主要问题讨论,迅速交换信息和解决问题。FDA强调BTD程序会配备有经验的审评人员,这在未来审评机构和申请人的沟通当中起着至关重要的作用。因为有资历的审评人员会有足够的审评经验,会为未来的临床计划和临床设计提供更全面的指导意见,提高沟通的效率。充分、高效地利用配置给突破性治疗药物审评资源,充分发挥审评人员在突破性治疗药物认定和管理中的主导作用。
六 我国药物突破性治疗的展望
突破性治疗药物的认定是鼓励具有临床价值的创新药加快审评审批的又一重大举措,《药品管理法》《药品注册管理办法》和《突破性治疗药物审评工作程序》(试行)为研究和创制具有明显临床优势的药物提供了制度保障和技术支持。药物纳入突破治疗性治疗程序后,申请人可以在临床试验阶段通过与CDE频繁的沟通交流优化临床试验设计,在申报上市时可以申请优先审评审批程序,进而缩短上市时间。
我国突破性治疗药物的制度刚刚起步,实施效果初现,但尚未形成成熟的认定体系,突破性治疗药物审评工作程序虽然明确了该程序的适应范围和适用条件、工作程序和工作要求,但是在流程设计、技术要求及审评资源配置上还需要与业界一同深入研究完善。
实施突破性治疗药物认定的最终目的是为了通过早期临床研究数据发现具有突出临床优势的药物,缩短其临床研发周期,使得罹患严重危及生命或严重影响生存质量疾病的患者早日获得更好的治疗。为此,可借鉴FDA、EMA经验,不断完善认定流程,保证动态获益风险评估贯穿其中,充分发挥审评人员在突破性治疗药物认定和管理中的主导作用,在药物临床试验研发阶段深入指导申请人开展相关研究,进而加快药品上市,最终造福广大患者。

来源:中国药事


