您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-14 22:21
摘要:【目的】建立 44 种常用儿童药品的微生物限度检查方法。【方法】按《中国药典》2015 及 2020 年版四部通则,分别采用常规法、中和法或稀释法等对 44 种常用儿童药品的微生物限度检查方法进行适用性试验。【结果】需氧菌总数计数:化学口服液体制剂可采用 1:10 平皿法检查;中药制剂需对样品进行中和处理,其中,中药口服液体制剂可采用 1:10 平皿法检查,中药颗粒剂可采用 1:100 平皿法检查。所有样品的霉菌和酵母菌总数计数均可采用 1:10 平皿法检查。所建立的检查方法对 5 种试验菌株的回收比值均在 0.5~2.0之间,试验组控制菌均可检出,阴性对照组均未检出,符合《中国药典》要求。【结论】建立的方法准确可靠,可用于 44 种常用儿童药品的微生物限度检查及质量控制。
儿童药品[1]因用药人群的特殊性,其安全性成为社会关注的重点问题。药品微生物检验作为保障药品安全的重要措施[2]之一,其结果经常会受到药物剂型、处方和检验技术等多种因素的影响。因此,为了获得准确可靠的检验结果,根据《中国药典(2020 年版)》[3]的规定,应根据药品的理化特性等进行微生物方法适用性试验[4-6],并建立适宜的微生物检验方法。
国家药品监督管理局批准的儿童药品以颗粒剂、片剂和液体口服制剂为主[7-8]。其中,颗粒剂多为中药制剂,大多具有清热解毒的作用;口服液体制剂通常含有防腐剂,对微生物的生长存在一定的影响,因而无法采用直接接种的方法进行微生物检验。因此,如何快速、准确地建立适宜的微生物检验方法也成为了儿童药品生产单位和检验机构面临的一大难题。
目前尚未有针对儿童药品的微生物限度检查方法的系统研究报道。鉴于此,本研究选择颗粒剂和口服液体制剂为主要代表,建立了 44 种常用儿童药品的微生物限度检查方法,并对结果进行分析讨论,为儿童药品的生产单位和检验机构建立有效可行的微生物限度质量分析方法提供参考,以达到减少方法建立工作量、提高检测效率以及为儿童药品的优先审评[9]提供数据支持的目的。
1、材料与方法
1.1 材料
1.1.1 主要仪器 BSA2202S 型电子天平(德国 Sartorius 公司),MSC1.8 型生物安全柜(美国 Thermo 公司),恒温培养箱(日本 Sanyo 公司)等。
1.1.2 试验菌株 金黄色葡萄球菌(Staphylococcus aureus,SA)[CMCC(B)26003],铜绿假单胞菌(Pseudomonas aeruginosa,PA)[CMCC(B)10104],枯草芽孢杆菌(Bacillus subtilis,BS)[CMCC(B)63501],大肠埃希菌(Escherichia coli,EC)[CMCC(B)44102],乙型副伤寒沙门菌(Salmonella paratyphi B,SP)[CMCC(B)50094],白色念珠菌(Candida albican,CA)[CMCC(F)98001],黑曲霉(Aspergillus niger,AN)[CMCC(F)98003]。均购于中国医学菌种保藏中心(CMCC),使用前均进行了鉴定确认。
1.1.3 培养基及稀释剂 胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)和紫红胆盐葡萄糖琼脂培养基(VRBG)(德国默克 Merck 公司);肠道菌增菌液体培养基(EE)(青岛海博生物技术有限公司);RV 沙门菌增菌液体培养基(RVS)(北京奥博星生物技术有限责任公司);沙氏葡萄糖琼脂培养基(SDA)、木糖赖氨酸脱氧胆酸盐琼脂培养基(XLD)、麦康凯琼脂培养基(MACA)、麦康凯液体培养基(MAC)、溴化十六烷基三甲铵琼脂培养基(CA)、甘露醇氯化钠琼脂培养基(MSA)、pH7.0 氯化钠-蛋白胨缓冲液(pH7.0)等(广东环凯微生物科技有限公司)。
1.1.4 供试品 氨溴特罗口服溶液(1)、布洛芬混悬液(2)、多潘立酮混悬液(3)、核酪口服溶液(4)、美敏伪麻溶液(5)、盐酸氨溴索口服溶液(6)、 盐酸丙卡特罗口服溶液(7)、右旋糖酐铁口服溶液(8)、对乙酰氨基酚口服溶液(9)、复方氨酚美沙糖浆(10)、开喉剑喷雾剂(儿童型)(11)、维生素 D滴剂(胶囊型)(12)、维生素 AD 滴剂(胶囊型)(13)、肺力咳合剂(14)、小儿肺热咳喘口服液(15)、健儿清解液(16)、小儿消积止咳口服液(17)、金振口服液(18)、小儿柴桂退热口服液(19)、小儿清热利肺口服液(20)、双黄连口服液(21)、百咳静糖浆(22)、小儿感冒宁合剂(23)、小儿豉翘清热颗粒(24)、小儿退热颗粒(25)、醒脾养儿颗粒(26)、小儿肠胃康颗粒(27)、小儿清肺化痰颗粒(28)、小儿清热止咳颗粒(29)、猴耳环消炎颗粒(30)、双黄连颗粒(31)、小儿柴桂退热颗粒(32)、小儿清咽颗粒(33)、小儿咽扁颗粒(34)、健脾生血颗粒(35)、小儿肺咳颗粒(36)、小儿肺热咳喘颗粒(37)、小儿金翘颗粒(38)、小儿宣肺止咳颗粒(39)、儿童回春颗粒(40)、清宣止咳颗粒(41)、多动宁胶囊(42)、肾衰宁胶囊(43)、小儿布洛芬栓(44),共 44 种样品,由上海市各辖区市场监督管理局抽样送检。
1.2 方法
1.2.1 菌液的制备 参照《中国药典(2020 年版)》四部通则 1105 及 1106。
1.2.2 供试液的制备 制备方法 A:取供试品 10 g 或 10 mL,加 pH7.0 至 100 mL,均质混匀,作为 1:10 的供试液。
制备方法 B:取供试品 10 g 或 10 mL,加 pH7.0 无菌氯化钠-蛋白胨缓冲液(含 3%聚山梨酯-80 及 0.3%卵磷脂)(pH7.0+)至 100 mL,均质混匀,作为 1:10 的供试液。
制备方法 C:取供试品 10 g,加胰酪大豆胨液体培养基(含 3%聚山梨酯-80 及 0.3%卵磷脂)(TSB+)至 100 mL,均质混匀,作为 1:10 的供试液。
制备方法 D:取小儿布洛芬栓 10 g,加入 20 mL 不超过 40 ℃的无菌十四烷酸异丙酯,均质混匀,再加70 mL 不超过 40 ℃的 pH7.0+,均质混匀,作为 1:10 的供试液。
必要时,用同一稀释液将供试液进一步稀释制成 1:100 的供试液。
1.2.3 需氧菌总数、霉菌和酵母菌总数计数方法适用性试验 取 1:10 或 1:100 的供试液各 10 mL,分别加入试验菌液 0.1 mL,混匀,使每 1 mL 供试液中含菌量<100 cfu。取其 1 mL,加入 15~20 mL 的温度不超过45 ℃熔化的琼脂培养基(含或不含 3%聚山梨酯 80 及 0.3%卵磷脂),混匀,凝固,培养。
1.2.4 控制菌检查 ① 大肠埃希菌:取 1:10 的供试液 10 mL 接种至 100 mL 的 TSB 中,33 ℃培养 18 h,
取上述培养物 1 mL 接种至 100 mL 的 MAC 中,42 ℃培养 24 h 后划线接种于 MACA,33 ℃培养 18 h。② 耐
胆盐革兰阴性菌:分别取按照制备方法 C 的供试液 10 mL 置 23 ℃培养 2 h。依次取相当于 0.1、0.01 和 0.001g 供试品的预培养物接种至 10 mL 的 EE 中,33 ℃培养 24 h 后,划线接种于 VRBG,33 ℃培养 18 h。③ 沙门菌:取供试品 10 g 或 10 mL 接种至 200 mL 的 TSB(含或不含 1%聚山梨酯 80)中,均质混匀,33 ℃培养 18 h。取上述培养物 0.1 mL 接种至 10 mL 的 RVS 中,33 ℃培养 18 h 后划线接种于 XLD,33 ℃培养 18 h。④ 金黄色葡萄球菌:取 l:10 供试液 10 mL 接种至 100 mL 的 TSB+中,33 ℃培养 18 h,取上述培养物划线接种于 MSA,33 ℃培养 18 h。⑤铜绿假单胞菌:取 l:10 供试液 10 mL 接种至 100 mL 的 TSB+中,33 ℃培养 18 h 后划线接种于 CA,33 ℃培养 18 h。
分别参照上述方法,同时加入<100 cfu 的阳性菌同步培养,形成阳性对照。
1.2.5 计算及结果判断 需氧菌总数和霉菌和酵母菌总数回收比值按如下公式计算:
各菌株回收比值=(试验组的平均菌落数−供试品对照组的平均菌落数)/菌液对照组的平均菌落数。
各菌株回收比值应在0.5~2.0范围内,控制菌检查适用性试验的阳性对照均能正常生长。
2、结果
2.1 样品来源分布
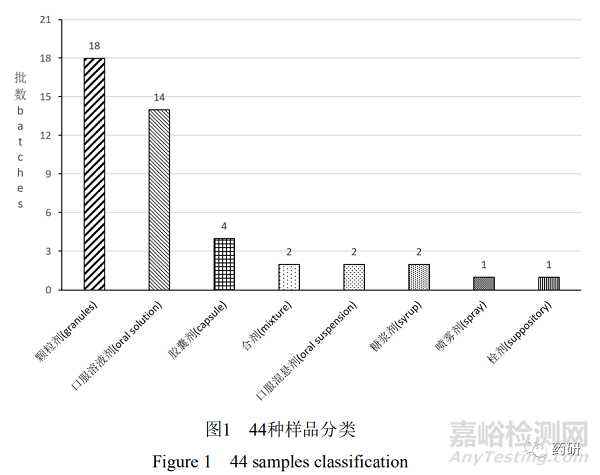
44种样品来自于全国不同生产企业,其中化学药品13件,占29.95%;中成药31件,占70.45%;液体23件,占52.27%;固体21件,占47.73%。除1件为直肠给药制剂,1件为口腔黏膜给药制剂外,其余均为口服给药制剂。具体分类见图1。
图片
2.2 需氧菌总数、霉菌和酵母菌总数计数方法适用性试验
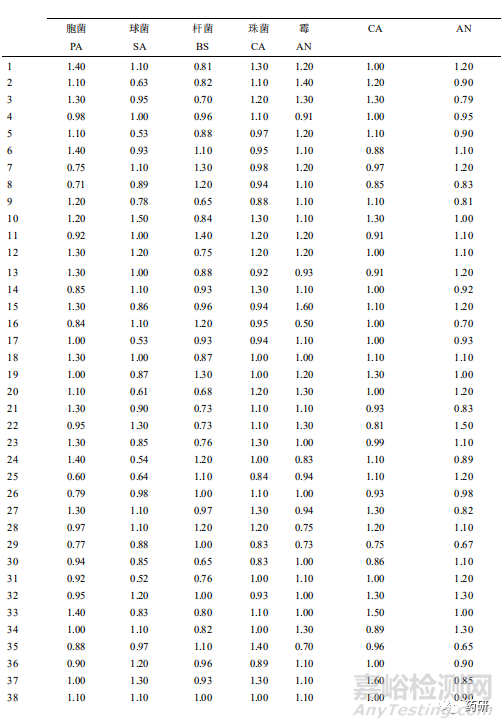
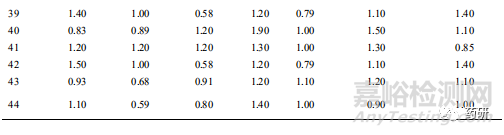
由于中药制剂存在一定的抑菌性,需首先对样品供试液进行中和处理。8类样品需氧菌总数、霉菌和酵母菌总数计数方法详见表1,各样品的试验回收比值见表2。
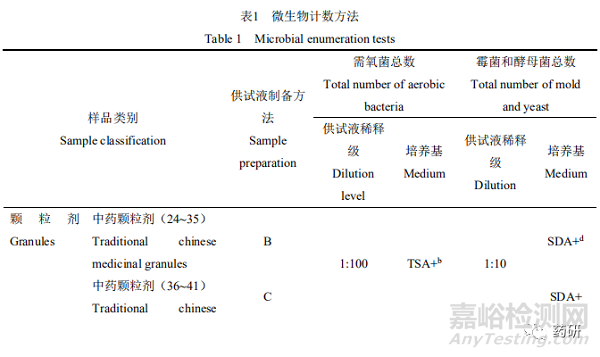
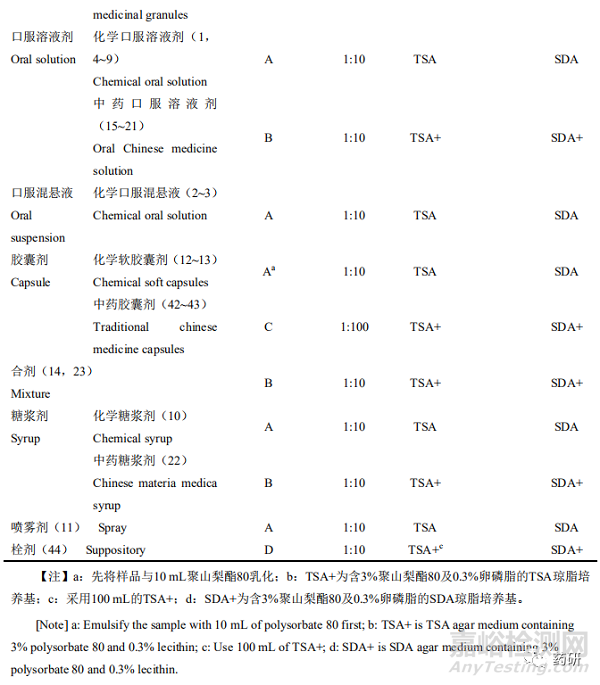

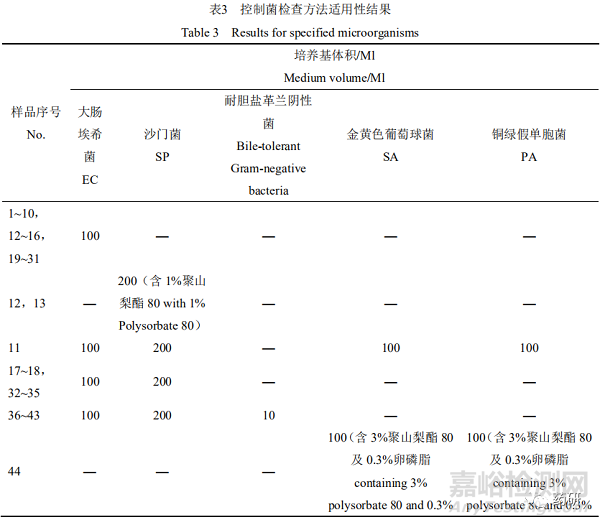
2.3 控制菌检查方法适用性试验结果
大肠埃希菌均可接种至100 mL的TSB中检查;一般样品的沙门菌均可接种至200 mL的TSB中检查,滴剂为油性液体,沙门菌在200 mL的TSB中加入1%的聚山梨酯80检查;耐胆盐革兰氏阴性菌均可接种至10 mL的EE中检查;开喉剑喷雾剂(儿童型)可直接接种至100 mL的TSB中检查金黄色葡萄球菌和铜绿假单胞菌,但小儿布洛芬栓则需接种至100 mL的TSB+中。见表3。
3、 讨论
本文按照《中国药典(2020 年版)》四部通则的要求,建立了 44 种常用儿童制剂的微生物限度检查方法。中药制剂多含有清热解毒的成分,有一定的抑菌性,对微生物计数方法的影响较大。以颗粒剂为例,其中小儿豉翘清热颗粒的处方中含有薄荷、青蒿、黄芩和大黄等成分。有研究显示,薄荷提取物,尤其是薄荷精油、青蒿对枯草芽孢杆菌、金黄色葡萄球菌有较强的抑制效果[10-12]。而黄芩和大黄也被多次报道对常见的致病菌具有很强的抑制作用[13-16]。本研究也证实小儿豉翘清热颗粒在检查需氧菌总数时需联合采用中和法和稀释法。单采用 1:10 的供试液进行回收试验时,PA 的回收率为 0.22,SA 和 BS 的回收率均为 0;改用稀释法,即采用 1:100 的供试液进行回收试验时,3 种微生物的回收率均>0.5。小儿退热颗粒和醒脾养儿颗粒单纯采用 1:10 的供试液结合中和法进行需氧菌总数检查时,细菌的回收率均<0.5,经进一步的稀释至 1:100 的供试液后均>0.5。值得注意的是,即使是同一品种,但是不同生产厂家的样品,需氧菌总数的回收率也存在一定的差异。厂家 A 的小儿泻速停颗粒可采用中和法进行需氧菌总数检查,厂家 B 则需采用中和稀释法。因此,对剩余的中成药的固体制剂均采用 1:100 的供试液进行需氧菌总数的检查。
口服液体制剂(如口服溶液剂、口服混悬液和合剂等)水活度高,容易变质,不易保存,一般含防腐剂,用供试品原液做需氧菌总数的回收时,回收比值通常达不到 0.5[17],将原液稀释 10 倍,可消除其抑菌性。化学口服液体制剂可采用直接接种法;中成药类的口服液体制剂有一定的抑菌性,需联用培养基中和法。以肺力咳合剂和小儿肺热咳喘口服液为例,采用直接接种法进行检查,枯草芽孢杆菌的回收率均<0.5,进一步采用中和法,即选择 pH7.0+进行样品制备,结果均符合规定。对剩余的 8 种中成药类的口服液体制剂采用中和法进行微生物限度方法适用性检查,需氧菌总数计数回收率结果均在 0.5~2.0 之间。
由于布洛芬[18]的不同制剂类型间辅料成分不同,抑菌性也存在差异。布洛芬混悬液、颗粒、片剂、胶囊剂型抑菌性不大,可用平皿及稀释法进行检验,而软胶囊和缓释片抑菌性较强,需采用薄膜过滤法进行检验[19]。本研究中的布洛芬混悬液用平皿法即可,而小儿布洛芬栓采用中和法进行计数回收时,枯草芽孢杆菌的回收率为 0.31,将琼脂培养基从 15~20 mL 增加至 100 mL 时,需氧菌总数回收率均>0.5。
本研究的 44 种制剂的霉菌和酵母菌总数均可以采用平皿法检测,由此可见,中成药通常对细菌,特别是对金黄色葡萄球菌和枯草芽孢杆菌有一定抑菌作用,而对白色念珠菌和黑曲霉基本无抑菌作用。因此,在日常检验中,对中成药类药品可先采用金黄色葡萄球菌和枯草芽孢杆菌作为敏感菌株进行方法适用性试验,以减少工作量,提高工作效率。
通常,药品的微生物检验是一种“个性化”的检验,每种药品需根据其特性,通过方法适用性试验建立符合要求的供试品检查方法。一般的药品质量标准中,对于微生物检验通常较为简略,未具体描述其检验方法,仅要求符合制剂项下的规定。除此以外,药品微生物检验项目与其处方密切相关。在本院长期的标准复核、检验及文献报道中,许多微生物技术人员对于质量标准中处方、制法等理解存在偏差,甚至不清楚该检查哪些控制菌,误检、漏检微生物项目的现象时有发生[20]。尤其是部分中药制剂的质量标准中未明确处方或制法,给微生物检验带来一定的难度,建议在中药制剂的质量标准中应明确制法。同时,药品的质量标准中,宜明确微生物限度检查的具体方法。
儿童药品不是简单的成人药品的成分减量,其开发研究需要投入大量的时间和精力。我国目前儿童用药较为缺乏,政府对儿童药物的上市提供快速优先审评的绿色通道。本研究拟通过系统研究,建立一个适用于儿童药品的通用微生物限度检查方法,以减少工作重复,加速检验,保障儿童用药的安全有效。

来源:Internet


