您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-02 09:21
中国创新药研发走到今天,传统语境中的Fast follow基本是不再有人热衷了。尽管如此,至少到目前为止,多数Biotech公司,也包括投资机构,似乎尚未集体转向,去追逐那些真正创新的靶点——不管这些靶点是否被叫做First in Class。
就我个人而言,其实不太喜欢按照Fast follow和First in Class去对靶点作分类——复杂的现实世界显然不是这般非黑即白。一个靶点是否会纳入Biotech公司和投资人的考量,即使最精炼的思考维度,至少也要包括两项:第一,研发风险大不大;第二,竞争程度高不高,用现在流行的说法是就是“卷不卷”。
这两个维度基本是负相关:低研发风险的靶点一定“卷”得厉害,“不卷”的靶点却存在较高的研发风险高。前半句最早是说仿制药,后来变成说首仿,现在Fast follow也一样了。这么乍一看,似乎创新药研发没什么好机会可以选择。但事实上,富贵险中求,天下的生意又有哪个不是这样呢?尽管看似“不险的卷&不卷的险”,但许多真正的机会却也唯有通过不断在两个极端之间的徘徊试探,然后才被发掘和培育。
创新药的靶点选择也是类似的逻辑。既然现在低风险的靶点有点“卷不动”了,我们不妨换个方向,看看那些肯定“不卷”的靶点。尽管这样的转向势必会带来研发风险的提升,但却也未必是无解的死结。事实上,在相对高研发风险靶点的研发过程中,许多成熟的经验确然可以帮尽可能降低风险,以及提高研发确定性。譬如,同样挑战高风险的极限运动,老司机显然比菜鸟的安全系数还是高得多。
1、选择需求更加强烈的非拥挤赛道
所谓需求更加强烈,简而言之,就是目标人群大,并且缺乏有效治疗手段。
试以肿瘤药为例。不同癌种之间,研发竞争格局其实差异非常大,无论是从不同渠道的统计数据,还是业内直观感受,大概都能发现血液瘤、淋巴瘤新药研发竞争激烈程度都远超过实体瘤(尤其考虑还有CAR-T分掉一块)。
在纷繁冗杂的数十种实体瘤中,同样也是“冷热”不均,研发资源挤在肺癌、乳腺癌等几个有限的癌种,其他诸如胃癌(不算HER2和Claudin 18.2)、食道癌、卵巢癌、胰腺癌这些相对“安静”得多,中国尤其如此。去翻翻NCCN或者CSCO指南,就会发现日常被广为谈论的很多新药,都齐刷刷地挤在有限几个瘤种的末线,大量癌种依然在化疗之后便几乎再没有其他更有效的手段。
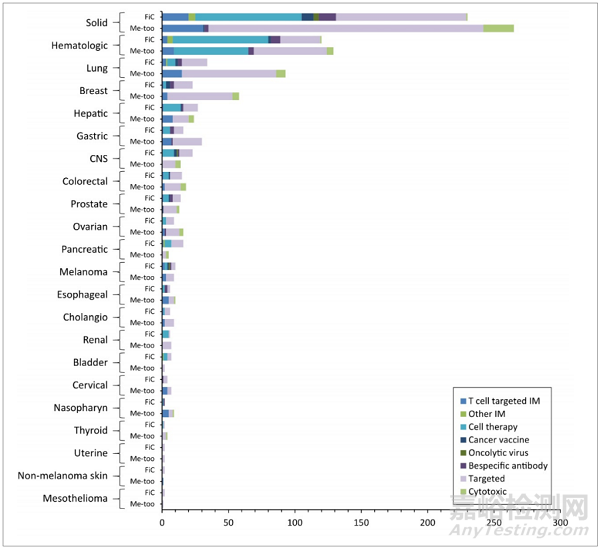
不同类型癌症的中国在研药物类型概览
数据来源:Li G, et al. Nat Rev Drug Discov. 2021 Jan;20(1):15-16.
事实上,这样的不平衡布局,恰是新靶点的机会所在。许多癌种的“研发遇冷”,看似因为研发难度过大。但事实上,无论是患者、临床医生或是监管机构,都非常希望工业界能够为这些适应症带来更多治疗选择。因此,从临床入组、监管要求乃至后续商业化门槛,它们往往都又比那些拥挤的癌种要宽松得多。
对于真正的创新靶点,其实非拥挤癌种应该是更好的选择,至少可以避开去跟那些火爆的热门药物PK,不用担心任何“卷”的风险,专心应对研发风险就行了——这本来就更贴近创新的本质。尤其对国内公司而言,胃癌、食管癌为代表的这些消化道肿瘤,是欧美公司常年忽略的,却又是中国人群需求明确的,其实机会非常大。
从更宏观的角度来说,越是不太成熟的赛道,越是容易有“弯道超车”的机会,类比中国的互联网和新能源汽车产业。这个逻辑套在适应症选择也是适用的。如果中国Biotech真在未来有机会出现世界级的新药,我认为更大概率会出现在那些公认研发需求强烈、却又不太被欧美公司去触碰的这些癌种里面。
2、深入探索疾病生物学机制
选择方向只是第一步,更重要的判断有多大机会走下去,这就需要对目标疾病的生物学机制要有足够深入的理解。对一些药企而言,很多癌症不敢被碰,的确是为“未知”的风险吓到了。
一个创新靶点,作为药物开发目标的风险究竟有多大?需要对不同层面的生物学机制进行探索,这个过程中,学术界和工业界各有定位和擅长。
并不是发现一个伴随肿瘤高表达的蛋白就能做药物靶点,这一点现在应该是常识。明确目标靶点的上下游信号通路、在整个网络中的地位(是枢纽还是冗余),这大概也不难理解。任何一个有潜力的靶点,现在都能够找到许多相关信息。到这里,还都只是学术界基础科研的活儿,对公司,大概也就是查文献和读文献。那么这就够了吗?
不是。对创新靶点而言,接下来才是关键。基础研究的这些结论,诸如信号通路、蛋白互作等,往往基于经典模式研究模型,包括细胞系、果蝇、线虫、小鼠品系等。Biotech公司做创新药研发,关注的是各种具体疾病和患者群体。基础研究发现这些可能做靶点的信号,在目标疾病中是否仍然是true signal?这个过程更多由对特定目标感兴趣的公司来自行探索。
这些都需要通过诸如病人组织样本、人源化小鼠等更接近人体的稀缺模型,对相关发现是否可重复、特定疾病是否相关、特定人群是否敏感或者高表达、哪些机制药物组合更为有效等方面进行验证。而这,便是我们南京转化医学实验室的主要工作之一,也是我们敢于探索创新靶点的坚实基础。这两年,我们的一些研究陆续正在高水平国际期刊发表,对我们的创新性也是很好的佐证。
成熟靶点的Fast follow,基本不需要这样的探索研究,省事儿又无风险,代价就是谁都能做,然后开始“卷”。创新靶点自然“不卷”,但是想要真正能够走稳,这些基于in house研究获得的对疾病的独特理解,是必不可少的。没有这些理解,你无法从纷繁的公开信息中确定那些真实可靠的信息,更不可能将靶点信息和真正的疾病信息关联起来。甚至,对欧美已经进入临床的靶点,开发策略也就只能人云亦云。国外做血液瘤,你就只能跟着做血液瘤,连淋巴瘤都不敢试,更有价值的实体瘤更是想都不敢想。
3、具备真正临床Research的能力和态度
对真正创新靶点的研究而言,临床试验不仅是Development,更是Research,包含诸多对未知的探索。
许多临床前药物发现的科学家,包括创新药投资人,往往对临床研究有些认识误区,或者囿于Fast follow时代固有观念,更多关注从候选分子临床前各种比较中表现出的优势参数,很多时候认为候选分子定了,命运也就基本定了。对于后续临床研究,虽然意识到投入高且难度大,但感觉这个过程只是Development,只是验证,好不好就是赌一把。这些认知其实并不准确。
创新靶点的临床研究,首次在人体层面对目标靶点进行操纵,获得的各种信息反馈,包括安全性、有效性等,大概率会与预期有所偏差。这些偏差是否在可控的范围内?究竟是靶点本身的问题,还是分子的问题,抑或是患者群体或适应症选择的问题?是否可以通过某些假设方式将毒性或者安全性调整回到预期轨道?这些假设应该怎样先在临床前验证,再根据结果回到临床调整方案?……等等这些问题不一而足。
除了这些基于科学本身的问题,还有新药在目标适应症的临床定位对应的不同国家Medical practice相关问题,这一点在今年年初关于FDA针对信达的ODAC会议前后已有很多讨论,这里就不多展开。
这些挑战都表明,创新靶点的临床研究,绝不仅仅是按部就班的验证过程,Biotech公司需要真正以Research的态度来开展临床。从方案设计到临床运营的各个环节的细微差别,都可能对进展和最终结果产生巨大影响。这也彰显出一家Biotech公司临床研究能力,真正把握创新靶点的药物研发过程的重要性,很可能超出过往Fast follow时代形成的认知。这个能力体现在诸多方面,包括创始人对临床研究的判断和认知、临床执行团队的经验和规范,以及临床前研究的配合、协同等等。
我们自己临床研究亦是如此。在对IN10018的开发中,我们对不同类型癌种都是采取针对性的联用策略,背后是基于疾病生物学机制研究的方案设计和针对性模型验证。包括在中美两地开发也是选择不同的癌种,设计不同临床方案,而不会简单地把同一方案扩张到不同癌种甚至不同国家。这般“对症下药”也是我们临床有机会获得更高成功概率的基础。
过去十年国内投资机构看创新药,大都盯着项目从临床前数据到团队经验等各种要素,对于临床开发,则是总想着“车到山前”就重金去挖CMO,由此带来国内包括“水母型CMO”等各种乱象。如果未来想挖掘真正能攻关创新靶点的项目,创始团队的临床Research经验,或者退一步,至少临床Research思维,当是重点评估要素。
4、深度挖掘对相关靶点的人体研究数据
药物研发最终要回到人体应用,所有创新靶点人体相关的数据和研究经验都有待深度挖掘。哪怕是negative data,也是针对目标靶点在未知人体系统中的扰动尝试,所有反馈都是对后续改进开发难得的指引。
创新靶点开发很难一帆风顺,首次人体试验“跌得鼻青脸肿”的新靶点比比皆是。即使是现如今大红大紫的靶点,许多也曾经走到被放弃的边缘。
譬如CDK4/6,90年代中期就开始不断被工业界尝试,连续多年因为安全性和靶点选择性在临床“扑街”。又如多年后日进斗金的Palbociclib,2001年被合成出来后,研发跌跌撞撞,到2003年遭遇Pfizer砍掉Ann Arbor的研发中心,连内部支持的科研团队都没了;2004年好不容易启动Phase I,一个all comer的试验设计,几乎没有看到任何临床疗效。这种情况在Pfizer内部,几乎就判了死刑。
所幸的是,这个靶点在研究领域一直没被放弃,其在肿瘤调控中的诸多特征被持续发现,包括Slamon在内的许多研究团队又在乳腺癌等疾病模型方面开展了大量研究,最终打动Pfizer重新设计和推进Palbociclib后续开发,并在ER阳性乳腺癌的Phase II研究中看到了令人惊叹的疗效,最终成就了这个“重磅炸弹”药物。
我们正在快速推进的FAK靶点亦是如此,从PubMed搜索Review文章热度变化就可见一斑。FAK最早在2010年前后开始备受MNC关注,Review数量快速上升;及至2015年,几家Phase I 数据低于预期,此后连续3年Review数量大幅减少;2019年之后,学术界和工业界,也包括我们,对这个靶点又有一系列重要发现,尤其是几项非常漂亮的临床数据陆续披露,这个靶点热度又重新回升,甚至包括许多PROTAC公司也跃跃欲试。
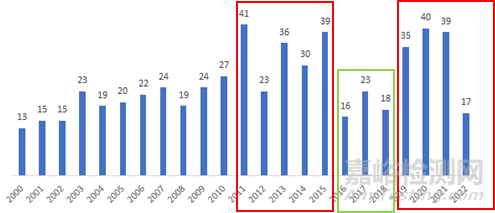
FAK相关Review历年数量走势
数据来源:PubMed
由此可见,创新靶点的判断不要以一时成败论英雄。能否站在过往研究,尤其是人体研究的基础上,深入对靶点生物学机制进行探寻,获得对这些创新靶点的独特认知,并进一步真正按照药物研发的科学规律设计后续的开发路径挖掘出真正有价值,找准方向继续开发,才是取得最终成功的关键。
纵然被MNC按下暂停键的靶点,包括在Phase I临床之后停下的靶点,未必就不能出好项目。Loxo Oncology的重磅口服TRK抑制剂Larotrectinib,最早由Array BioPharma开发。Horizon Therapeutics的IGF-1R单抗药物Teprotumumab,最早是由Genmab和Roche作为热门抗肿瘤靶点的药物开发。最近百亿收购案的明星Biohaven,当家品种Rimegepant最初也是BMS完成的早期临床研究。包括我们自己的某些项目引入策略亦是如此,这和国内前几年流行的License in模式还是明显不同的。
这大概类似有能力的家庭能把“普校”考成“学区房”,有能力的企业也能把冷门靶点做成热门靶点,前提是你要真正扎实的通过创新研究创造价值。
— 结语 —
不久前,一篇Alnylam创始CEO John Maraganore离职感言的读后感火遍全网。究其原因,我想更多还是Alnylam多年逆境煎熬,最终守得云开见月明的这段励志故事,深度引起了行业共鸣。近年来,无论是行业环境还是资本环境,中国创新药经历了如过山车般的大起大落。尽管有着曲折和反复,但大方向上的进步还是毋庸置疑的。
时至今日,寒冬又至,整个行业又开始承压,一段时间的震荡和淘汰无可避免。但也唯有如此,我们方才可能告别“内卷”的Fast follow时代,步入下一个新纪元。更多真正针对创新靶点启动的研发正在越来越受到关注,除了瞄准这个大方向,如何在研发过程中降低风险,稳定前行,势必会被越来越多的从业者思考。
最后,想引用前述那篇热文中的一句我非常喜欢的话,与共同过冬的各位同道共勉:“天花乱坠的故事适合在泡沫期以最快速度争夺资源,而脚踏实地的药物资产是萧条周期中的救命稻草。”

来源:同写意


