您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-06-30 15:24

国家药监局消息,为贯彻落实《粤港澳大湾区药品医疗器械监管创新发展工作方案》,推进粤港澳大湾区药品上市许可持有人、医疗器械注册人制度改革,发布了《支持港澳药品上市许可持有人在大湾区内地9市生产药品实施方案》和《支持港澳医疗器械注册人在大湾区内地9市生产医疗器械实施方案》。
支持港澳医疗器械注册人在大湾区内地9市生产医疗器械实施方案
为贯彻落实《粤港澳大湾区药品医疗器械监管创新发展工作方案》中“在粤港澳大湾区开展医疗器械注册人制度改革”有关要求,支持港澳医疗器械注册人将持有的医疗器械在粤港澳大湾区内地9市符合条件的企业生产(以下简称“港澳医疗器械注册人 跨境委托生产”)。经研究,制定工作方案如下:
一、工作目标
以习近平新时代中国特色社会主义思想为指导,深入贯彻落实习近平总书记关于粤港澳大湾区建设的重要指示精神和要求,按照党中央、国务院决策部署和市场监管总局等8部门印发《粤港澳大湾区药品医疗器械监管创新发展工作方案》有关规定,深化医疗器械注册人改革,允许港澳医疗器械注册人跨境委托生产,进一步推动粤港澳大湾区生物医药产业深度融合,实现粤港澳大湾区医药产业共同发展。
二、职责分工
国家药监局负责对港澳医疗器械注册证变更实施审批。
广东省药监局负责港澳医疗器械注册人跨境委托生产涉及的医疗器械生产许可工作,以及组织开展医疗器械注册质量管理体系核查,并落实属地监管责任,加强对辖区内相关企业的监督检查。
三、适用范围
(一)品种范围:适用于在香港特别行政区或澳门特别行政区合法登记的企业所持有和生产,并已获得《医疗器械注册证》在境内注册上市的医疗器械。《禁止委托生产医疗器械目录》(国家药监局通告2022年第17号)规定的品种除外。
(二)适用企业:医疗器械注册人为港澳企业的,由其在大湾区内地设立的外商投资企业法人作为代理人,办理医疗器械变更注册事项,协助港澳医疗器械注册人履行义务,承担连带责任。
港澳医疗器械注册人获得国家药监局发放的医疗器械注册证后,可以委托大湾区内地9市符合条件的企业生产。受托生产企业应当具备与所生产医疗器械相适应的质量管理体系和生产能力。
四、工作程序
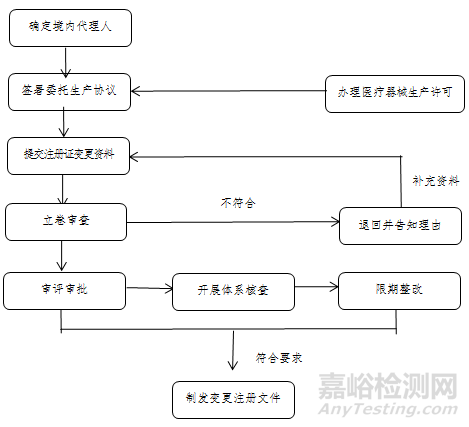
(一)确定境内代理人。港澳医疗器械注册人由其在大湾区内地设立的外商投资企业法人作为代理人,办理医疗器械变更注册事项,协助港澳医疗器械注册人履行《医疗器械监督管理条例》第二十条义务,承担连带责任。该代理人应与港澳医疗器械注册人所持有医疗器械注册证登载的代理人一致。
(二)签署委托生产协议。港澳医疗器械注册人在粤港澳大湾区内地9市选择符合条件的企业作为受托生产企业,参考国家药监局制定的医疗器械委托生产质量协议指南要求,由港澳医疗器械注册人、代理人和受托生产企业三方共同签订质量协议以及委托协议,监督受托生产企业履行有关协议约定的义务。
(三)变更医疗器械注册证生产地址。代理人协助港澳医疗器械注册人向国家药监局提交符合要求的申请材料。国家药监局器审中心按照程序开展审评审批工作。广东省药监局按照医疗器械注册质量体系核查有关要求、生产质量管理规范及其附录的要求组织开展现场体系核查。经技术审评及注册质量体系核查,符合要求的,准予变更注册,发放《医疗器械变更注册文件》,载明受托生产企业名称、生产地址及原注册证号等信息。
(四)受托生产企业履行报告义务。港澳医疗器械注册人完成医疗器械注册证变更后,受托生产企业应当向广东省药监局报告增加生产产品品种,并提供委托方、受托生产产品、受托期限等信息。
五、申报资料
按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家药监局公告2021年第121号)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家药监局公告2021年第122号)有关要求提交变更注册申报资料。
六、实施依据
《医疗器械监督管理条例》《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》《医疗器械生产监督管理办法》《粤港澳大湾区药品医疗器械监管创新发展工作方案》等。
七、注册收费
医疗器械注册收费标准按照《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年53号)要求执行。
八、工作要求
(一)港澳医疗器械注册人跨境委托生产的医疗器械,原则上应当与医疗器械注册证及其附件载明的相关事项保持一致,其主要原材料和生产工艺不应发生改变,产品在境内生产的质量管理体系应当与境外生产质量管理体系具有等同性。
(二)港澳医疗器械注册人应当严格落实医疗器械全生命周期质量管理主体责任,按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》等要求,建立健全质量管理体系并保证有效运行,切实履行全过程质量管理、不良事件监测及产品召回等义务。
(三)港澳医疗器械注册人在大湾区内地9市的生产经营行为违反《医疗器械监督管理条例》及配套规章制度的,注册人承担主体责任,代理人承担连带责任,受托生产企业承担相应法律责任。港澳医疗器械注册人、代理人应当每年对质量管理体系的运行情况进行自查,并于次年3月31日前通过省药监局网上平台提交自查报告。
(四)广东省药监局按照“问题导向,防范风险,责任明晰”的原则,创新医疗器械监管方式,与港澳监管部门探索建立信息畅通、衔接有序、协作有力的监管工作机制,完善事中事后监管体系,增强监管合力。夯实港澳注册人医疗器械全生命周期质量管理责任,监督代理人对研制、生产、经营、使用全过程中医疗器械的安全性、有效性依法承担连带责任,加强对受托生产企业相关生产活动的监督检查,加强相关产品质量抽检和不良事件监测工作,提升分析预警能力,切实防范医疗器械安全风险。
九、其他事项
(一)港澳医疗器械注册人可以在大湾区内地9市符合条件的多家企业进行委托生产,办理程序同上。
(二)港澳医疗器械注册人解除跨境委托生产的,原受托生产企业应当在30日内向广东省药监局报告。
(三)关于港澳医疗器械注册人委托生产的医疗器械上市销售问题,由广东省药监局牵头与海关、税务、外汇管理等部门沟通,协助企业实施依法合规的便捷跨境结算方式。

来源:国家药监局


