您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-29 04:30
磷酸钙骨水泥(CPCs)因其具备生物相容性、生物降解性、可注射性和自凝性,已成为最经济有效的生物材料,可作为骨缺损填充材料。由于CPCs能够稳定释放各种有机分子,也被广泛用作药物递送载体。本综述汇编了过去25年中CPCs的药物可控释放情况,阐明了CPCs的特性与药物释放之间的动力学和力学相关性,可指导具有定制药物释放功能的骨缺损填充材料的设计和制备。
01、研究内容简介
引言
骨组织是人体中最不易触及的组织之一。当出现骨质疏松、骨髓炎、骨肉瘤、骨折或创伤等病理情况时,需要进行侵入性手术移除病理组织和植入假体或再生支架。骨再生是术后完全恢复的重要步骤。在过去的30年里,骨组织工程的范式已经包含了以下四个关键因素:1)一种生物相容性的支架,它与天然骨的细胞外基质生态非常相似;2)形态发生信号,有助于将细胞导向表现型理想的类型;3)招募成骨细胞铺设骨组织基质;(4)充分的血管化,以满足组织生长的营养供应和清除需要。因此,理想的骨再生材料是由生物相容性、生物可吸收材料制成的支架,该支架可递送骨形态发生蛋白(BMPs)等形态发生分子、转化生长因子β(TGF-β)和其它物质。此外,术后或创伤后事件的第一个阶段的组织炎症,它开始于最初的12h内,在损伤后7天左右结束。由于必须始终考虑手术部位被致病菌污染的可能性,因此就产生了对生物材料局部和持续递送抗炎和抗生素分子的需求。从这个假设出发,在过去的30年里有无数的研究致力于开发合适的生物材料协助再生过程,以满足机械性能、生物体内植入的要求和逐步释放药物或分子。
骨骼是一种不同区域具有各种各样的机械特性和代谢率的器官,因此,对于这些区域,不同的释放速率被证明是理想的。例如,长骨表现出一种功能梯度的性质,从中间的软骨髓到其周围相对多孔的松质骨,再到近表面和表面的较硬、多孔较少的皮质骨。随着释放药物的清除率随着距离长骨中轴的距离而降低,因此精确调整的植入位置的释放率是至关重要的。这篇综述的目的是描述一种被称为磷酸钙骨水泥(CPCs)的特殊材料的不同结构和组成特征影响药物释放特性的方式。假设建立了这样的相关性后,向骨骼输送药物的领域将更接近于一种生物材料可以在原位调节的状态,从而为骨缺损的生理生态位产生理想的释放动力学。
CPCs由于其特殊的生物相容性和生物可吸收性而成为骨缺损填充物研究的热点之一。Ginebra等人详尽地综述了CPCs释放各种原子和分子物质。CPCs的另一个特殊性能是具备可注射性和适应骨缺损部位几何形状的能力,允许进行微创重建手术。CPCs可以通过粉末和液相混合进行原位合成,并在几分钟内变硬。
自20世纪90年代初的第一次开创性研究以来,许多工作都集中在CPC基质的药物释放上,每一次的后续研究通常是对药物释放机制和条件的更深入理解。为了对所得到的结果进行正确的解释,借鉴了药代动力学领域的理论和半经验模型,并成功地将其应用于CPC-药物释放系统,作为CPC基质药物释放的定性和定量分析工具。一旦建立了释放机制的基本特征,就提出了众多配方不同的CPC作为不同药物的载体基质。对CPC粉末和液体成分的相对量,添加剂的使用,药物种类,载药方法和基质药物体系的许多方面进行了实验,以寻找特定药物在与其临床应用相应的条件下最满意的释放动力学。通过初始释放量、最小释放量和最大释放量、总释放时间、释放速率和释放曲线等参数来确定药物的最佳释放度,这些参数是药物整体释放动力学和释放机理的衍生物。大多数文献报道都集中在CPC支架药物释放的两个主要方面:1)基体成分特征,包括化学成分、孔隙率、结晶度和可降解性,是否加入补充相或其他添加剂;2)药物相关研究,研究药物的不同方面,考虑药物类型、载药量和载药方法等参数的释放效应。除这两个主要方面外,还有一些报道致力于研究各种环境条件,如释放介质或体内释放对药物释放动力学的影响。
本综述系统地回顾了在过去25年内CPC基质对药物释放特定领域的贡献。由于比较不同的基质-药物释放系统存在方法学上的困难,我们通过选择满足特定要求的文献来完成该工作。选择的文献满足以下要求:1)所包括的工作必须至少有4个实验点的定量释放数据(除了第8节,它关注的是体内释放),用以正确定义释放曲线;2)几乎所有被收录的文章都包含了由于释放系统的一种或多种特性的曲线变化的比较结果,如药物类型、CPC基质的结构特征(如孔隙度、微结晶度、添加剂浓度等)、载药方法和其他。在该工作中,我们做了大量的工作来明确区分CPC药物系统的不同特征。这样做的目的是试图分离出对释放行为的个体结构或组成影响,并找到一种系统的、合乎逻辑的原理,来解释是什么驱动了释放过程的不同方面。尽管作出了种种努力,但这些确定CPC基质结构的变量始终是相互关联的。由于不可能在这些不同但又内在相互关联的变量之间划清界限,因此,对于定义释放动力学的每个讨论案例的关键特征必然存在一些疑问。对于这些多重协同工作系统的关键参数来说尤其如此。关于基质组成的一个例子是,经常不可能将基质的主成分与它的额外成分清楚地区分开来。在这方面可以考虑的因素很多,但最终的决定考虑引入的额外成分(如二次CP前驱体粉末或生物可降解聚合物)的化学性质、其相对数量以及其在骨水泥基体中分布的均匀性。在所有这些考虑和合理化之后,将有一条非常细且相当模糊的界线将这些个别因素区分开。但决定其中哪一个因素占主导地位将或多或少是武断的。
另一个难以解决的问题是,如何根据药物的物理化学组成和释放特性将药物释放系统分类为可定制和可调节的。在2016年的一项研究中,Uskokovié等人提供了这些术语的词源和功能分类。然而,根据相关文献中所报道的药物释放动力学的方式,将复杂的多组分系统归类为这些类别之一仍存在疑问。其中一个例子就是在添加或不添加聚合物添加剂(如壳聚糖或聚酯)的情况下,CPC基质的释放。一个固定组分的CPC可以被归类为可定制释放的基质,但连续添加不同数量的聚合物,例如,在1-5 wt%范围内添加5种不同浓度的聚合物将使系统变得可调节。然而,在这种情况下可调节性是由于与CPC的附加组件的相关变化,而不是与核心基质的相关变化。这就产生了一种关于系统是否在本质上是可定制或可调节的不确定性。尽管存在未解决的问题和歧义,但这项工作的结构还是被划分为以下两部分:具体的组成和结构特征对药物释放过程的贡献。这些个体的特征是CPC药物释放系统中研究最多的方面,深入了解它们对释放率的贡献,可以帮助研究人员合理设计用于特定的医学应用的释放动力学。事实上,设计一种具有生物活性的CPC作为骨缺损填充物,需要全面了解控制药物释放的因素,无论是单独作用还是协同作用。从定性的角度对这些因素进行解释和阐述,并在对相关文献进行全面调查的基础上,提出了本文的中心主题。
1 动力学方程和半经验模型
在这篇综述中,报道的文献使用了不同的方程和半经验数学模型来定量地解释释放结果。图1图示了药物分子从基质中物理释放的三个最常见的反应顺序,即第零、第一和第二。当药物的溶解只是时间的函数,且在任何给定的时间点,与药物浓度无关时,则零级动力学方程适用。一级动力学描述了药物的吸收/释放,其中反应速率与药物浓度线性相关。二级动力学表明药物的释放/吸附速率与药物用量或浓度的平方值有关。
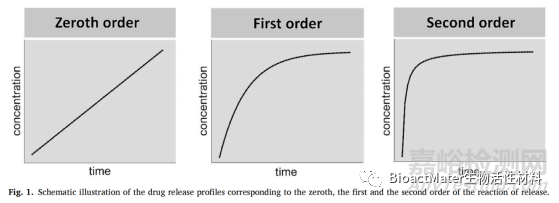
虽然上述动力学方程可以为许多单维和简单系统提供精确的数值解,但它们在实际的三维情况下用途有限,因为要正确地建模所研究的系统,必须考虑到环境变量的复杂性和多样性。此外,从这些数值解中推断释放机制的信息,从来没有一个直接和明确的方法。为此,提出了一系列适用于药物释放体系的经验和半经验模型和方程,能够为药物释放动力学和机制提供更现实的指示。
Higuchi模型于1963年被提出,用来描述药膏膜中药物的溶出速率,后来它被应用于更广泛的环境中,如片剂的药物释放。由于丰富的需求,这种关系经常被错误地应用于不能严格满足所有需求的系统中。因此,所有偏离理想条件的情况都必须加以评估,以便对所要达到的结果作出正确的解释。Korsmeyer等人提出了一个不同的半经验模型,称为Korsmeyer-Peppas模型或幂律模型。
2 基质的一般特征
2.1 预调CPC基质的一般特征
用于调整CPC基质药物释放的一种非常常见的方法是修改骨水泥配方中的粉末相、液相或两相。几篇文章集中讨论了药物释放控制方面,尽管各自有着不同的目标和结果。由于药物的释放速率与硬化骨水泥的溶出速率成正比,因此控制这种溶出速率也是控制药物释放速率的方法之一。
1998年,Otsukad等人研究了基体几何特征对释放特性的影响,为此制作了相同厚度(2mm)、不同直径(2,4,15 mm)的CPC片。研究了形成HAp的TTCP/DCPD骨水泥在不同的药物装载量下放置1h后吲哚美辛的体内和体外释放情况。在这里和文本的其他地方,“体外”一词指的是仅偶尔补充生物分子物种的非生物释放条件,但不包含任何细胞。吲哚美辛的释放速率与片的表面积呈线性关系,为扩散控释(至少在实验第一阶段),与Higuchi方程的实拟合证实了这一点。
有几篇著作研究了使用液相对药物释放的直接或间接影响,这些液相是由已知对CPC凝结过程有延缓作用的成分或与之一起加入而获得的,例如羧酸的化合物类。在2007年的一项研究中,Alkhraisat等人旨在阐明在模拟骨中高度血液灌注区域的条件下,决定透钙磷石表面降解的因素。为了提高透钙磷石的稳定性,用不同浓度的磷酸、乙醇酸、酒石酸和柠檬酸水溶液制备了不同的骨水泥。静置反应开始后,将标本浸泡在培养液中1分钟(磷酸溶液)或2分钟(羧酸溶液)。失重是通过比较释放前后干燥颗粒的直接重量来测量的。实验证据表明,失重与所使用的液相有关:磷酸>酒石酸>乙醇酸>柠檬酸。在添加0.5%透明质酸和0.5%硫酸软骨素-4后,进一步研究了柠檬酸制备的骨水泥的降解行为。透明质酸制备的骨水泥表面崩解明显减少。Khasaba等人在2010年的一项工作中使用了类似方法,其中探索了使用不同液相获得CPC的几个方面。骨水泥的制备采用相同的粉末相(磷酸-水合物-钙磷酸盐的混合物(MCPM)、CaO和合成HAp的混合物),但采用不同的液体,即聚丙烯酸(PA)、聚烯酸或35% (w/w)聚甲基乙烯醚马来酸的水溶液。前两种骨水泥在孵育的第一天表现出强烈的钙释放,而后一种水泥的特点是在整个8周的潜伏期内都是受控释放的。
Hemmati等人在2014年的一项工作中进一步评估了抗坏血酸(AA)在CPCs释放行为中的作用。得到了不同的CPC基质,包含不同量的AA: 0、50、100和200 mg/ml。用幂律模型拟合了抗坏血酸在模拟体液(SBF)中的释放规律。计算的k参数随着AA含量的增加而减小,表明在AA浓度为100和200 mg/ml时,骨水泥的微观结构更加致密。另一方面,当AA浓度为50 mg/ml时,n因子比AA浓度较高时(0.38 vs. 0.15)高出两倍以上。AA浓度为100和200 mg/ml时,AA的扩散释放受到阻碍,这可能与AA与CPC的相互作用较强有关,且浓度越高,AA的扩散释放越明显。
Akashi等人在2001年发表了一篇论文,其中选择基于ɑ-TCP的CPC作为抗菌药物的载体。将不同的粉末(ɑ-TCP, ɑ-TCP + BaSO4)和液体(水+羧甲基纤维素钠,水+柠檬酸+酒石酸+聚羧酸)混合得到两种不同类型的骨水泥,分别称为I型和II型。混合后,骨水泥在潮湿的环境中保持1h,然后浸入释放介质中。考察了甲硝唑、头孢克洛和环丙沙星的释放度。骨水泥I由针状羟基磷灰石晶体组成,具有较高的孔隙度,可以更快地释放药物。另一方面,骨水泥II主要形成无定形钙盐,具有更紧密的颗粒聚集,在孵育早期释放较慢,尽管在随后的时间点倾向于急剧分解,诱导由基质降解驱动的药物释放。这项工作的结果为研究胶结物液相的化学性质所起的作用,以及它们如何影响凝固过程,进而影响药物释放行为提供了有趣的见解。首先,他们证实了羧酸在一般情况下是凝固反应的缓凝剂。因此,由于长时间的凝结反应,骨水泥保持其可塑浆状态的时间更长。对于药物释放实验,骨水泥在混合后几分钟浸泡在培养溶液中。骨水泥浆体可以被认为是高多孔系统,其中组成的纳米颗粒相互之间是弱纠缠的。因此,只要凝结过程被延缓,培养介质可以很容易地在基质中扩散,增强汇聚,从而产生爆发效应和增加药物释放。液体组分的性质也会影响基质在释放介质中的溶解度。Ca的释放是骨水泥降解的标志之一,可以用骨水泥的溶解度来解释,而骨水泥的溶解度又取决于在液相中使用的羧酸的内溶解度。可以得出结论,溶解度越高,骨水泥的降解程度越高,因此,从这些系统中释放出的药物数量也越多。最后,可以讨论液体组分对骨水泥最终pH值的影响。Khashaba等人报道,骨水泥的pH值,特别是在固化过程的初始阶段,对药物的溶解起着重要作用。因此,使用改性聚丙烯酸获得的更酸性环境往往会增加释放速率,而使用液相中的聚甲基乙烯醚马来酸获得的pH值更中性的骨水泥具有更可控的药物释放特性。
Irbe等人的团队在2012年的工作中采用了类似的实验方法,通过不同粉末和不同液体的组合来创建粘合剂,以阐明对利多卡因释放的影响。他们获得了3种不同的骨水泥,即HAp-B、HAp-A和DCP/HAp,其中DCP代表无水(DCPA)或二水(DCPD)形式的磷酸二钙,它们与两种不同负荷的利多卡因(30和50 mg)混合。DCP/HAp骨水泥的特点是在第一个10 h80%的装载药物以强烈的爆发解吸释放。相比之下,HAp-A和HAp-B水泥在第一个24h内只允许40%的药物进行持续线性释放,在第3天完全释放完。平行实验证实,除HAp/DCP外,其他基质的pH值均随时间增加,但仍保持较高的酸性水平。这种酸性环境是骨水泥溶解度高的原因,这解释了药物释放速度快的必然结果。
2013年Su等人提出了一种双相α-TCP/HAp骨水泥作为庆大霉素的载体进行研究。不同庆大霉素载量(4、8和16%)包括在骨水泥中。释放实验显示释放剖面有两个不同的阶段。在第一阶段,观察到一种爆发释放,药物的溶解量相对较大。这个阶段之后是第二个阶段,这个阶段是一个较慢且更持久的释放。作者通过药物对凝固阶段骨水泥基质结构演化的影响来解释这种行为。研究认为,庆大霉素分子中所含的硫酸盐基团阻碍了α-TCP向HAp的相变,因此没有形成针状或片状晶体,从而阻碍了庆大霉素的释放。因此,在反应的第一个h内,即在转化完成之前,释放了大量的药物。随着庆大霉素和硫酸盐离子的释放,针状结构的形成加快,减缓了释放过程。
2.2. 原位固化CPC的一般基质特征
有几篇文章试图评估骨水泥凝固/硬化过程的不同阶段对脱模行为的影响。从2017年到2019年Rau等人的两部工作中,分别考虑了Cu和Fe离子的释放。作者研究了Cu-TCP前体粉末中Cu离子的释放以及相应的Cu-TCP骨水泥形成更多可溶性透钙磷石。出乎意料的是,除最早的1h外,所有时间点从TCP粉末中释放的Cu都高于从透钙磷石骨水泥中释放的Cu。当Cu含量归一化为材料中主动释放相的量时,前驱体粉末的释放量继续高于骨水泥,但差异不再具有统计学意义。两种剖面的特征都具有相对强烈的爆发释放和接近零阶的动力学。Ginebra等人的两篇文章重点介绍了新鲜混合CPC与预先配制的CPC在释放率方面的比较。在他们2013年的工作中,将多西环素(DOXY)负载到新鲜的CPC和7天前的预先配制的CPC中,并研究了释放行为。预先配制的的CPC的特点是扩散控制释放。Korsmeyer-Peppas拟合提供了在释放实验期间保持不变的k参数,作为在孵育期间未发生微观结构改变的证据。非Fickian扩散由计算的参数n定义,其范围介于0.49和0.58之间。对于新的CPC,观察到了不同的情况,有两个不同的释放区域作为孵育时间的函数。初始阶段显示爆发释放,然后是第二阶段,速率显著降低,随着药物的持续释放,趋于零阶动力学。在两种不同动力学状态之间的过渡时间与最终设定时间之间发现了相关性。作者认为,这种相关性表明了CPC微观结构演变对释放模式的影响。假设在设定反应过程中,发生缺钙HAp(CDHA)纳米晶体的沉淀,填充先前由含有药物分子的液体占据的空间。这导致曲折性增加,这阻碍了药物的迁移率,从而降低了释放速率。
在不同凝固时间使用骨水泥可以模拟临床上适用的可注射骨水泥在不同凝固和硬化阶段的脱模行为。因此,在2015年的后续工作中,Mestres等人将注意力集中在不同时间制备的透钙磷石骨水泥基质上:3min(新鲜骨水泥)和1h和15h作为预固骨水泥。选择辛伐他汀作为模型药物,并装载到上述骨水泥上。释放曲线由Korsmeyer-Peppas模型拟合。药物从3min和1h凝固骨水泥的释放,在前8h内显示出爆发释放,其余4天溶解较慢,而15h骨水泥能够在整个孵育期间提供持续的洗脱。拟合参数得出传输机制异常的结论,相应的n值为0.77。通过了解n值,可以计算出所有检查的CPC的k参数及其随时间的变化。从尚未凝固的新鲜骨水泥与预先凝固的骨水泥之间的差异可以看出,初始k值(k3min > k1h > k15h))与曲折系数呈负相关。将k值绘制为时间的函数,突出显示了3min骨水泥微观结构的快速变化,伴随曲折性增加。1h骨水泥显示k值随时间的变化较慢。有趣的是,在释放实验的终点,不同骨水泥的所有k值都收敛于几乎相同的值,证实了在不同凝固时间研究的同一骨水泥的相似结构性质。
在2016年的一项研究中,Uskoković课题组展示了获得具有适应性药物释放的可注射骨水泥的可能性。该研究以HAp1和HAp2两种碱性粉末为骨水泥配方的基本组分,以HAp1:HAp2, 0:100、50:50、85:15和100:0等不同比例组合而成。HAp1是由缓慢降水制备的,而HAp2是突然沉淀的。这两种主要组分的特殊之处在于,HAp2在与液体混合后和以结晶形式重新沉淀之前能够保持其无定形状态。另一方面,HAp1倾向于快速恢复到其原始结晶状态。通过以万古霉素和环丙沙星为模型药物的骨水泥进行释放实验。药物溶解实验表明,HAp2具有高爆发释放和快速药物耗尽的特征。在HAp1中观察到相反的行为。混合组分骨水泥具有混合行为,释放速率与所用HAp2的比例成正比。作者给出的解释提到了一些热力学考虑因素,例如前体粉末的表面能和溶解度与其结晶或无定形条件的关系。而2019年的后续文章侧重于阐明在由HAp1和HAp2组成的相同骨水泥系统中以不同比例释放药物的机制的特征。所研究骨水泥的基本考虑因素与前面描述的工作相同[38]。然而,这一次,动力学分析旨在破译释放过程中涉及的机制的关键方面。采用Korsmeyers-Peppas模型,作者证明,通过绘制骨水泥中k参数与HAp1/HAp2比率,观察到k值的显着增加,表明HAp2的微观结构允许更快释放,且在许多情况下更有利的释放。万古霉素释放的n个值的模拟图表明,该指数随HAp2含量的降低,表明从异常传递到更常见的非Fickian扩散的转变。在以环丙沙星为模型药物的情况下,结果恰恰相反,n指数随着HAp2含量的增加而增加,这表明药物的性质不仅可以影响释放速率,还可以影响释放机制。
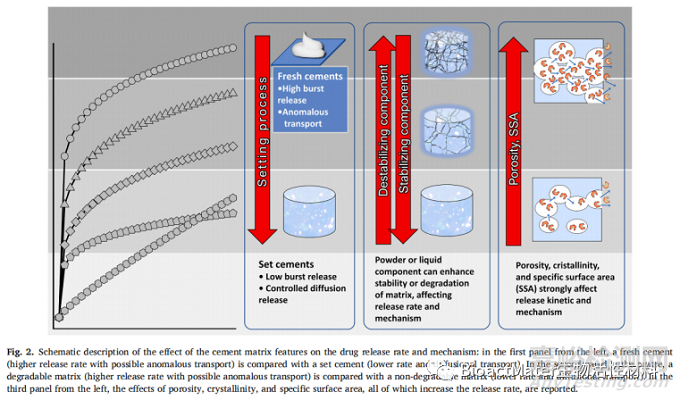
在Uchida等人2018年的一项研究中,报告了从CPC和不可生物降解的聚甲基丙烯酸甲酯(PMMA)释放的万古霉素在体外和体内条件下的比较。在体外实验中,CPC载体的药物释放量始终比PMMA载体的药物释放量更大,并且这种释放差异随时间持续56天而不断增加。比较TCP和HAp颗粒的释放是Son等人2019年的一项工作的目标。以硫酸庆大霉素为模型药物,使用从颗粒状TCP或HAp和TCP颗粒混合物中获得的基质研究其溶解。研究了三种释放系统,其中硫酸庆大霉素分散在内部:1)TCP颗粒,2)TCP-HAp颗粒和3)凝固剂,即水。当药物溶解在由TCP和HAp混合物组成的基质中时,获得最佳释放速率。该系统在140h内表现出恒定和持续的释放。作者认为,与TCP相比,HAp颗粒的存在具有显着降低的溶解度,使得骨水泥在凝固反应期间不易降解。HAp颗粒的内在稳定性有助于保护负载的庆大霉素,允许药物在144h内更持久和持续的释放。此外,HAp颗粒的存在可导致DCP的形成,其特征在于孔隙率增加,从而增强释放。一般来说,尽管始终存在的物理效应,但药物释放速率预计与CPC演变成的CP相的溶解度成正比。尽管迄今为止尚未进行专门比较CPC中药物释放的相位依赖性动力学的研究,但除了这里提到的间接解决这一问题的研究外,仍然可以得出这一结论。考虑到本节中总结的所有影响,图2示意性地代表了诱导趋势,具体指基质降解性,新鲜度和微观结构特性对药物释放动力学和机制的影响。
3. 孔隙率和孔隙特征
孔隙率和孔隙特征清楚地代表了CPC基质最重要的性质之一,以及它们的化学性质。适当的孔隙度的载体允许在水泥中承载相对大量的药物,同时保证载体不受阻碍的吸附和解吸的可能性。许多作者试图深入了解载体基质孔隙度对释放过程的影响的特异性,并且一些工作报告了诱导,增强和定制孔隙特征以获得最佳释放的可能方法。在Haghbin-Nazarpak等人2010年的一项工作中,研究了双相骨水泥(β-TCP和MCPM)中硫酸庆大霉素的释放。释放曲线显示,该过程分两个不同的阶段进行:在第一阶段,持续约10天,沿着骨水泥表面分布的药物以相对较高的速率释放。骨水泥的降解与初始释放阶段同时发生。骨水泥基质上出现裂缝和大孔,其尺寸范围为微米,导致约15%的药物突然爆发释放。从第10天到第15天,没有观察到药物的进一步释放。Otsuka等人研究了碳酸氢钠添加对碳酸磷灰石骨水泥中吲哚美辛释放行为的影响。通过增加NaHCO3的量制备了4个样品3致孔剂(0%,2%,5%,10%)。微孔分布研究表明,释药后微孔尺寸增大。NaHCO3的含量对孔隙尺寸和释放过程有很大影响,NaHCO3含量越高,孔隙半径越大。作者解释了这一效应的原因,因为碳化磷灰石的溶解度增加,在基质中NaHCO3含量较高时产生的孔洞数量增加。然而,游离的碳酸盐以二氧化碳的形式升华也一定是孔隙形成的原因。孔径分布的变化对释放速率影响很大,释放速率随孔径增大而增大。释放曲线表现为扩散控制的缓释过程,缓释速率随NaHCO3加入量的增加而增加。然而,在10% NaHCO3的情况下,孔隙的扩大非常明显,导致装载的药物在前10h内爆发释放量几乎100%。Girod-Fullana等人在2009年的一项工作中使用了类似的方法。在这种情况下,释放系统由装有布洛芬作为模型药物的果胶微球组成。将微球以2%、4%和6%w/w的不同比例掺入CPC基质中,以探讨复合材料内微球量对释放过程的影响。测定了所有复合样品的总孔隙度和微孔隙度,发现它们都随着微球含量的增加而增加,从0%微球含量的0%大孔体积分数增加到6%微球含量下的29%。释放实验的结果显示,所有复合材料均具有非Fickian扩散状态,释放持续至少45天。出乎意料的是,微球含量较低的复合材料的释放速率较高,因此孔隙率较低。作者对这种现象提出了两种可能的解释:1)药物的限制可能诱发局部浓度超过溶解度水平,导致释放速度减慢;2)果胶形成凝胶的能力,因此一些微球可能经历膨胀并填充CPC的一些固有孔隙,从而降低真正的孔隙率。
不同的课题组研究了混合过程中使用的粉末与液体比(P/L)对孔隙率的影响以及使用此参数来定制药物释放速率的可能性。在Hofmann课题组2009年的工作中,研究了产生接近零孔隙率基质的可能性,以防止抗生素从CPC基质中爆发释放。他们研究了以不同P/L比率(2.5g/ml和4.0g/ml)创建的CPC制剂万古霉素和环丙沙星的释放。这两种配方的孔隙率分别为18%和38%。累积释药曲线显示,两种药物的P/L比均为4.0时的释药速率大于2.5时的释药速率,且两种药物的扩散机制均无明显变化。因此,这些结果符合释放速率应随基质总孔隙率增加的概念。在2011年的一篇论文中,Schnieders等人通过改变药物负载方法研究了CPC孔隙度对药物释放的影响,即通过将药物直接负载到CPC基质上或将其封装到随后掺入CPC基质的可生物降解聚(乳酸共乙醇酸)(PLGA)共聚物中。为了调节样品孔隙度,采用不同的P/L比,创建了5种不同的CPC配方,P/L比分别为2.0、2.4、2.7、3.0和3.3 g/ml。孔隙率随液量的增加几乎呈线性增加,即随P/L的增加而增加。在药物直接分散到CPC的情况下,药物的释放速率和初始爆释量与P/L比值成反比增加。结果表明,与直接载药相比,PLGA微球载药体系的药物释放时间延长,爆发释放时间减少。当使用通口模型来拟合实验数据时,提供了一个更有趣的见解。而在直接装药的情况下,Higuchi系数与CPC孔隙度有很好的相关性,而在PLGA微球包覆的情况下,没有相关性。这表明在后一种情况下,药物的释放是由微球的扩散控制的,大大降低了药物释放速率对基质孔隙度的依赖性。Ginebra课题组在2013年的论文中得出了类似的结论。在这项工作中,设计并实施了一系列实验,以确定不同的变量是如何影响药物(DOXY)的释放,无论是单独的还是协同的方式。针对孔隙率因素,作者研究了两种不同液粉比(L/P)(0.35和0.65 ml/g)的CPC基质的特性。开放孔隙度测量显示,液体含量较高的样品的平均孔隙尺寸更大(L/P为0.65)。正如预期的那样,L/P高的骨水泥具有更高的释放率。
Otsuka课题组报告了许多工作,这些工作具有相同的方法来诱导CPC基质中的孔隙率。在这些工作中,使用预先配制的含有药物的CPC块作为基质,并采用多根不锈钢针形模沿块沿规则的三维模式多交叉排列,机械地在块内形成一系列大孔,然后移除。在这些论文中,使用相同的方法来研究机械诱导的大孔(半径为300,500或600μm)对药物释放的影响。使用具有越来越多的交叉排列的大孔(0,20,40,60)的不同骨水泥块进行释放实验。每个块含有相同量的药物。释放模式揭示了大孔数量与释放速率之间的直接关系。所有的释放模式都表现出扩散趋势,因此采用通口图进行拟合,并从这些分析中计算出相对的通口常数。计算出的通口常数绘制为宏观孔数或相应比表面积的函数。在所有情况下,实验数据都通过具有高回归系数的线性回归得到良好拟合,从而建立了获得装载了具有所需释放速率的不同药物的CPC块的可能性。在2013年的两篇文章中,Hesaraki等人评估了通过添加十二烷基硫酸钠(SDS)作为表面活性剂在CPC基质中诱导大孔的可能性。在参考文献中,释放系统是通过不同量的SDS(0,20和100mM)与不同剂量的头孢氨苄-水合物(CMH)作为药物(0,1,5,10wt%)负载到骨水泥中而获得的。观察到释放超过300h。不同体系的释放曲线揭示了诱导的宏观孔隙率对释放模式的有趣影响。在释放的前10h,观察到扩散控制状态,当向系统中加入大量SDS并产生更多大孔时,释放速率更高。将这些结果与通口模型拟合产生良好的相关性。在24-300h的时间间隔内,观察到与该行为的偏差,释放与时间呈线性关系,遵循零阶动力学曲线。这种偏差归因于CPC基质的降解,在该方案下,释放速率不再与基质孔隙率相关。在同一组的第二项研究中,作者探索了多孔CPC中地塞米松(DEX)的释放行为。实验配制与前一个类似涉及通过添加SDS(0 mM和100mM)结合不同药物剂量(0,10,50,100 nM)的多孔CPC基质。据观察,SDS的添加导致大孔隙率增加13-16%,同时相对于无SDS的CPC,微孔体积随之减少。所有系统的释放曲线都显示出扩散控制的释放,较高的释放率对应于较高的SDS和DEX量。释放曲线同时拟合了Weibull方程和Korsmeyer-Peppas模型。拟合参数表明,虽然宏观和微观多孔基质具有相同的释放机制(n值或d值之间的差异在统计学上不显著),但k和t常数存在显着差异,这取决于基质的几何和物理特性。作者推断,这些差异可归因于孔隙率引起的基质修饰。根据本研究的结果,可以得出结论,将大孔引入微孔CPC中可以成为增加释放速率的途径,与引入大孔的浓度和平均大小成正比。在Vorndran等人2013年的一项工作中,提出了一种可注射的即用型CPC糊剂作为具有药物载体特性的骨填充剂。CPC浆料是使用油基化合物作为液相而制成的。将这种油基骨水泥的特性与其水基类似物进行了比较。水基CPC参考的总孔隙率为42%,高于油基孔隙率约20%。水基骨水泥的平均孔径为15 nm,而油基骨水泥的平均孔径为25-30 nm。尽管总孔隙率较低,但释放曲线表明所有油基CPC的释放速度更快,而Korsmeyer-Peppas拟合表明药物的溶解发生在扩散或扩散/降解状态下。这归因于油基骨水泥特有较大的孔隙。孔隙扩大与骨水泥中水溶液的分散或骨水泥中所含固体药物的溶解有关。
在Uskoković课题组于2016年发表的文章中,该文章的重点是制备具有可调释放曲线的CPC基质,考虑了几个参数,以便辨别每个参数在定义两种不同抗生素的释放行为中的作用:万古霉素和环丙沙星。所研究的系统由两种不同HAp粉末的各种组合组成:HAp1,具有更高的结晶度,相对较低的孔隙率(42%)和较低的释放速率;和HAp2,大部分无定形,但具有较高的孔隙率(55%)和强烈的药物释放倾向。实验证据表明,随着杂化骨水泥中HAp2的相对量增加,药物的释放速率和孔隙率平行增加。在Lucas-Aparicio等人2020年工作中,研究了基于TCP的CPC,其中Si在基质中具有广泛的适应性,作为药物的潜在载体,能够提供恒定释放和最小的爆发效应。对不同Si量的骨水泥进行表征:化学计量Si取代的0%,40%和80%。结果表明,总孔隙率和平均孔径随Si的引入而减小,而比表面积随Si含量的增加而增加。Si含量的增加导致释放能力的重大变化:从0%和40%Si情况下的一阶释放到80%Si情况下的零阶释放。此外,Si取代率为80%的骨水泥显示出可忽略不计的爆发释放。作者将这个有趣的结果归因于孔隙的纳米性质,其能够产生更大的曲折性,并成为药物扩散的关键控制因素。显然,当孔的尺寸与药物分子的尺寸相当时,孔径的影响比毛孔明显大于药物分子时更强烈,在这种情况下,后者可以自由地扩散出孔隙,并且释放更多地受到扩散而不是结构因素的控制。结论即药物运输机制与药物分子与孔径之间存在的关系密切相关。
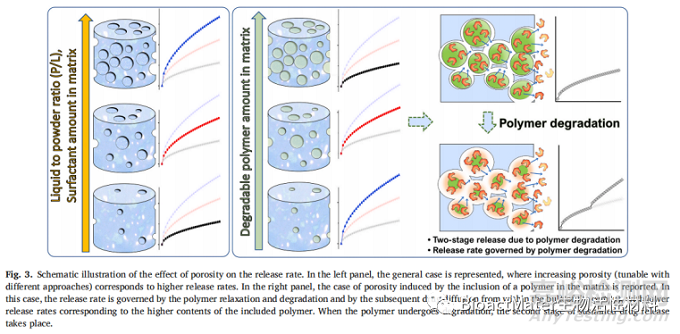
适当调整孔隙大小以适应药物的尺寸(例如,小药物分子的孔径为几个纳米,大药物分子的孔径为几十纳米),可以在分子尺度上建立非Fickian扩散驱动机制,适当大小的孔隙允许一次释放单个分子,产生与浓度无关的零级动力学。相反,当孔隙尺寸大大超过药物分子尺寸时,药物会发生流释,产生Fickian扩散机制和爆发效应[55]。图3示意性地总结了CPCs中孔隙率影响药物释放速率和机制的不同效应。
4. 基质添加剂
Wang等人报道了一种通过向CPC基质中加入聚合物来控制药物释放的相对简单的方法,即将CPC粉末与不同的聚合物混合,例如甘露醇晶体或水杨酸晶体。这些添加剂在基质中诱导大孔,并用于提高生长因子的释放速率。提出了一条显示TGF-β1从CPC/(水杨酸)复合材料中释放的曲线。药物的溶解发生在一阶动力学中,并且观察到持续释放超过800h。
在Takechi等人2002年的一项研究中,观察到用壳聚糖修饰的CPC基质中释放出抗生素氟莫西夫钠。将不同量的聚合物添加到骨水泥中以破译其对药物释放的影响。从含有0%,0.5%和1%壳聚糖的骨水泥中获得释放曲线。在持续24h的第一阶段,壳聚糖含量最低的骨水泥的释放量较高。24h后,生理盐水缓冲液被充分补充,释放开始,幅度减小,但行为相反,特别是含有更高浓度壳聚糖的骨水泥释放率更高。作者解释说,在第一阶段壳聚糖可能已经填充了骨水泥基质的孔隙,从而促进了药物的保留。然而,当生理盐水缓冲液被取代时,具有较高量壳聚糖的骨水泥,现在含有较大量的保留药物,开始以更高的速率释放药物。
De la Riva等人在2009年的一项工作中提出了一种透钙磷石-壳聚糖基质系统作为生长因子的载体,特别是血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF)。首先合成了一种小型圆柱形壳聚糖海绵,PDGF和VEGF分别作为液相或海藻酸盐微球的组分包含在其中。反过来,海绵被掺入骨水泥中,从而产生了含药物的透钙磷石-壳聚糖支架的两种变体。两种药物都以扩散控制的动力学释放。在前24h内,分别释放了45%和13%的PDGF和VEGF。在最初的爆发释放之后,PDGF的释放在连续两周后达到70%,而64%的VEGF在接下来的3周内释放。这些结果证实了壳聚糖减缓药物释放的能力。虽然药物分子主要吸附在透钙磷石颗粒上的表面结合位点上,但它们被更深入地掺入壳聚糖的碳质网络中,这解释了它通过延长和复杂化药物分子的逃逸路径来降低释放速率的能力。
在Tığlı等人的一篇文章中报道了壳聚糖/HAp支架的开发是用于递送碱性成纤维细胞生长因子(bFGF)。他们制备了两个支架,反应溶液中壳聚糖含量分别为2%和3%(w/v)以及HAp颗粒的1.25%(w/v)。使用溶剂吸附法将bFGF插入支架中。两种制剂的释放曲线都表明,由于基质中存在HAp,释放速率受阻,溶解过程延长,而且在较高浓度的壳聚糖下制备的支架释放速度更快。这暗示了通过调节反应溶液中聚合物浓度来控制CPCs释放速率的可能性。实验数据与幂律模型拟合。异常转运表征了bFGF从这些HAp/壳聚糖支架中释放的特征,表明水的吸收和溶胀控制的扩散是bFGF释放的关键机制。
在Lode等人报道的一项研究中,探索了用VEGF功能化的CPC的释放动力学。通过使用不同的添加剂组合获得改良的CPC基质,即将前体粉末与2.5%(w/w)矿化胶原蛋白I(BioD/coll)和48g/g柠檬酸三钠(BioD/coll/cit)或25mg/g O-磷酸化-l-丝氨酸(BioD/coll/PS)混合。由此共得到3种改性骨水泥基质,并在非生物细胞培养条件(37°C,5%CO)下获得VEGF的释放曲线。三种不同的分子式均表现出扩散控制的动力学。所有的变异都包括胶原蛋白(coll)显示出增加的初始爆发。胶原是CP复合材料中最常用的有机添加剂之一。它加入到CPC前体中可诱导Ca2+离子形成复合物,并在凝结时间上有轻微的延缓。
胶原蛋白增加爆发释放的趋势可以通过这种大分子降低CPC对VEGF的结合效率的能力来解释,因此有更多的未结合的VEGF分子自由扩散出基质。这个阶段之后是剩余7天的较慢释放。BioD/coll/PS配方相对于纯胶原蛋白变体没有显着变化。相反,观察到柠檬酸三钠变体的释放速率降低(BioD/coll/cit)。作者认为柠檬酸三钠可以增强骨水泥的负表面电荷,从而导致对VEGF的静电亲和力增加,并且与CPC的结合更强。然而,对于所有制剂,7天后显着减慢释放,在BioD/coll和BioD/coll/PS的情况下累积释放为25%,在BioD/coll/cit的情况下累积释放为15%。
Li等人研究了用壳聚糖寡糖(CO)和胶原多肽(CP)等有机相修饰的CPC释放鲑鱼降钙素(S-CT)。用不同量的CO-CP有机相制备了4种不同的骨水泥:0%,5%,10%和15%w/w。从这些复合材料中观察到S-CT的释放60天。对于所有制剂,释放的两个阶段,其特征在于不同的速率,可以个性化。虽然未改性的骨水泥在前7天内表现出较高的释放速率,但在此时间点之后,CO-CP改性骨水泥显示出更高的释放速率,其量级与CO-CP含量成正比。这被认为是由于释放的第一阶段有机相填充基质孔。在潜伏期,多糖倾向于溶解在骨水泥基质内留下开放的通道,并允许药物的更高释放。观察到接近零阶的动力学,在整个实验过程中两个阶段都有恒定和持续的释放。
Chen等人测试了通过加入0.5%海藻酸盐修饰的CPC复合材料作为庆大霉素的药物载体。比较了未改性和改性骨水泥的释放曲线。海藻酸盐的添加强烈减轻了最初的爆发释放,从未改性骨水泥中前24h的70%变化到改性骨水泥中的51%。一般来说,用改性骨水泥获得更慢,更受控的药物释放。根据先前的文献数据,这可以通过庆大霉素与海藻酸盐甘露醛残基的选择性相互作用来解释。对于这两种变体,一周后观察到药物完全耗尽。最后,藻酸盐的添加不会改变释放曲线的形状,在这两种情况下,释放曲线都受到扩散的动力学控制。
Colpo等人在2018年的工作中旨在阐明控制来自两种不同CPC基质的不同药物体外释放的机制:1)从纯α-TCP前体获得的骨水泥和2)从α-TCP粉末中获得的骨水泥,加入10wt%丙烯酰胺聚合物(α-TCP DS粉末)。选择四种不同的分子作为释放实验的模型药物:硫酸庆大霉素,利多卡因,布比卡因和盐酸左布比卡因。共进行2(基质)x 4(药物)= 8个实验。首先,所有研究系统的XRD结果允许得出结论,药物不会干扰凝固过程,并且所有骨水泥的最终成分由α-TCP,β-TCP和CDHA的混合物组成。通过将骨水泥浸入pH 7.0和37°C的10ml磷酸盐缓冲盐水(PBS)溶液中,总持续时间为90天,进行释放实验。相似的特征表征了基质/药物系统的所有组合,在前200h内发生爆发效应,随后降低和持续释放速率。除利多卡因情况外,所有其他体系均显示出从10 wt%丙烯酰胺加成中获得的基质的更高释放。为了确定释放动力学和机制,将三种不同的数学模型应用于释放实验曲线:1)通口方程,2)Korsmeyer-Peppas方程和3)Peppas-Sahlin方程。与实验数据的最佳拟合是通过使用Peppas-Sahlin模型实现的。比较同一释放药物和不同基质的Peppas-Sahlin方程的n个指数,结果表明,较高的n值(在0.33-0.51范围内)表征了α-TCP DS骨水泥的释放,表明Fickian扩散是普遍的机制,异常传递的贡献很小。作者得出结论,后一种贡献可归因于丙烯酰胺的链松弛和随之而来的水凝胶的形成,这解释了更高的释放速率。
Lin等人在一项工作中使用了带有羧基基团的多壁碳纳米管(MWCNTs)来增强三斜磷钙石基骨水泥,并为MG132开发了合适的载体系统,MG132是一种小肽分子,用于抑制nf - kb介导的破骨吸收。MG132释放的间接测量是从28天的荧光素酶测定中推断出来的。研究发现,与未改性CPC水泥相比,MWCNT的引入降低了MG132的爆裂释放,并诱导了更持久的释放。MG132的药理活性保存时间最长可达28天。
Wang等人研究了丝素对α-TCP基骨水泥的增强作用。信号素3A (Sema3A)被装入壳聚糖微球(Sema3A/CMs)中。因此,负载微球被纳入骨水泥/丝素复合材料中,制备了Sema3A CMs/SF/a-TCP,研究了Sema3A从该传递系统的释放情况。在孵育的头几天观察到初始爆裂效应。此后,Sema3A以接近零级动力学的方式持续释放。作者没有提供任何聚合物(壳聚糖)降解的证据,因此低爆发效应伴随一个可控的零级动力学释放可以认为与其它结果一致,即药物包被聚合物微球的释放动力学由聚合物弛豫控制。
在2016年Zhang等人的一项工作中,制备并表征了实验性口腔正畸骨水泥。为了制备这些骨水泥,ACP颗粒以40%的比例掺入:1)苯四甘油利用的混合物(PMGDM)和乙氧基双酚A利用(EBPADMA)的质量比1:1;2)聚乙烯(PE)+10% 2-hydroxyethyl丙烯酸甲酯和双酚A 5%缩水甘油利用(PEHB),形成两种截然不同的复合材料:PE + 40 ACPp和PEHB + 40 ACP,分别。两种不包括ACP (PE和PEHB)的骨水泥也分析了其钙和磷酸盐离子的释放。进行了三轮释放和再释放。在第一轮测试中,PE + 40ACP,特别是PEHB + 40ACP的释放量很高,这表明了树脂相配方的重要性。作者将PEHB+40ACP相对于PE+40ACP的更高的释放倾向归因于10% wt%的HEMA组分,特别是其亲水性,这可以解释该配方较高的吸水率。HEMA的这种特性可以促进基质内水的增强扩散,使钙和磷酸盐离子在pH调节的培养基中溶解和释放更高。进一步的补液和再释放试验表明PE+ 40ACP和PEHB+40ACP的释放能力优于无ACP的骨水泥。每一轮的特征是所有配方的释放率都在下降。此外,每个释放轮中所有骨水泥的所有释放曲线都以扩散状态为特征。
在Uskoković等人2017年的一项工作中,HAp形成CPC添加了二氧化硅和明胶,这使骨水泥具有热固性。因此,在室温下凝固大约需要45分钟的骨水泥体积将在生理37°C下在几分钟内凝固。由于明胶的溶解受到控制,这些额外的组分也增加了硬化产品的表面孔隙率,明胶在固体材料中留下了空隙。研究了两种不同骨水泥配方中万古霉素的释放,其中含有19.4%和26.5重量%的添加剂相。这两种骨水泥均未检测到爆发释放,并且与无添加剂CPC相比,它们的总释放速度较慢且更持久。药物释放动力学与明胶含量无关,表明释放主要通过万古霉素对HAp的亲和力来控制。万古霉素负载效率和凝固骨水泥中HAp的重量百分比的平行增加支持了万古霉素主要不是被明胶捕获的观点,而是通过静电吸引与HAp表面结合,并通过在水合力的帮助下克服这种吸引力而释放出来。然而,明胶在这里仍然起着关键作用,通过包覆HAp颗粒并阻碍万古霉素分子的解吸,从而促进其缓慢和持续的释放。
在Schumacher等人2017年的一项研究中,提出并研究了一种VEGF和溶菌酶(Lyz)蛋白的递送系统,该系统来自基于硅酸钙的CPC和介孔生物活性玻璃(MBG)组成的基质。将介孔硅酸钙以不同比例加入到前驱体α-TCP粉末中,选择含有10 wt%MBG的制剂作为适合药物释放评估的制剂。通过将前驱体粉末与Na2HPO4水溶液混合得到水泥。两种不同的负载路径用于包埋Lyz:1)在Na2HPO4水溶液中溶解Lyz;2) MBG粒子在Lyz富集缓冲溶液中孵育。实验评估了两种蛋白质从纯CPC基质和CPC/MBG复合材料水泥预先设置3天的个体释放。两种基体的释放曲线比较表明,CPC纯基体的释放率高于CPC/MBG复合材料的释放率。扩散曲线显示两种不同基质中VEGF和Lyz的释放,表明基质的扩散是其主要机制。从CPC/MBG基质中释放的较低量的蛋白质可归因于介孔二氧化硅诱导的拮抗作用。也就是说,一方面已知MBG具有固有的孔隙率和通过形成水合二氧化硅物质在溶液中降解的高度倾向。从理论上讲,该因素会诱导药物释放速率的增加。另一方面介孔二氧化硅具有高生物活性,能够促进骨水泥表面沉积一层CDHA并阻碍药物的浸出。在这项研究中,后一个因素的主导地位可以解释CPC/MBG系统的释放减少。
Jani等人在2018年的工作中提出了介孔二氧化硅(MCM-41)和HAp复合材料(MCM/HA)作为布洛芬(IBU)的递送基质。将该基质的释放行为与纯MCM-41制成的系统进行比较。释放测试在PBS溶液中的体外条件下进行,pH值为7.4。从比较MCM-41和MCM/HA释放IBU的曲线中得出的最重要结论是,MCM-41基质中释放的药物的量更大。介孔二氧化硅基系统也显示出更高的爆发释放,导致在前10h内所含药物的更快消耗。在剩余的60h内观察到几乎可以忽略不计的释放。另一方面,MCM/HA显示出更封闭的释放,具有轻微的爆发效应,其次是减少但持续的释放。观察到的爆发释放可归因于基质表面上存在IBU分子。FTIR分析表明,SiOH沿孔壁富集,并且IBU的OH−和COO−基团可以与SiOH通过氢键作用。此外,IBU的羧基可以与HAp的Ca2+相互作用。作者认为,这些因素可能导致IBU在基质中的迁移率降低,从而导致MCM/HA系统的释放速度变慢。
Su等人2013年的一篇文章报道了硅酸钙(CS)改性β-TCP骨水泥作为药物载体。考虑了CS与β-TCP不同比例的配方,即0:100,30:70,50:50,70:30和100:0。研究了这些基质中成纤维细胞生长因子-2(FGF-2)的体外释放。当浸入SBF溶液中预定时间时,对所有配方的基质骨水泥本身的降解进行监测。发现掺入较高量CS的基质的降解速率受到抑制。众所周知,由于在表面形成Si-OH物质,CP晶格内硅酸盐基团的适应性降低了表面电荷,这反过来又提高了表面Si的溶解速率。此外,富SiO2层的形成诱导Ca2+和PO43-从溶液中沉淀,导致HAp层的形成,部分屏蔽了溶液中的基质。然而,FGF-2在12周内的释放显示出随着CS含量的升高而稳定增加的解吸速率。有趣的是,虽然曲线在释放的第一阶段保持了相似的释放,表明存在扩散控制释放,但它们之间的差异在较长的孵育期开始累积,并且释放动力学从一阶变为零阶,与CS含量成反比。这一结果与CPC降解证据一致,表明在CS的量较低时,由于骨水泥溶解程度较高而导致的药物释放变得更加突出。富含CS的骨水泥中更受控的药物释放与上述形成浅表HAp的过程一致。
用离子掺杂粉末相是另一种控制CPC释放速率的策略。许多能够将自己容纳在CP晶格内的离子使其变形并使其更易溶,从理论上讲,这应该使药物负载不稳定并且更容易更快地释放。例如,Ito等人2006年的一项工作报道了实验的结果,该实验旨在探索通过添加Zn来改变β-TCP陶瓷溶解速率的可能性,其含量在0到10 mol.%之间。为了量化陶瓷的溶解分数,Ca2+测量醋酸盐缓冲液中的浓度。溶出通量图表明,支配该过程的机理是多核化,而平衡溶解度随Zn含量的降低而降低,这是由于形成的自由能降低(相当于由于Zn的存在而增加稳定性)。锶(Sr)是CP中另一种常见的阳离子掺杂剂,与Zn一样,它增加了基于TCP的CPCs的溶解度[77],因此,使它们比纯CPC更容易表现出更快的药物释放动力学。
Alkhraisat等人在2009年的一项研究中研究了Sr掺杂对CPC中DOXY羟甲酸的负载和释放的影响。本研究选择了三种不同的CPC配方:含有0%、13.3%或26.6%Sr的β-TCP CPC.测量了所有配方的孔径和比表面积,显示与无Sr对照相比,它们在含Sr的基质中增强。CPC在低(5mg/ml)和高(24mg/ml)浓度的DOXY下在不同的含药物溶液中孵育24h。观察到孔径和比表面积对药物负载有直接影响,由于结合位点增强且药物分子可及性,在含Sr的骨水泥中更有效。解吸曲线证实了含Sr骨水泥与液体介质的渗透效率。当药物浓度≥10mg/ml时,结合位点的饱和度发生,过量的药物分子过度饱和骨水泥表面。在孵育的前40h内,相对于无Sr对照,Sr的释放率分别为13.3%和26.7%。用幂律方程拟合释放曲线,计算的拟合参数表明,低载药量(5 mg/ml)的DOXY释放曲线呈现出Fickian扩散规律,高载药量(24 mg/ml)的DOXY释放曲线呈现出异常扩散规律。这可以归因于DOXY分子在高负载下在骨水泥表面过饱和结合位点上的不均匀分布。
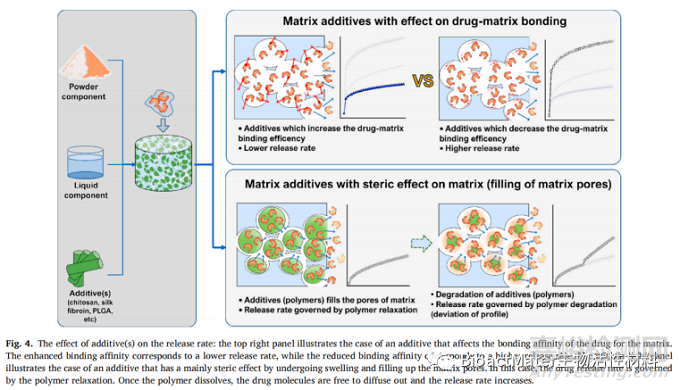
Sr掺杂对α-TCP骨水泥降解及其Sr离子释放的影响也是Shi等人报道的一项研究的目的。从不同的Sr来源制备不同的Sr取代骨水泥:Sr-OCP粉末(Sr-CPC-O),Sr-αTCP粉末(Sr-CPC-S),SrCO3粉末 (Sr-CPC-C)和SrCl2解决方案(Sr-CPC-L)。水泥的Ca到Sr最终替代率分别为0.2%、1.0%和1.0%1.5%。对所有骨水泥中Ca2+和Sr2+离子的释放进行了实验。老化溶液中钙离子的浓度表明,在前14天钙离子的释放持续缓慢,随后在其余14天的监测中钙离子的释放迅速增加。对于所有骨水泥都观察到了这一点,而不考虑骨水泥中的Sr含量。Sr释放率主要由CPC中的Sr替代度定义。实验结果表明,Sr-C-C的Sr浓度最低,并且很可能含有SrCO3,分解并重新结合在基质中,有助于质量的增加。Sr-CPC-S显示出Sr释放的显着增加,可能是由于含有不纯β-TCP的水合骨水泥中存在弱碱性化合物。图4示意性地总结了CPC中添加剂影响药物释放速率和机制的不同效应。
5. 药物类型
在van Staden等人2011年的一项研究中,进行了一项实验来监测由透钙磷石制成的骨水泥中蒙氏肠球菌素ST4SA的释放。观察到具有高初始爆发释放的典型一阶动力学。这证实了抗生素从CPC中快速释放的一般趋势,特别是当它们以透钙磷石为基础时。在Otsuka课题组1991年的工作中,比较了两种不同抗生素头孢氨苄和诺氟沙星的释放,两者都以4.8%的负载效率负载到CPC上。定性和定量分析,加上实验数据与通口模型的拟合,表明典型的非Fickian扩散表征了两种药物的释放,它们之间没有显着差异。
监测CPC基质中淫羊皮苷和万古霉素的双重递送是Huang等人在2013年报道的研究对象。在这项工作中,两种药物同时装载在同一个骨水泥载体中。一旦置于孵育溶液中,则单独测量其浓度30天。两种药物都显示出持续释放30天的监测。虽然没有尝试进行定量分析,但两种释放曲线虽然有些奇特,但可能与零阶动力学大致相关。
在Saleh等人于2016年报道的一项研究中,选择硫酸庆大霉素、阿莫西林和氨苄西林三水合物来研究Mg取代的透钙磷石骨水泥作为药物载体的潜力。实验释放曲线表示双峰释放,典型的初始爆发发生在前24h内,然后是第一动力学顺序的持续释放。三种不同药物的测定释放速率依次为:硫酸庆大霉素>氨苄西林三水合物>阿莫西林。在Akashi等人2001年的一篇文章中,观察到三种不同药物的释放模式,即甲硝唑,头孢克洛和环丙沙星。CPC基质的两种变体被用作载体,它们在释放行为中的作用在其他地方被推测出来。释放数据与通口模型拟合,导致扩散机制在前24h内具有相对较高的爆发释放,随后在所有检查药物的后期阶段释放明显减慢。释放速率的比较表明,它们遵循以下顺序:甲硝唑>环丙沙星>头孢克洛。作者将这一结果解释为取决于药物的化学性质及其与CPC的相互作用。甲硝唑的最高释放速率是由没有羧酸基团解释的,羧酸基团存在于头孢克洛和环丙沙星中。该组具有与Ca离子形成稳定复合物的能力,从而在CPC支架内捕获得更强。此外,环丙沙星剂量含有硬脂酸镁作为非活性成分,其能够抑制α-TCP缩合并延缓凝固反应,因此有利于药物的释放。在Hofmann等人2009年的一项工作中,对CPC释放的万古霉素和环丙沙星进行了比较。在他们的释放机制中没有发现特别的差异,在这两种情况下都对应于典型的非Fickian扩散。万古霉素的初始率较高,这可以用万古霉素的水溶性来解释,其比环丙沙星高10倍。万古霉素与环丙沙星之间的另一项比较是在Uskoković课题组的两个工作中描述的实验中进行的。在这些工作中,两种药物都负载到不同的CPC基质中,指示为HAp1,HAp2及其以不同比例的组合,即85:15 HAp1:HAp2和50:50 HAp1:HAp2。实验数据采用幂律模型拟合,通过该模型获得所有药物-CPC组合的n和k参数。据观察,不同的药物甚至可能具有不同的从相同的CPC基质中释放的机制。例如,随着CPC基质中HAp2的量增加,万古霉素的释放机制逐渐从异常转运转变为更规律的Fickian扩散。相反,当从更结晶的基质转变为更无定形的基质时,环丙沙星的释放机制从规则的非Fickian扩散演变为案例II超传递机制。通过分析从四种不同基质释放的两种药物的结果,可以确认释放取决于药物与CPC之间相互作用界面的亲密性质。强调了药物和基质之间的协同作用,强烈影响释放行为。
Gbureck课题组从2013年开始的工作旨在阐明可注射骨水泥作为药物载体的特性。通过将CP粉末与含有表面活性剂的油基液体混合来获得骨水泥。选择庆大霉素和万古霉素作为模型药物。两种抗生素的特征是初始释放在7-28%的范围内。:之后,万古霉素的释放率由平方根曲线确定,而庆大霉素则持续释放数周。这种差异是由于硫酸盐反离子的作用,它干扰了膏体内的阴离子十六烷基磷酸盐表面活性剂,改变了药物的溶解度。硫酸庆大霉素对这种效应比万古霉素更敏感,因为万古霉素的正电荷密度较小。
Pasqual等人在2021年的一项研究中评估了释放溶液中存在的离子和反离子物种的相互作用对药物释放的影响。该研究采用电化学阻抗谱法研究了硫酸庆大霉素和盐酸利多卡因从TCP基质中释放出的药物,并将结果与更常见的技术(即紫外-可见光谱)的结果进行了比较。作者得出结论,以盐的形式负载到基质上的药物的释放速率取决于它们在培养基中的溶解速率以及随后解离成离子和反离子的速率。药物溶解过程中形成的离子与盐水缓冲溶液中已经存在的离子物种之间的特定相互作用可以在确定释放机制和释放曲线的形成中发挥重要作用。在同一组的先前研究中,证明盐酸利多卡因的添加增加了一组基于TCP的骨水泥中针状和板状CDHA晶体的尺寸,这反过来又加速了药物释放的速度。作者通过假设较大的颗粒允许更丰富的吸附和更丰富的药物分子从骨水泥晶体表面溶解来解释这种效应。
生长因子是另一类生化化合物,需要局部给药,并受益于持续和受控释放。在De la Riva等人报道的一项研究中研究了VEGF和PDGF的局部控制释放,其中提出了由透钙磷石和壳聚糖组成的复合基质作为药物释放的基质。然而,在这里必须考虑到,虽然PDGF直接包含在基质中,但VEGF被封装在藻酸盐微球中,然后将其引入骨水泥中。因此,与PDGF相比,VEGF表现出非常温和的初始爆发释放:分别为13%和45%。此外,PDGF最终在2周内完全释放,而封装的VEGF显示出持续释放超过35天。在Habraken等人2008年的一项工作中,通过实验不同的药物负载方法,研究了CPC释放的三种不同生长因子(重组人TGF-b1,bFGF和BMP-2)。一阶释放动力学表征了所有监测释放实验。此外,无论负载方法如何,不同生长因子的释放速率都非常相似。释放曲线的特征在于释放速率的顺序如下:bFGF>BMP-2>TGF-b1。作者的结论是,很难提供能够预测不同生长因子释放动力学的解释,因为必须考虑许多因素,例如等电点,水合作用和空间位阻因子,即使这样,这也不足以提供明确的答案。Gunnella等人在2019年的另一项工作专注于释放属于TGF-beta宏观家族的三种生长因子:GDF5,BB-1和BMP-2。将不同剂量的每种生长因子负载到CPC支架的两种不同变体上,其中一种与PLGA纤维结合。PBS+FCS/绵羊血清在孵育30天后的累积释放结果显示BMP-2(43.7%)释放率很高,其次是GDF5(22.6%)和BB-1(13.2%)。在所有研究的系统中观察到扩散动力学,其特征在于爆发释放,然后释放速率逐渐减速。作者将生长因子之间速率的差异归因于基质和生长因子之间的不同相互作用,特别指的是对CP具有高亲和力的BMP-2官能团(羟基,胺和羧基)。此外,生物分子的空间位阻3D排列可以在确定这种相互作用的特殊性中发挥重要作用。还必须考虑不同尺度上骨水泥的物理化学,组成和空间组织。
根据本节中报告的研究结果,很明显药物身份可以或多或少地直接影响释放动力学。该药物可与CPC基质相互作用,对药物溶解产生轻微至明显的影响。某些类型的药物具有能够通过氢键与骨水泥表面相互作用或螯合Ca2+的功能团,就像含有羧酸盐基团的药物一样。这些相互作用通常以通常与特定化学相互作用的强度成正比的方式延缓药物的释放。另一个常见效应涉及对配制属性引起的变化。小药物分子特别容易在释放的最初几个小时内诱导凝固反应的延迟和随后释放速率的增加。另一个重要作用依赖于药物诱导最终骨水泥的物理化学变化的能力,例如孔隙度,结晶度和比表面积。对于含有硫酸盐反离子的药物尤其如此,它可以诱导最终孔隙率的增加和/或充当骨水泥沉淀的成核中心,从而降低最终产物的结晶度并加速释放。图5示意性地总结了CPC中药物的分子特性影响药物释放速率和机制的不同效应。
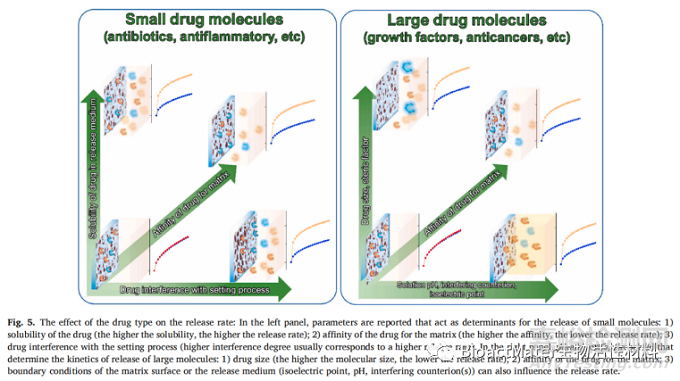
6. 药物浓度
Hamanishi等人于1996年进行的一项经典研究中,对TTCP-DCPD骨水泥中不同量万古霉素的释放进行了80天的监测。将骨水泥中加入1%、2%或5%的万古霉素,并以PBS测定其解吸速率。发现释放的终点与万古霉素的负荷量有关,等于5%负荷为80天,2%负荷为40天,1%负荷为20天。接下来,Otsuka等人研究了不同浓度下吲哚美辛的释放,并于1997年报告了研究结果。CPC负载1%,2%或5%的吲哚美辛,并在SBF中测量药物释放。体外释放发生在弥散状态下,以mg单位为单位的绝对速率与负载的药物量成正比。Rabiee在2013年的一项工作中,研究HAp骨水泥中释放的盐酸四环素(TCH)是其目标。研究了装载了4种不同TCH量的骨水泥。发现释放速率和机制都取决于药物负荷,速率归一化为初始药物负荷,并以百分比表示,与药物负荷量成正比。观察到从高剂量的一阶到低剂量的零阶的动力学转变,表明对于后者,溶解-扩散机制调节溶解。Sakamoto等人评估了不同药物负荷下万古霉素和阿米卡星释放情况的比较。在骨水泥混合之前,将药物直接添加到粉末组分中。释放曲线显示出类似的行为:在阿米卡星的情况下,由于添加的药物量较高,获得较高的累积药物释放,而相反,对于万古霉素,由于负载药物的较低剂量而发生较低的累积释放。
Zou等人在2007年发表的文章研究了纳米HAp-壳聚糖(nHAp/CS)复合递送系统中不同浓度的小檗碱释放。制备了7种小檗碱浓度为0.1%~1%的nHAp/CS制剂。观察到持续释放至少28天。动力学特征揭示了溶解状态的两个阶段。在第一阶段,观察到爆发释放,释放速率直接取决于负载药物的数量。在第二阶段,观察到药物溶解加速,特别是对于低剂量的药物。通口模型用于定量描述释放动力学。从第14天开始,释放的第二阶段显示出与平方根定律的偏差,特别是对于低药物剂量(0.1和0.3%)。随着初始药物负荷的增加,偏差变得不那么明显。作者解释说,在第一阶段,动力学主要是吸附在基质表面的药物的溶解,这对于高剂量的药物来说更快。当这个阶段结束时,CS的降解决定了第二阶段的动力学。CS溶解允许嵌入在大部分骨水泥中的药物分子溶解,并且对于低药物负荷的样品,这种效应更为明显。
在Alkhraisat等人的一项研究中,进行了Sr取代的CPC中DOXY羟甲酸的不同负载的吸收。本研究采用不同锶含量的Sr-CPC基质(13.3%和26.7%)。对于这些输送系统,速率和机制都取决于药物负荷(5和24mg/ml)以及骨水泥中的Sr含量。对于5mg/ml的DOXY羟甲酸盐,释放速率和初始爆发通常随着Sr含量的增加而增加,而对于24mg/ml负载的DOXY羟甲酸酯观察到相反的行为。通过幂律拟合解吸数据,并计算出的n个值来阐明释放机制。因此,所有低药物剂量的CPC的n值<0.45,表明为Fickian扩散。另一方面,对于所有具有高剂量药物的CPC,n值范围约为0.75,表明运输异常。这可能是吸附在骨水泥表面上的DOXY水环状物碎片脱落的结果,这在高浓度药物下发生的程度更大。Lucas-Aparicio等人在2020年的一篇文章中采用了类似的方法。进行了一系列实验,以评估硅取代的CPCs中以5和10mg/ml的浓度释放万古霉素,[Si/(Si+P)]原子比为40%和80%。此外,研究了两种装载方法,但药物量的影响仅与其中一种方法相关,其中涉及在骨水泥制备阶段以8.4mg的量添加固体药物。药物含量的降低通常导致较慢和延长的释放,以及轻微的爆发。Korsmeyers-Peppas的契合揭示了低药物剂量的扩散机制和高剂量的异常运输。这种行为归因于药物在高剂量情况下的过饱和度,诱导释放减慢。在含有80%Si的骨水泥的情况下,观察到动力学模式的根本变化,从装载100mg万古霉素的骨水泥的第一阶到含有8.4mg万古霉素的骨水泥的理想零阶。
在Hesaraki等人的一项研究中,将不同浓度的头孢氨苄一水合物(CMH),包括5和10重量%,被负载到改性CPC基质中。加入一种基于TTCP的粉末,加入数量可变的SDS作为表面活性剂,并研究了CMH释放。进行了通口模型拟合,揭示了在这种特定情况下,与骨水泥内表面活性剂的量相比,药物负荷起的作用较小,这强烈地决定了动力学和释放机制。在Montazerolghaem等人2012年的一项研究中,证明了辛瓦斯汀(SVA)从酸性CPC中持续释放。将不同剂量的固体药物(1,0.5,0.25和0mg SVA/g骨水泥)加入CP粉末中,与凝固液体混合以形成CPC药物输送系统。累积释放速率与药物剂量成反比。使用幂律来拟合数据,并且对于所有SVA剂量,获得n值约为0.53,表明异常转运作为释放机制。异常的Fickian动力学归因于骨水泥凝固最后阶段发生的微观结构变化。此外,获得了k值,并且它们与药物负荷呈负相关。这项工作中没有讨论这一方面,但是在类似实验中获得的结果允许假设高剂量的SVA可能与局部过饱和度以及随之而来的释放减慢有关。在van Houdt等人2018年的最新工作中,使用高剂量(5wt%)和低剂量(0.5wt%)的阿仑膦酸盐(ALN)来研究由60wt%CPC和40wt%PLGA组成的复合材料的药物释放。在高剂量和低剂量下均观察到持续释放超过150天。高ALN剂量系统的累积释放率明显更高。作者得出结论,高剂量的ALN可能会阻碍初始TCP向最终HAp阶段的转化,延缓硬化过程,从而允许释放更大量的药物。
在Blom等人的三项研究中,采用了类似的实验方法,以研究由rhTGF-b1生长因子作为药物和CPC作为药物载体的系统的释放特性。实验方法是将rhTGF-b1在不同负载下混合:5,10,20,66和133ng至CPC粉末组分的固定量,然后与液相混合以触发凝固反应。之后,监测细胞培养基中rhTGF-b1的释放48h。结果表明,rhTGF-b1的释放速率可以通过改变生长因子的负载量直接调节。这是因为在负载的生长因子量和相应的释放速率之间发现了直接的相关性。实验数据还强调,释放仅从CPC基质表面发生,但在监测的48h内释放了适量的rhTGF-b1(2%)。对于所有生长因子载荷,在释放的最初几个h内发生爆发释放,随后溶解明显减慢,动力学由基质表面的扩散控制。
Habraken等人分析了CPC中不同生长因子的释放,包括TGF-b1,bFGF和BMP-2。还监测了BMP-2释放的不同量的这种生长因子,这些生长因子负载到固定量的骨水泥上:50 ng,500 ng和5μg。该研究证实,不同生长因子负载下的载流子系统具有相同的释放曲线,其特征在于初始爆发释放,因此释放速度较慢,总持续时间为45天。因此,这些特征表明,不同释放生长因子的动力学模式和机理相同,仅在幅度上不同,显示出生长因子负荷与其释放速率之间的直接相关性。Gunnella等人最近的一项工作侧重于从透钙磷石骨水泥中释放骨形态发生蛋白GDF5,BB-1和BMP-2,其中GDF5和BB-1生长因子以四种不同浓度与骨水泥混合:2,10,200,1000μg/ ml,考虑2和10μg/ ml作为低剂量,200和1000μg/ ml作为高剂量。在这种情况下,累积绝对释放模式也表明释放幅度严格取决于生长因子负荷。此外,所有模式的动力学都是相似的,这表明从骨水泥表面释放的扩散机制。然而,累积百分比释放的趋势表明,低生长因子剂量系统能够在初始爆发释放中以平行增量释放释放更高的相对量药物,从2μg/ ml剂量的30%(GDF5)和15%(BB-1)下降到1000μg/ ml剂量的10%(GDF5)和5%(BB-1)。
Alkhraisat等人于2008年进行的一项用TCP替代6.7,20.0或33.3% Sr制备骨水泥的研究。Sr2+释放的测量值在老化介质中进行来自骨水泥的离子。观察到所有骨水泥的初始爆发释放,范围在38-58 ppm以内,具体取决于Sr2+内容。在后期阶段,曲线的特征是在孵育的第3天暂时减少,然后是持续和恒定的零阶释放,剩余14天Sr2+范围在18至30 ppm 之间。后者可能是二次CP相释放速率较高的结果,其形成受Sr含量的影响。Singh等人在2016年的一项研究中得出了一致的结果,在该研究中为了评估老化介质中Sr2+离子的释放,DPCD水泥前驱体被5和10 mol.%的锶取代。在培养基中测定MC3T3-E1细胞活力期间,测定15天的Sr2+浓度。两种含Sr骨水泥均检测到持续释放,5 mol.% Sr CPC的日释放量约为0.02 mM,10 mol.% Sr CPC的日释放量约为0.05 mM。因此,可以假设两种骨水泥的零阶动力学,释放速率仅取决于替代比。Jayasree等人2016年的另一项研究报道了HAp水泥释放Sr2+的结果。采用具有四种不同浓度的Sr(3,5,8,10mol.)以及无Sr骨水泥的CPC作为离子释放支架。在PBS培养基中进行释放实验,无论初始Sr浓度如何,累积离子释放曲线均具有非常相似的形状。因此,6周后,Sr2+所有骨水泥配方在培养基中的浓度值为3.2-3.5 ppm。即使没有应用适合实验数据,但所有释放模式都以明显的一阶动力学为特征。在2016年的一项研究中,Rau等人研究了在Tris-HCl缓冲溶液中浸泡30天的Ag取代的TCP基骨水泥基质中的Ag离子释放。选择具有两种浓度Ag的基质,即0.6wt%和1.0wt%,用于释放测定。报告的溶解模式显示释放速率与基质中Ag浓度之间存在直接关系,其中1.0 wt%样品的释放速率高于0.6重量%的样品释放速率。具有无爆发效应且具有一阶动力学的受控释放表征了Ag释放。同一作者的另一项工作集中在Zn的溶解速率。比较锌浓度为0.6%和1.2wt%的Zn-CPC,发现Zn浓度最低的骨水泥溶出速率最高(0.6 wt%)。这一结果符合Ito等人的工作,其中Zn从CPC中释放的Zn随着其中Zn含量的增加而降低。显然,Zn杂质的增加导致形成骨水泥的晶格具有更高的热力学稳定性,因此Zn在骨水泥中的较高浓度下会受到阻碍。图6示意性地总结了CPC载体中药物的浓度如何影响药物释放的速率和机制。
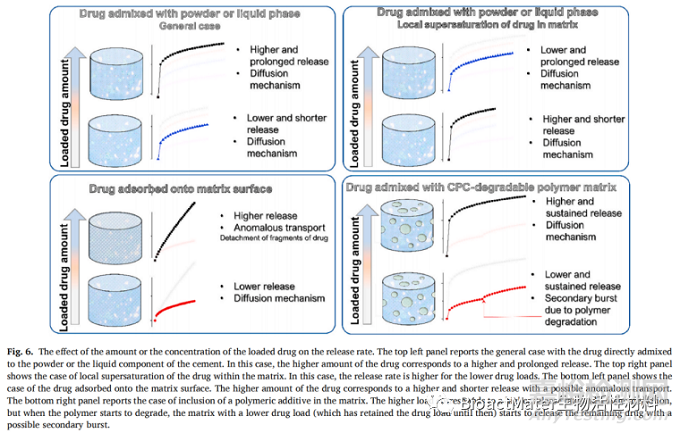
7. 药物负载方法
Habraken等人探索了药物在明胶或PLGA微球内的捕获作用,以提供对药物释放的增强控制。在本研究中,牛血清白蛋白(BSA)作为一种模型药物,以两种不同的方式装载在PLGA微球中:在双乳法制备过程中装载在微球中(BSA(I))或在冷冻干燥过程中吸附在微球上(BSA(I))。微球依次嵌入CPC基质中,形成CPC-BSA(A)和CPC-BSA(I)复合材料。通过将BSA直接添加到CPC中作为对照样品来制备进一步的样品。与药物直接从PLGA微球中溶解相比,CPC-BSA复合材料和CPC-BSA对照均显示出显着降低的释放速率和初始爆发。CPC/PLGA BSA(A)的释放率也低于对照CPC-BSA样本的释放率。对这一趋势的解释可能与pH值的降低有关,这是由于PLGA微球的降解而导致的,从而产生酸性环境。pH值的这种变化可能会影响骨水泥的表面电荷,导致BSA分子与骨水泥表面之间的静电键更强,这阻碍了药物在骨水泥基质内的流动性和扩散性。同一课题组的另一项工作采用类似的程序来评估先前负载到两种不同类型的明胶微球中的不同生长因子(TGF-b1,bFGF和BMP-2)的释放:GEL A(猪)和GEL B(牛)。此外,对于每种明胶类型,使用两种负载方法:1)生长因子的瞬时负载到微球中,以及2)延长负载。一旦得到,将不同的微球与粉末相混合,形成不同的CPC复合材料。GEL A以5和10wt%引入CPC基质中。此外,通过生长因子吸附到浸泡在溶液中的CPC上或在骨水泥混合之前将BMP-2溶解到硬化液中来产生对照样品。释放模式表明,前一个样品的释放量高于将BMP-2预先吸附到CPC表面的后一个样品,其中BMP-2直接掺入基质中。较高的初始爆破和释放速率表明,BMP-2的释放受CPC表面扩散的影响,而来自本体的较慢扩散定义了通过硬化液体引入的BMP-2释放的动力学。另一项实验证实了GEL-A和GEL-B微球内生长因子的瞬时和长时间负载之间的差异。对于生长因子,GEL类型和即时与延长负载时间的所有组合,观察到类似的行为。具体而言,对于BMP-2和TGF-beta,观察到约5-6%的爆发释放,然后是持续和恒定的释放阶段,其轮廓类似于零阶动力学。结合延长负载方法,观察到GEL-A的释放速率较高。bFGF的特点是释放速率较高,有趣的是,当从GEL-B复合材料中释放时,释放模式的形状更类似于一阶动力学。此外,对于后一种情况,与长时间装载方法相比,即时装载方法可确保略高的释放率。最后,对BMP-2进行的全面研究表明,尽管存在某些局限性,但调节明胶的类型和复合材料中的相对wt%可以成为调节生长因子释放速率的手段。
Schnieders等人还研究了PLGA-CPC复合材料及其释放特性。研究了PLGA微球和CPC-微球复合材料的释放,并选择庆大霉素克罗贝酯作为模型药物。明胶微球的药物释放分三个明确定义的阶段进行,包括爆发释放,平台和由PLGA降解和随后的药物释放决定的持续释放。当将载药微球纳入CPC骨水泥中时,释放曲线表明动力学和释放机制发生了巨大变化。爆发释放强烈下降,零阶动力学表征了模式,恒定释放速率持续超过100天。作者提出了微球在骨水泥内的嵌入以及药物分子在基质表面上的部分吸附作为这种行为的可能解释。进一步研究了这些系统,将盐酸万古霉素包封在PLGA微球中,并依次掺入CPCs内部,形成用于控制药物释放的复合体系。本研究制备了不同P/L比下的各种CPC基质,以获得不同的孔隙率并评估其影响。报告了常规骨水泥与通过将含有万古霉素的PLGA微球添加到液相中制备的骨水泥之间的比较。本综述前面已经讨论了损益比和孔隙率的影响。在这里可以强调的是,对于通过直接将药物添加到液相中制备的骨水泥,释放速率和动力学严格取决于P/L参数,因此取决于孔隙率。对于含有装载药物的PLGA微球的骨水泥,这一结论不再有效,这表明释放的动力学决定阶段是药物从微球而不是基质孔扩散。Otsuka课题组在他们的一项工作中也提出了将药物封装在PLGA微球内的负载方法。将辛伐他汀(SIM)负载到PLGA微球(SPLGAM)中并依次包埋在碳酸羟基磷灰石(CHAp)骨水泥中,得到SPLCAM/CHAp复合材料。通过将SIM加入骨水泥浆(SIM/CHAp)来制备对照样品。SIM 的释放曲线是从三个不同的系统获得的:SPLGAM、SIM/CHAp 和 SPLGAMs/CHAp。释放速率遵循以下顺序:SIM/CHAp > SPLGAM > SPLPGAM/CHAp。所有配方都表现出接近零阶的动力学。采用四种配合模型来阐明释放机制:零阶和一阶,通口和Korsmeyer-Peppas。通过对拟合的分析,可以推断出SPLCAM和SPLGAM/CHAp系统的特点是由PLGA的降解和松弛控制的Case-II传输机制,而SIM/CHAp的释放则由CHAp表面的初始SIM扩散和从CHAp核心到CHAp表面的连续扩散来控制。此外,零阶模型描述了SPLGAM/CHAp动力学以及Korsmeyer-Peppas模型。
Fullana等人中提出了一种从CPC(CP-LMAP)中含有果胶微球(LMAP)的复合材料中控制释放IBU的系统。考虑用不同量的LMAP(0%,2%,4%,6%w/w)制备的复合材料。通过直接在骨水泥内掺入药物(CP/IBU)制备了参考样品。比较了2%、4%和6%CP-LMAP复合材料的释放曲线,并使用通口模型进行了拟合分析。所有复合材料均采用非Fickian扩散机理表征,释放速率与果胶微球的量成反比:CP/IBU–LMAP2% > CP/IBU–LMAP4% > CP/IBU–LMAP6%。作者提出了两种可能的解释:第一种是大量药物局部过饱和的可能性,这可能会减慢溶解过程。第二种,在一些文献证据的支持下,断言释放速率应与骨水泥复合材料中存在的多糖量成比例地降低,因为后者能够形成凝胶,可以填充基质的孔隙,从而阻断药物扩散。
Dolci等人提出了喷雾凝结固体脂质微粒作为从CPC基质中释放阿仑膦酸盐的负载方法。将阿仑膦酸盐封装在用五种不同的脂质赋形剂制备的各种微球中。通过凝固时间和抗压强度实验的结果,在测试的五种赋形剂中只选择了两种合适的赋形剂:角质和孕甾醇。使用这两种赋形剂制备的CPC-微球复合材料进行阿仑膦酸盐的释放。这两种体系的释放速率,并与在释放培养基中孵育的微球中阿仑膦酸盐的释放曲线进行了比较。药物在脂质微球中的包封大大减少了爆破溶解,并产生了以非Fickian扩散长达21天为特征的延长和持续释放。与角质微球相比,用预乳微球制成的复合材料显示出适度较高的释放率。在该组的另一项工作中,不同量的角质层和预沸石微球被嵌入骨水泥内。释放测试的结果允许得出结论,两个系统都适合持续释放长达21天,并且在任何爆发阶段都没有。此外,释放速率可以很容易地通过复合材料内负载的微球量来调节。Vorndran等人在2013年的一篇论文中报道了负载了单组分或双组分方法的系统的药物释放。在这项工作中,庆大霉素和万古霉素被装入由CP粉末和分散在油基悬浮液中的K2PO4混合而成的水泥中。加入药物的方法是:1)将固体抗生素与水泥浆混合,或2)将抗生素溶解在水泥浆中。所有制剂的特征是在整个60天内持续释放。Korsmeyer-Peppas分析表明,单组分骨水泥负载导致由扩散过程控制的释放,n值范围在0.20-0.39之间,而双组分骨水泥显示出异常传递,这意味着扩散和降解过程(n = 0.53-0.63)。据推测,单组分释放机理与加入骨水泥浆中的固体药物的溶解有关,而双组分骨水泥则经历了含有该药物的水性液体的分散,从而促进了异常的运输机制。在Alkhraisat等人2010年的一项工作中,分析了从Sr取代的CPC中解吸DOXY多西环素。DOXY多西环素按照两种方法负载到骨水泥中:1)通过将骨水泥在含抗生素的溶液中孵育来吸附,或2)通过使用抗生素溶液作为骨水泥的液相。正如预期的那样,在从溶液中吸附药物的骨水泥中,大部分药物位于表面上,并且在解吸后的几个小时内发生了药物的快速且几乎完全释放。相反,使用DOXY多西环素溶液固化的水泥具有较低的爆裂释放和较长的连续释放时间。采用幂律模型对释放机理进行了评价。作者只讨论了n值,而k参数的比较(20-43的吸附DOXY多西环素和9-20的固定溶液中的DOXY多西环素没有被提及,尽管它与实验数据一致,确认第二种加载方法中药物从大量水泥中溶解的阻碍更大。Lucas-Aparicio等人最近的一项工作采用了类似的概念,其中万古霉素通过以下两种方式负载到Si-CPC中:1)从含药物溶液中吸附药物或2)在骨水泥制备阶段以固态负载药物。由于这项工作试图评估多种因素对药物释放的影响,包括骨水泥基质中的Si含量,药物浓度和负载方法,因此必须假设在如此详尽的实验设计的框架内,很难一次分离出一个变量引起的效应。特别是,负载方法的效果似乎与药物浓度(或量)严格相关。在药物剂量低的情况下,通过吸附负载的骨水泥显示出释放曲线,具有较小的爆发效应和更受控的药物释放。然而,与以固态添加药物的骨水泥相比,释放的药物的总量要低得多。对于含有高剂量药物的骨水泥,观察到相反的行为。在这种情况下,直接添加固体药物的骨水泥的特征在于更高的爆发释放和药物的快速消耗。使用Korsmeyer-Peppas模型来拟合释放数据,对于低药物剂量,k值相对于负载方法显着变化,而n值没有显着变化。相反,对于高药物剂量,n值存在显着变化,k值的变化更为温和。图7示意性地描述了药物负载方法可以影响药物释放速率和机制的方式。
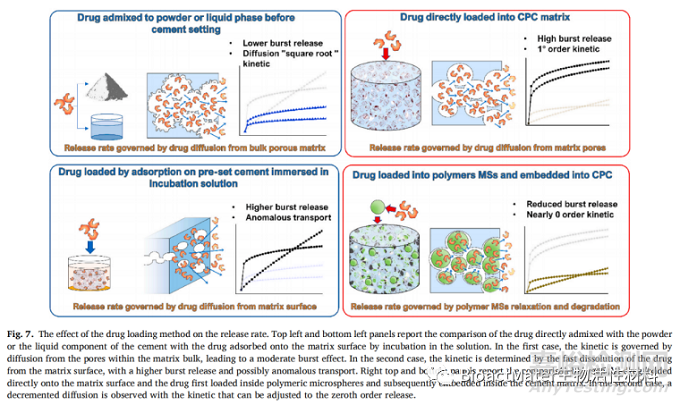
8. 释放介质
释放介质对药物动力学特征的重要性往往被低估,但就像在"剪刀石头布"游戏中一样,它与基质和药物因子严格相关,因此在定义药物释放行为方面起着同样关键的作用。不同的作者在他们的工作中研究了释放动力学与释放介质特征之间的相关性,从其化学成分到极性再到pH值等。Hamanishi等人报道了TTCP-DCPD骨水泥作为PLGA的载体,并试图解决多种因素对动力学特性的影响。其中,他们研究了在PBS和SBF两种不同的释放介质中,药物释放的差异,结晶不良的磷灰石骨水泥,为期超过7天。观察到,在前3天SBF的释放速度更快,但在第3天后PBS中的释放速率变高,并且这种情况在实验的剩余时间内保持不变。作者假设在SBF中孵育3天后,CP在骨水泥表面发生再沉淀,减小了骨水泥基质中孔隙的尺寸,从而阻碍了药物扩散。在1999年的一项研究中Khairoun等制备了一种结合玻璃释放体系的CPC,并观察到其对Na+和Ca2+离子的控释。将CPC-玻璃样品浸入两种不同的培养基中并孵育约5周:0.9%NaCl溶液和0.5%CaCl2溶液。通过XRD进行的相组成调查表明,在这两种情况下,透钙磷石都是在孵育过程结束时形成的,但在CaCl老化的情况下,其存在率较高。这说明除了从玻璃中释放Ca2+离子外,同样的离子从溶液中析出,但没有改变释放速率(在这两种情况下,5周后透钙磷石相都可以很好地检测到)。在Tamimi等人2008年的一项工作中,DOXY被选为使用透钙磷石骨水泥作为载体的缓释研究。对于该实验,将含有DOXY的透钙磷石骨水泥在PBS溶液中孵育超过200h。DOXY是一种抗生素,已知在酸性环境中高度可溶,因此作者测试了溶液pH对释放模式的影响。安排该研究以确保潜伏期的开始与配制过程的开始相吻合。在透钙磷石凝固反应的第一阶段,pH值保持在较低值,诱导DOXY的爆发释放。然而,随着定型反应的进行,pH值增加并稳定在7.4,从而减慢了释放速度。累积释放曲线产生典型的扩散控制曲线,在前100h内DOXY的总释放量约为75%。为了测试释放介质的pH值对仍然嵌入骨水泥基质中的剩余25%的药物的影响,将溶液的pH值调节至5.9。在这个新的条件下,观察释放过程的重新激活,直到药物完全耗尽,遵循与之前相同的释放机制,不修改模式形状。
Otsuka课题组进行了几次实验,以深入了解影响CPC基质中不同物质释放的条件。具体来说,他们研究释放介质影响的配制受到破骨细胞和成骨细胞产生的pH条件的启发。这两种条件分别由pH 4.5和pH 7.8的SBF缓冲液再现。在他们所有的论文中,研究了不同的系统:磷灰石/胶原骨水泥释放的维生素K2,磷灰石骨水泥中的辛瓦斯汀溶解,以及可注射磷灰石骨水泥释放的DNA复合物。所有这些研究都有相同的方法来测定释放介质对药物溶解的影响。此外,所有这些实验都取得了连贯的结果,其中在模仿破骨症的醋酸性缓冲液的酸性环境中释放的药物剂量高于在模仿成骨细胞状态的SBF的碱性环境中释放的药物。这种行为归因于SBF溶液允许CP沉淀在骨水泥表面的能力,从而阻塞表面孔隙并阻碍从基质表面到溶液的药物转移。
Shi等人在2018年的一项特殊工作报道了通过使用低强度脉冲超声(LIPUS)影响庆大霉素从CPC释放而获得的结果。在这里,作者探索了与流体动力学更相关的条件,而不是与释放介质本身的化学特性相关的条件。尽管使用和不使用LIPUS获得的释放模式之间存在相似性,但在LIPUS制度下观察到药物的释放率较高。作者提出了两种可能的解释:1)由于释放介质中高压和低压的交替而形成微流,这诱导了空化,2)由超声波驱动的温度可能局部升高。在2006年的一篇论文中,Ruhè等人描述了用白蛋白预处理的CPC释放rhBMP-2生长因子。使用PBS或胎儿小腿血清(FCS)溶液作为培养基对rhBMP-2释放进行比较。发现PBS中生长因子的体外保留率高于FCS,但除了释放的总剂量外,两个系统都具有扩散控制方案的典型相似行为。虽然很难为这种效应提供明确的解释,但作者谨慎地建议,当使用丰富的蛋白质缓冲液作为培养基时,所含的蛋白质可以与rhBMP-2竞争形成钙复合物,这可以改善rhBMP-2从基质表面的溶解。文献中没有报道探索细胞培养对释放动力学的影响的研究,并且不确定与细胞的相互作用是否会减慢或加速释放,以及效果是否取决于细胞的性质(成纤维细胞,成骨细胞,破骨细胞等)。图8示意性地总结了释放介质控制药物释放速率和机制的不同效应。
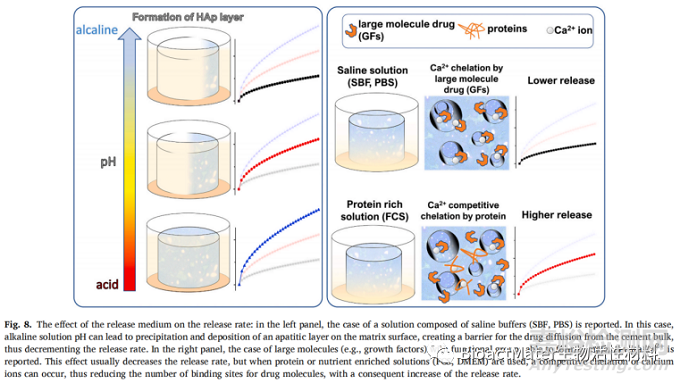
9. 体内释放
Ruhè等人在体内条件下评估了经白蛋白预处理的多孔CPC负载rhBMP-2的释放情况。在大鼠模型中,通过放射标记支架的闪烁成像,通过体内和体外伽马计数来评估实验释放曲线。报道了将rhBMP-2作为皮下贮存物注射的保留图,以及将生长因子装入多孔CPC椎间盘(有或没有白蛋白预处理)植入大鼠背部皮下的保留图。CPC盘释放rhBMP-2的体内动力学在大鼠异位模型中表现出单相指数趋势,其特征在于28 d后保留20-30%。未处理的骨水泥和白蛋白预处理的骨水泥之间的释放存在差异,其最终保留率分别为16±10%和31±5%。然而,作者并不认为这种差异是显着的,因为假设rhBMP-2的生命周期持续时间不超过四周,并且预计在更长的时间内不会有生物活性。在Stallmann等人2008年的一项研究中,报道了CPC载体释放人乳铁蛋白1-11(hLF1-11)。将具有50mg/g hLF1-11负载的CPC注射到12只兔子的股管中。在第1天,第3天和第7天,终止了四只兔子,并通过液相色谱和质谱法手术切除股骨进行组织学分析和hLF1-11浓度的半定量测定。hLF1-11的初始爆发释放之后是释放量的恒定减少。在第7天观察到较晚的轻微释放。在第7天试件的组织学分析中观察到的水泥裂缝的形成和降解可以解释这种释放行为。
在de la Riva等人的一项研究中,进行了体外和体内释放的比较实验,以定义这两种药物递送方式之间的差异。VEGF和PDGF生长因子被纳入组合的透钙磷石-壳聚糖递送系统中。在体内释放评估首先注射水泥,之前在家兔股骨内用60Co源放射25 kGy剂量的γ,然后将动物分成不同的组,并从取出的股骨中取出植入物。PDGF和VEGF定量是通过对提取的植入物进行放射性测量获得的。体内累积释放模式显示出一阶动力学,表明对于两种生长因子都涉及扩散机制。两种生长因子的总释放量在65-75%之间。然而,虽然VEGF需要28天才能达到最大总释放量,但PDGF仅用了14天。对植入物不同区域的生长因子浓度作为时间函数的调查显示,植入物区域的PDGF在第3天发生最大日释放,VEGF在第7天发生最大日释放。在这些时间点之后,观察到浓度降低,表明生长因子扩散到周围的骨骼中。
Delgado等人在2012年的另一项研究中采用了类似的方法制备了可生物降解的CPC/聚合物复合材料,作为PDGF的局部体内递送系统。用125I-PDGF植入兔股骨后,监测体内PDGF的释放和组织分布。125I-PDGF累积释放谱为持续释放10天以上,初始爆发量约为PDGF初始剂量的40%,总体释放谱为近一级动力学。PDGF水平在缺陷部位较高,并且在大约5天内几乎保持不变。从第6天开始,其余观察期内125I-PDGF浓度开始下降,周围组织中生长因子水平下降(在骨干远端组织中约1ng /g)。
Liu等人还提出了壳聚糖/CPC复合物作为体内条件的载体体系。制备HAp/CS支架以评估抗菌溶菌素酶的体内释放。将载药支架皮下植入大鼠体内,使用Qdot 625 ITK羧基量子点作为荧光标记物测量溶菌素的体内释放。通过成像系统记录荧光信号21天。对照组注射溶葡萄球菌,不注射复合支架。Qdot标记溶葡萄球菌素的释放速度非常快,在注射后24小时内持续释放。相反,对于植入支架的药物组Qdot标记的溶葡萄球菌释放时间更长,达到21天。
在Uchida等人2018年的一项工作中,提出了一个有趣的比较系统之间的万古霉素局部递送。比较的支架系统由CPC或PMMA组成,两种支架均植入Winstar大鼠股骨区。在第1、7、28和56天从取出的试验标本中提取残留的万古霉素,以确定释放到大鼠组织中的抗生素量。体内释放曲线显示,与PMMA支架相比,基于CPC的支架释放万古霉素的释放显着更高,并且从该支架释放的持续时间也更长。更重要的是,到第56天,CPC支架仍然能够释放100μg万古霉素,而PMMA没有释放可检测到的数量。考虑到万古霉素的最低抑制浓度为每克组织1.56 μg,后一证据尤其相关。
可以从体外和体内研究的比较中得出一些一般考虑因素。最重要的是体外模型不足以准确表示体内条件的复杂性。表征体内环境的复杂条件以不同的方式影响药物释放速率和机制。大多数体外实验的特点是近乎稳态或受控的进化条件。在体外实验期间,释放培养基通常保持静止或搅拌,并以既定的间隔刷新。尽管人们普遍认为这可以用来模拟生理条件,但这种方法通常不足以重现活体动物模型中的真实流体动力学过程。润湿性的差异,基质内的生物流体灌注和用新鲜生理液连续替换可以加速或延缓释放过程。虽然静止介质中的释放通常会产生饱和效应,从而阻碍释放速率,但这种效应在体内条件下以大量流体流动为代表。此外,即使是环境条件中最温和的变化也足以促使CPC基质的降解更快或更慢,从而导致药物释放动力学和机制的变化。为了加强对这些环境因素的控制,并随着时间的推移正确预测组织内的药物水平,采用了不同的策略,符合释放药物的类型和植入部位的特征条件。它们包括将基质孔隙率调整到合适的水平,将药物封装在聚合物微球内以及用各种添加剂预处理基质。最后,生理流体可以与基质药物系统发生化学相互作用并干扰凝固过程,从而缩短或延长凝固时间,从而影响释放曲线。生物流体与药物释放系统的化学相互作用还包括血浆的生物成分(主要是蛋白质)对CPC基质结合位点的亲和力。在这些情况下,外源性药物和内源性蛋白质可以竞争基质活性位点的占据,这通常导致药物释放增强。与细胞的相互作用会对药物释放产生各种影响,从与纤维组织的假想吞噬情况下的阻碍释放,到被破骨细胞或其他专门用于CP基质降解和颗粒摄取的巨噬细胞吞噬情况下的加速释放。
10. 结论
伴随着骨再生领域的发展不断产生了创新的方法,包括能够改善再生成骨过程的新配方和材料组合的使用。在这个框架中,CPC药物释放系统作为骨组织工程范式的一部分发挥着关键作用,作为基质支架,具有与天然骨骼高度相似的机械,化学和微观结构特征。除了这种基本的一致性外,还需要载体和释放成骨过程所需的分子以及预防炎症状态和/或感染的能力。为特定应用而量身定制的功能药物释放需要充分了解这些系统的动力学和机制特性。此外,还需要描述这些系统的各个参数如何影响释放曲线的模型,特别是因为CPC药物是复杂的系统,其中不同的因素可以单独和/或协同影响释放模式。大多数时候,这些因素产生难以区分的纠缠效应,例如本工作中考虑的因素-协同作用。尽管如此,在这项工作中我们已经设法辨别出控制CPC中药物释放的最基本因素,并且文本也相应地进行了结构化。
载体基质是这些释放系统中最基本和最复杂的部分,其化学性质,降解倾向和微观结构特征代表了控制药物释放曲线的最重要特征。总体而言,骨水泥的凝固和硬化会影响脱模速率。通常,主要由无定形相组成的新鲜骨水泥具有较高的释放速率,受异常传递和可变行为的影响,其中具有明确定义微观结构的固结骨水泥显示出更稳定的释放模式,其释放曲线受扩散机制的影响。可降解的基质允许实现更高的释放率,因为药物与分离的基质碎片一起被释放。因此,可溶性更强的透钙磷石形式的骨水泥凝固往往比可溶性较低的HAp形式的骨水泥凝固更快地释放其药物,尽管其他因素可能会逆转这一趋势。稳定或缓慢降解的基质进一步显示出由骨水泥微观结构在动力学和机械上控制的释放模式。结晶度、晶粒尺寸、晶界性质、晶粒缠结,还有孔隙度、孔隙几何形状、曲折性、相互连通性和分布,以及比表面积强烈影响药物释放速率。孔隙率可以通过使用不同的方法来调整,例如作用于P/L比率或通过使用适当的孔源或表面活性剂。增强基质孔隙度的另一种方法涉及使用可生物降解的聚合物,其溶解预计将在CPC基质内留下空腔,从而为药物的更迅速释放开辟通道。使用这种方法并不总是导致释放速率的增加,因为在溶解之前,与释放介质接触的聚合物可能会膨胀并形成填充开放孔隙的凝胶,这将减慢药物的释放。当这一过程发生时,释放速率首先取决于聚合物凝胶的溶解和松弛,然后才取决于药物从基质本体的扩散,从而导致释放普遍受到阻碍。
在CPC基质中使用添加剂可以通过产生pH,表面电荷,化学亲和力或其他参数的局部变化来影响药物对基质内表面的亲和力。根据引入添加剂的种类和数量,其中一些含有壳聚糖,PLGA或碳纳米管,药物/CPC结合强度可以增加或减少,导致释放速率的相应变化。此外,当引入的添加剂由可生物降解的聚合物组成时,由于自催化聚合物降解,可以检测到二次爆发,导致与纯CPC的释放曲线的偏差。药物的化学性质进一步对释放速率有直接影响。一般来说,药物在释放介质中的较高溶解度有利于释放,而如前所述,药物对基质表面的高亲和力可能会降低释放效率。该药物还可以干扰配制和硬化过程,通常通过隔离游离离子并与成核新相的表面位点竞争来减慢它们的速度。CP以其部分无定形,可模塑的形式保留允许药物更快地溶解并增强爆发效应。药物的过大分子尺寸会阻碍多孔基质通过空间位阻效应的扩散,导致溶解速率降低。此外,当比较以相同量装载到CPC载体中的相同药物的释放时,如果药物装载方法不同,则可以获得不同的结果。当药物直接与粉末或液体组分混合时,释放由基质体积的扩散控制。在这种情况下,较高量的药物导致更高和更长的释放。在通过预孵育将药物吸附到基质表面上的情况下,释放在机械上是异常的并且随着负载的药物量而增加,尽管负载的分子消耗更快。最后,药物可以负载到可生物降解的聚合物微球内,这些微球随后被嵌入骨水泥基质中。在这种情况下,释放动力学由聚合物的弛豫和微球的药物扩散来定义。当聚合物微球完全溶解时,CPC基质内会留下一系列空腔,从而形成一个新的相互连接的孔网,从而具有更快的动力学和释放机制,由药物从孔中扩散来控制。在这种情况下,通常会检测到二次突发和/或偏离纯CPC的释放特征。最后,释放介质也会影响释放机理和动力学。盐水缓冲溶液,如PBS或SBF,可以促进磷灰石沉淀和沉积在骨水泥表面,从而成为药物从散装扩散的屏障,从而降低释放速率。当药物能够与钙离子形成复合物时,较慢的速率表征释放曲线。然而,诸如FCS或DMEM之类的释放介质含有能够螯合钙离子的蛋白质和营养素,在这种情况下,可以发生竞争性络合,扣除药物可用的螯合位点并增强其释放。
本文的主要目的是首先识别控制药物释放动力学的关键物理化学因素,然后建立一个框架,以有效利用其合理设计具有精确的释放曲线的生物活性骨缺损填冲剂。通过严格的文献综述,我们已经成功地描述了一些影响释放动力学和机制的因素。定性框架的使用以及各种因素不可避免地纠缠成复杂的协同依赖关系,限制了这一广泛情况的实际应用,但它们绝不会使它无效。明确的原则已经出现,可以用于设计具有可调释放特性的CPC,尽管这需要在基本材料结构和性能设计方面的技能。提出这些基本原则将使这次综述进入更一般的领域,而这些领域超出了其范围。然而,结合本研究中提出的原则,在超细尺度材料结构的合理设计方面即将取得的进展。这将证明在确保CPCs作为最理想的小缺陷、低负重骨替代品之一的继续主导地位方面是有价值的。

来源:BioactMater生物活性材料


