您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-25 23:01
摘要
同常规口服制剂相比,咀嚼片具有许多优点,尤其适用于老人和儿童等吞咽困难的人群。然而,咀嚼片的质量评价体系尚不完善。咀嚼片通常需在口腔中充分咀嚼后进入胃肠道,其润湿、崩解、溶出等过程与普通片剂有所不同。因此,普通片剂的质量评价方法往往不适用于咀嚼片。本文参考美国FDA 于2018 年发布的咀嚼片质量评价指南,讨论咀嚼片相比于普通片剂的特殊性,并从硬度、溶出度、口感评价三方面对国内外咀嚼片的质量评价研究进行综述,以期为咀嚼片的开发提供参考。
正文
咀嚼片系指于口腔中咀嚼后吞服的片剂[1],常加入蔗糖、甘露醇、山梨醇、薄荷、食用香料等辅料以调整口味[2]。在临床上,咀嚼片因其独特的优势而应用广泛。相比于普通片剂或胶囊,咀嚼片服用方便,无需用水送服,可以随时随地服用,同时咀嚼后可促进药物在体内的溶解和吸收; 相比于口服液体制剂,咀嚼片剂量准确,稳定性好,便于生产运输[3]。咀嚼片尤其适用于老人、儿童等吞咽困难的人群,其良好的口感能大大提高儿童的顺应性,体现了以患者为中心的药品设计理念。
随着咀嚼片临床用药价值的提升以及掩味技术的快速发展,越来越多的药物被研制成咀嚼片,如预防和治疗儿童哮喘的孟鲁斯特纳咀嚼片、抗微生物药头孢克洛咀嚼片、治疗高磷血症的碳酸镧咀嚼片等。除了传统意义上的咀嚼片外,可实现个性化给药的3D 打印咀嚼片以及具有更高适口性的软咀嚼片、咀嚼胶剂和咀嚼分散片也被相继开发。目前,我国咀嚼片的质量评价仍沿用普通片剂的相关指导原则,针对其特殊性的质量评价工作尚处于空白。由于咀嚼片需在口腔中充分咀嚼后进入胃肠道,其润湿、崩解、溶出等过程与普通片剂不同,因此,《中华人民共和国药典》中对普通片剂的硬度、崩解时限、溶出度等检查法不完全适用于咀嚼片; 此外,咀嚼片的口感评价至关重要,真正适用于咀嚼片的质量标准和指导原则亟须建立和完善。
2018 年,美国FDA 发布了一份咀嚼片质量评价的指南( 以下简称FDA 指南) [4],指出了过去批准的很多咀嚼片在质量控制方面存在资料不完整、质量指标数据仍处于很宽泛的范围而未达到接受标准等问题。FDA 鼓励目前已批准的咀嚼片或非申请的咀嚼片的生产商重新评价其关键质量属性,并确保适当的质量标准。FDA 指南列举了人用咀嚼片的关键质量属性,并对咀嚼片的研发、生产、标签信息等提出建议,对我国的咀嚼片质量控制具有一定的借鉴意义。本文参考该指南,对咀嚼片相比于普通片剂的特殊性进行了讨论,从硬度、溶出度、口感评价、崩解时限、命名和标识等方面对国内外咀嚼片的质量评价研究展开综述。而对于重量差异、含量均匀度、微生物限度等与常规片剂相同的检查项目,本文不做赘述。
1、硬度
《中华人民共和国药典》2020 年版[1]对咀嚼片硬度的要求为“咀嚼片的硬度应适宜”,该质量指标太过宽泛。理想的咀嚼片应同时具有适宜的硬度下限和硬度上限。硬度下限要求能为片剂提供一定的抗压能力,以顺利进行生产、包装和运输,通常可参考普通片剂的硬度要求,即硬度在50 N 以上,抗张强度在1. 5 ~ 3. 0 MPa 为好[2]。咀嚼片的硬度上限应确保片剂具有合适的咀嚼性,以免在咀嚼过程中对牙齿、下颌造成损伤,其测试方法应尽可能地模拟实际咀嚼过程,如唾液润湿、模拟牙齿咀嚼等[5]。FDA 建议[4],咀嚼片应具有较低的硬度值( 如< 118 N) 。如果咀嚼片在短时( 约30 s) 暴露于唾液中显著崩解和/或硬度降低,可以考虑较高的硬度值( > 118 N) 。在其他情况下,申请者应对所提出的硬度提供理由。
1.1、测定方法
普通片剂硬度通常指片剂的径向破碎力( Fh ) ,单位为kN,抗张强度通常指单位面积的径向破碎力( σh ) ,单位为kPa 或MPa[6],两者关系见公式( 1) 。

其中D 为片剂直径,H 为片剂厚度,测量方式见图1A。
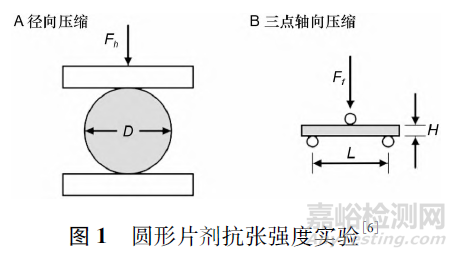
然而,在实际咀嚼过程中,咀嚼片所受到的力往往是轴向破碎力( 见图1B) ,且对于同一片剂而言,轴向破碎力往往大于径向破碎力,以公式( 2) 计算的三点轴向抗张强度( σf ) 更适合衡量咀嚼性。直径在16 ~ 19 mm 的圆形片剂,抗张强度上限为2 MPa[6]。

其中Ff 为轴向破碎力,D 为片剂直径,H 为片剂厚度,L 为2 个下支座之间的定距,通常建议L =2 /3D。
1.2、咀嚼难度指数( chewing difficulty index,CDI)
轴向破碎力和径向破碎力之间存在相关关系,这使得咀嚼片的实际生产过程能够通过径向破碎力进行监测[5]。Gupta 等[7]对此进行了进一步推导:

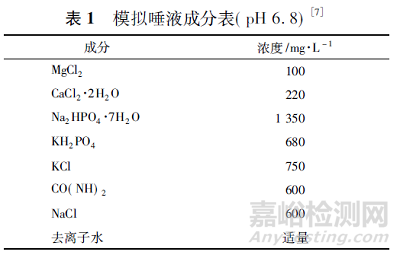
CDI 即为圆形片剂的径向破碎力与片剂厚度的乘积,FDA 指南中采用了CDI 来衡量咀嚼片的咀嚼性能[4]。申请者除了评估咀嚼片的硬度外,还应考虑评估咀嚼片暴露于人的唾液前后的咀嚼难度指数[7],模拟唾液的组成成分,见表1。
1.3、测定装置
片剂硬度测定装置通常为硬度计或硬度测定仪,所测得的数值为片剂受到1 次压缩的最大峰力值[8]。然而这些方法无法考察片剂的内聚性和弹性,质构仪能够准确描述片剂受力后力、位移、时间的变化过程[9 - 10],更适合于咀嚼片,尤其是软咀嚼片的硬度测定[11]。质构仪有多种模式可供选择,例如,全质构分析法( texture profile analysis, TPA) 能够通过模拟2 次咀嚼过程得到与人的感官评价相关的质构特性参数,见图2[10]。
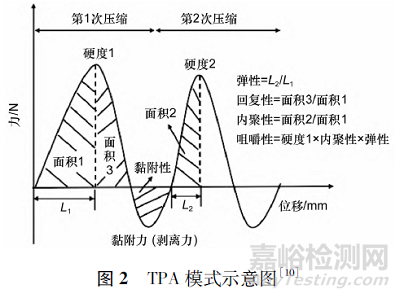
应用TPA 模式能够测定咀嚼片的硬度、内聚性、弹性、咀嚼性以及黏性等参数[12],其中,咀嚼性即为该模式下硬度、内聚性和弹性的乘积。在质构仪探头往复运动的同时增加水平方向上的滑动,可使咀嚼片的硬度测定更加接近实际咬合过程[5]。
2、溶出度
理想的咀嚼片应能在规定时间内充分溶出以发挥疗效,其体外溶出试验应当遵循速释片的溶出试验原则[4]。由于一些患者可能会不经咀嚼而整个吞服咀嚼片,故应对完整的咀嚼片进行溶出度考察,保证其活性成分在咀嚼或未咀嚼情况下都能充分溶出。
2.1、溶出度检查方法
截至2021 年9 月1 日,FDA 溶出曲线数据库[13]共收录了29 个咀嚼片品种的溶出方法( 见表2) ,可以分为以下3 种: 篮法、桨法和往复筒法,其中,篮法和桨法也为普通片剂常用的溶出方法,往复筒法为《中华人民共和国药典》2020 年版新增方法,主要用于缓释制剂和咀嚼片的溶出度检查。
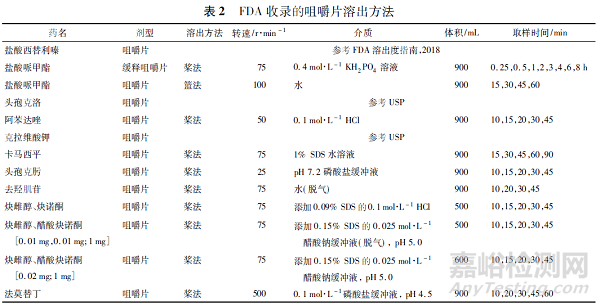
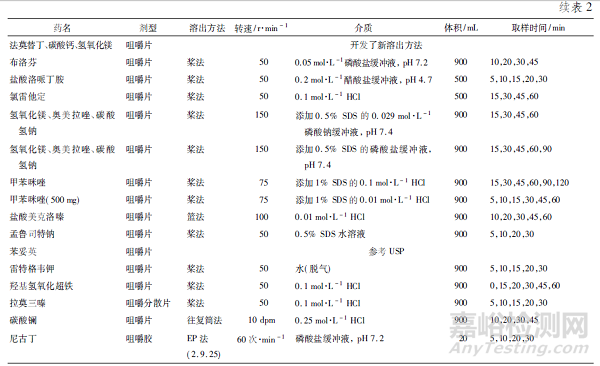
本文对3 种咀嚼片的溶出度检查法进行了比较,其优缺点见表3。
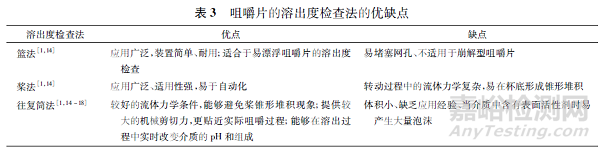
2.2、溶出条件改进
咀嚼片在咀嚼过程中破碎,其比表面积改变,同时可能有部分药物在口腔中释放,应尽可能选择生物相关的溶出条件,如增加机械剪切力、增加模拟咀嚼过程和采用生理条件相关的溶出介质[19 - 20]。
2.2.1、增加机械剪切力 增加机械剪切力
国际药学联合会/美国药学科学家协会在《新型和特殊剂型的溶出/体外释放实验指导原则》[21]中提到,添加珠球的往复筒法可以为咀嚼片的体外溶出度测试提供更强烈的搅拌。Shruthi 等[22]采用添加玻璃珠的篮法对非崩解型的孟鲁司特钠咀嚼片进行溶出度检查,其累积溶出度( 89.0%) 高于未添加玻璃珠的篮法( 80.5%) ,说明玻璃珠的加入能够在一定程度上提升搅拌效果。同时,珠球的密度往往是影响溶出的关键参数,采用与溶出介质密度接近的珠球,能够避免因珠球在溶出过程中沉降至容器底部导致的搅拌增效不显著,从而提高机械剪切力,使溶出方法具有更高的区分力[23]。
2.2.2、模拟咀嚼过程
质构仪能够模拟口腔的咬合和研磨动作,将其与含量测定装置、搅拌装置组成的溶出度实时测定系统具有较强的区分力[24]。对于含有水不溶性或非崩解型基质的软咀嚼剂或咀嚼胶剂而言,制剂需要经过多次连续地咀嚼,药物在口腔中的释放量相较于常规咀嚼片更大[25 - 26],且释放行为受剪切力、温度、润湿和渗透情况影响较大。《欧洲药典》( 2.9.25) [27]介绍了2 种咀嚼胶剂的溶出度试验装置,装置A 和装置B 见图3。
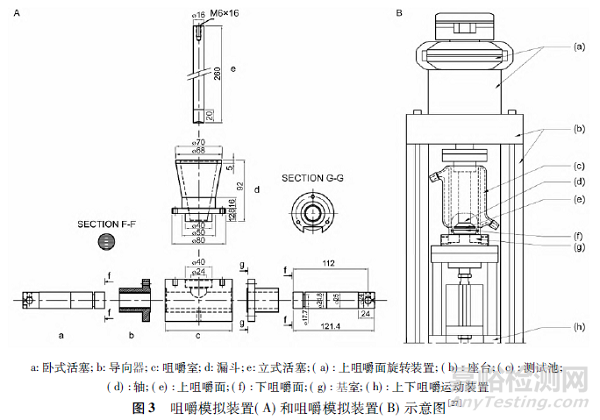
有研究发现[28],同一咀嚼胶剂在2 种装置中的溶出行为并不相同,由于装置B 提供了额外的扭转运动,使其能够提供比装置A 更大的释药速率,且具有更强的区分力。
2.2.3、生理条件相关的溶出介质
FDA 指南指出,在开发过程中,体外溶出试验应当使用完整片剂在至少4 种介质中进行,如水、pH 1.2 水溶液、pH4.5 缓冲液和pH 6.8 缓冲液等[4]。另外,咀嚼片还需使用模拟空腹和餐后胃肠生理环境的溶出介质进行评价,可以更好地帮助理解咀嚼片在体内的变化。目前使用较为广泛的生理相关溶出介质有: 模拟空腹状态下胃液的介质( FaSSGF) 、模拟进食状态下胃液的介质( FeSSGF) 、模拟空腹状态下肠液的介质( FaSSIF-V2 和FaSSIF) 以及模拟进食状态下肠液的介质( FeSSIF-V2 和FeSSIF) 等[29 - 31],其组成见表4。
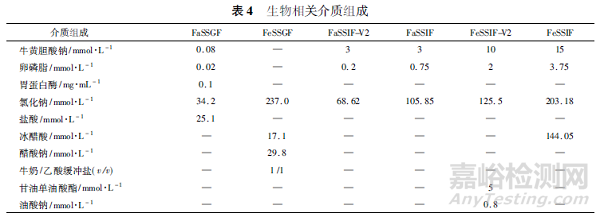
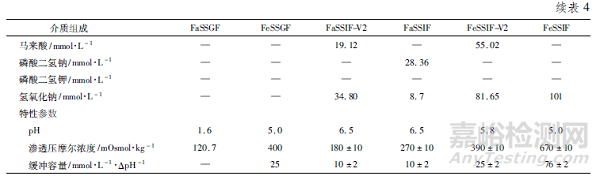
Martir 等[32]对孟鲁司特钠咀嚼片进行了生物相关的体外溶出度研究:先将咀嚼片置于100 mL 的FaSSGF中,采用桨法以50 r·min - 1转速持续1 h,然后分别转移至200 mL 的FaSSIF-V2 和200 mL 的FeSSIF 中继续转动3 h,于不同时刻取样检测。结果表明,孟鲁司特钠在FeSSIF 中的溶出度显著高于FaSSIF-V2中的溶出度,这可能是脂溶性的孟鲁司特钠在进食后的肠液中溶解度增加所致,该溶出方法相比于常规溶出度检查法具有更高的体内外相关性。
3、口感评价
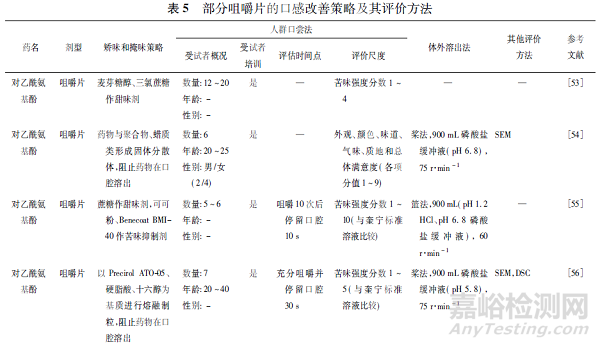
据报道,90.8%的急性儿科患者和83.9%的慢性儿科患者服药的主要障碍是药物的不良口味[33]。咀嚼片的主要目标受众是儿童,咀嚼后吞服的服用方式更加要求其具备良好的口感。因此,口感是咀嚼片非常重要的一项质量评价指标[34 - 35]。咀嚼片的口感评价是对咀嚼片味道、适口性、余味等的综合评价,通常针对不同口感改善策略,选择相应的评价方法或将多种评价方法联合使用[36],部分咀嚼片的口感改善策略及其评价方法的总结见表5。



3.1、人群口尝法
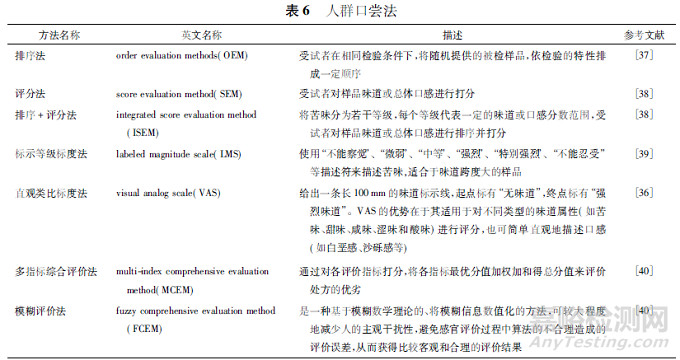
人群口尝法是目前使用最广泛,也是最直接、最能真实反映药物口感的体内分析方法,但也存在主观性强、操作繁琐、重现性差等缺点,通过应用合理的统计学分析方法,能够一定程度上提高人群口尝法的可靠性,但当药物处于早期研发阶段时,存在潜在的毒性风险[36]。目前,人群口尝法主要有排序法、评分法、评分+排序法、标示等级标度法、直观类比标度法、多指标综合评价法、模糊评价法等,详见表6。
3.2、动物尝味
动物尝味法是通过观察大鼠、小鼠、猫、犬等动物对味觉厌恶的反应来进行评价,主要有简短摄取法( brief access test) 和双瓶偏好法( two-bottle choice paradigm) 。简短摄取实验是指将样品放入特定的摄取装置“Davis Rig”[41],在短时间内记录被摄取的次数,进而判断出受试动物对样品的偏好程度[42]。
双瓶偏好法是在动物饲养笼外放置相同的多个水瓶,通过比较动物对试验组和对照组的饮水量,以及观察动物饮水时的自身反应( 如摇头、颌击、躁动、退回笼子角落等回避反应) 进行综合评价[43]。大鼠的味觉系统以及对味道的喜好与人类相似,故常用来作为受试物种。
Noorjahan 等[44]采用双瓶偏好法证明了大鼠对EDTA-铁的不良味道的回避行为具有浓度依赖性,且与人群口尝法具有一定的相关性。因此在产品开发前期,该模型在一定程度上可以代替人群口尝法,从而避免毒性等风险。
3.3、体外评价法
与体内评价方法( 动物偏好测试和人群口尝法) 相比,体外评价法的优势在于安全性和客观性,但往往需要多种分析方法联合评价,并建立体内外相关性。
3.3.1 溶出度试验
体外溶出度试验适用于掩味策略为阻止药物在口腔中释放的情况,溶出介质通常选择水或模拟唾液,应考虑到介质的体积、温度、pH、渗透压、离子强度、模拟唾液流速及舌头力矩等对溶出的影响。
国际药学联合会/美国药学科学家协会在《新型和特殊剂型的溶出/体外释放实验指导原则》[21]中指出: 如果掩味是制剂质量评价的重要一环,则需要在5 min 内进行多点检测药物的溶出。溶出度标准应根据药物的苦味阈值( bitterness value) [27]确定,即苦味物质经稀释后仍能品尝出苦味时该稀释度的倒数,通常以盐酸奎宁溶液( 苦味阈值= 200 000) 为对照,并计算6 例以上受试者的校正因子。另外,在对咀嚼片有效掩味的同时不能影响药物的体内释放,因此还需进一步考察药物在胃肠道中的溶出[39]。
3.3.2 形态表征及电子舌
当药物进行粉末包衣或制成固体分散体、包合物、微球等中间体时,通过扫描电镜法( SEM) 、差示扫描量热法( DSC) 、X 射线光电子能谱( XPS) 、X 射线衍射( XRD) 、红外光谱( IR) 等手段能够观察中间体的形态和结构,从而帮助评价掩味效果[45]。电子舌是利用交互感应的多传感器阵列读取液体样本的特征性响应信号,收集的信号经计算机处理和模式识别分析后,以样品整体品质信息作为输出的设备[46]。电子舌评价系统主要是通过比较掩味后的药品以及单纯的苦味药物的检测输出信号差异来评价掩味效果。运用电子舌检测药品可以减少体内评价中个体味觉敏感差异和主观感知差异而带来的结果偏差,且结果重现性较好。但相比于液体制剂,咀嚼片不能使用电子舌直接进行评价,必须将其溶解后才能测定,其评价结果无法反映咀嚼片的沙砾感、白垩感等综合感官结果,加之高昂的成本使得目前电子舌在咀嚼片口感评价中的应用实例不多[47]。
4、其他项目
4.1 崩解时限
《中华人民共和国药典》2020 年版制剂通则[1]中规定“咀嚼片不进行崩解时限检查”、“凡规定检查溶出度、释放度的片剂,一般不再进行崩解时限检查”。《美国药典》[14]、《欧洲药典》[27]、《日本药局方》[48]均未对咀嚼片的崩解时限提出规定。但是,即使相同活性成分、相同片重及径向破碎力相当的片剂,其崩解时限仍有较大差异[49 - 51],且考虑到可能存在患者咀嚼不充分或不经咀嚼直接吞咽的情况,FDA 建议将崩解时限纳入咀嚼片的关键质量属性,要求咀嚼片的崩解时限应足够短,以免患者咀嚼不充分时发生吸收不完全或消化道梗阻事件[4,52]。
4.2 命名和标识
我国目前对咀嚼片的服用方式未做明确规定。FDA 将咀嚼片区分为2 种类型: 一类是“为方便给药而允许咀嚼的片剂”,这类咀嚼片可以咀嚼后吞服,也可以直接用水送服; 另一类是“在吞咽前必须咀嚼和/或压碎,以避免窒息和确保有效成分释放的片剂”,这类咀嚼片必须咀嚼且没有其他给药途径[4]。因此,咀嚼片的说明书信息应明确咀嚼片的类型,并以醒目的标识告知患者给药方式。
5、结语
咀嚼片易于服用、口感良好,弥补了普通口服固体制剂吞咽困难的问题,尤其提高了儿童服用药物的顺应性和安全性,是今后儿童药物制剂的一个重要发展方向。但其不完善的质量控制和评价体系在一定程度上制约了一些药物品种的可咀嚼剂型研发[61]。目前,我国对咀嚼片的关键质量属性监管不完全,质量评价指标范围太过宽泛,且未证明其在可承受标准之内。
本文以FDA 发布的咀嚼片质量评价指南为参考,梳理了国内外咀嚼片的质量评价方法并进行归纳和总结,建议咀嚼片生产商重视咀嚼片的各种物理特性,如片剂的形状、厚度、脆碎度和味道等,并将硬度、崩解时限、溶出度以及其他影响生物利用度和生物等效性的因素纳入关键质量属性。要充分控制咀嚼片的性能,不能只考虑单一的质量属性,而应考虑质量属性的合理组合,确保咀嚼片达到预期的用途。展望未来,建议规范咀嚼片的质量控制和评价工作,以促进我国咀嚼片的研发、生产和监管,推进我国儿童用药政策体系的建立和发展。
参考文献
《中国新药杂志》2022 年 第31 卷第7期

来源:药物制剂之家


