您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-19 00:08
细细观察西方以及国内的CRO/CDMO企业在技术服务的项目中,多出现固体分散体作为增加药物溶解度,提高药物生物利用度的手段。此种类型的企业作为技术服务公司,所建立的平台以及所要打算承接的项目类型,恰恰也表明了创新药一个不容忽略的发展趋势,那就是创新药开发中,满心期待的先导化合物可能成药性不佳,越过了所谓的5 rule(bRo5)多项指标:
化合物的分子量不大于500g/mol;
化合物结构中的氢键供体(包括羟基、氨基等)的数量不大于5个;
化合物中氢键受体的数量不大于10个(N+O);
化合物的脂水分配系数的对数值(logP)不大于5;
化合物中可旋转键的数量不大于10个。
此类化合物API水溶性极差,细胞渗透性有限,造成化合物产品口服生物利用度不佳。
化合物筛选多通过高通量进行选择,加之作为化合物靶点的特性。一般化合物学家致力于提高化合物的作用效果,就需要化合物与之作用的靶点具有很强的亲和力。如果作用靶点疏水性强,就需要化合物具有很强疏水性。在药物筛选中追求更高的效价,往往就会加强对于与作用靶点亲和力的筛选,在细胞等生物水平进行测试,往往加入有机试剂,测试结果可能是抑制作用最为强劲的那一个。虽然满足构效关系选择了一个治病效果好的化合物,往往也走向了极端。一味追求实验室规模的作用效果,也造成了其疏水性极高而亲水性/水溶性极差,忽略了化合物的成药特性。一旦进入制剂临床前研究,就会发现,制剂人很难使用普通制剂快速推进化合物进入临床开发。
关注难溶性药物会发现很多的报道,表明了无论从已上市的还是研发产线中的,难溶性药物(BCSⅡ/Ⅳ)都已经达到70%以上。众所周知,一个化合物在人体中的“生死历程”,首先可能在胃肠道进行崩解成小的颗粒,颗粒间分崩离析后,才会发生溶解。溶解的化合物才能通过小肠上皮细胞,通过门静脉,进入血液循环。其中,化合物的溶解性和渗透性也构成了BCS分类的指标,而这两个指标也代表着化合物影响其体内生物利用度最重要的两个特性。当然了,对于制剂开发人员来说,除了在处方中添加助渗透的成分,一般对于生物利用度低的化合物,我们可以做的更多是考察改善药物的溶解度。因为化合物只有溶解才能吸收,只有吸收发能发挥作用,对于一个难溶性药物我们又能采取哪些措施呢?目前对于制剂开发人员来说比较棘手的问题是,需要化合物溶解去满足吸收与创新药研发中化合物越来越难溶之间的矛盾越来越僵化,需要一种或多种趁手的手段,去“铺桥修路”,打破这其中的桎梏。
众所周知,在化合物筛选的时候,优选晶体药物,而且选择多晶型中最稳定的晶型作为目标晶型来开发,因为它在制备,存储的过程中性质比较稳定且易于控制去建立质量标准满足申报要求,这种晶型也称之为优势晶型。当然,这种筛选目标和思路是对的,可是,对于所有的化合物不是都适用的。选择了所谓的优势晶型,也预示着这个晶型化合物与其他晶型化合物相比(包括化合物的无定形形式)具有最低的溶解度。这个也很好去理解,化合物晶型越是稳定,这个物质的体系内的能量越低,分子间的交错堆积处于最合适位置,分子间的作用力也就是最强。换言之,这个晶型晶格能比较强。晶格能强,需要打破其稳定的“堡垒”,就需要更多的能量,也就是打破晶格能需要更多的熔化热,也就是预示着这个化合物熔点高。根据公式:
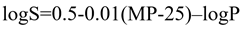
其中,S为溶解度,MP为熔点(晶格能量度),logP为脂溶性量度。这样很容易把熔点与化合物的熔点建立了关系。
在进行药物的形式筛选时,发现单单化合物分子优势晶型太稳定招致溶解度过低而影响其体内吸收,一般进行化合物的盐型或者共晶筛选,具体的筛选方向需要根据化合物的酸碱性质(主要指化合物pKa)来决策。一般化合物多以盐型形式出现。但是盐型筛选其实也是一个比较消耗时间与资源的活动,而且盐型在一定程度上可以使化合物溶解度达到过饱和,可是伴随着胃肠道酸碱性的变化,如何需要格外关注沉淀的发生,如游离碱成盐,在胃里面溶解度很大,一旦进入小肠,pH增加,化合物游离碱的形式可能析出。如何模拟化合物在胃肠的过程,以期待其可以在胃里面保持的时间,达到小肠立马就能吸收,避免析出沉淀。对于有希望的盐型,仍需进一步进行其优势晶型的筛选。
如有盐型确实不合适开发,根据Noyes-Whitney方程:
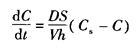
其中,dC/dt为溶出速度;D为溶质在溶出介质中的扩散系数;S为固体的表面积;V为溶出介质的体积;h为扩散层的厚度;Cs为溶质在溶出介质中的溶解度;C为t时间溶液中溶质的浓度。
通过粒径的减少,提高固体的表面积,进而提高固体与溶剂的接触,提高制剂的溶出,这或许也是不错的方法。粉碎或者微粉最低把化合物的粒度降低至
2μm,仅仅是提高了溶出速率,无法改变溶解度。根据DCS分类系统,通过化合物的溶解度与渗透性的重新的定义,创造性的DCS分为DCSⅡa(溶出限制体内吸收)与DCS Ⅱb(溶解度限制体内吸收)。判定化合物为DCSⅡa,还可以通过粒径降低解决因溶出而造成的吸收障碍。可是判定为DCS Ⅱb,就需要切实的提高化合物的溶解度,比如:粒度进一步的破坏,纳米晶化。根据Ostwald-Freundlich方程可知,当药物粒径小于1μm时,药物的溶解度会随粒径的减小而增大。当然,纳米晶依旧存在着需要克服的问题。在制备过程中,随着药物粒径的减小,粒子的表面自由能显著增大,粒子间产生相互聚集以降低表面自由能的趋势,同时纳米粒子强烈的布朗运动加剧了粒子间不断地相互碰撞,很容易发生聚集、结块、晶体生长或晶态改变等现象。因此,可在制备过程中加入1种或2~3种稳定剂混合使用,以解决粒子聚集或结块等问题。稳定剂主要分为离子型稳定剂(如阴离子型表面活性剂)和非离子型稳定剂(如非离子型表面活性剂、高分子聚合物)。离子型稳定剂主要通过静电排斥作用保持纳米体系稳定;非离子型稳定剂则主要通过提供空间阻碍作用保持纳米体系稳定。
最近,无定形固体分散体越来越受到关注,作为一种有效的制剂策略,可以明显的改善溶解度和溶出速率。药物以无定形形式分散在聚合物材料中,打破了化合物的晶格能,特别是对于高熔点化合物尤其明显,改善其溶解度。当然,固体分散体的开发依旧困难重重。无定形作为高能态,热力学不稳定,高能态势终究要转变为低能形式。留给我们的余地不过是,如何保证在货架期无定形的稳定性以及在给药体内维持在体内的过饱和浓度,在吸收窗内的过饱和浓度,可以促进化合物进入体内血液循环,提高化合物的生物利用度。
本文首先亮明了新药开发中遇到的一个现实问题-化合物越来越难溶,已经严重影响到了化合物的口服吸收,针对问题,然后列举了可供选择增溶策略的特征。相对而言,除了物理稳定性问题比较突出,固体分散体处方更加简单且动物试验与临床试验处方一致,易于桥接;基于喷雾干燥或者热熔挤出制备固体分散体,基础理论与配套设备比较成熟,且易于放大生产;固体分散体确实提高难溶性化合物的溶解度升高2-10,对于熔点较高者,更甚;极多研究表明,固体分散体提高生物利用度的作用之大。
参考文献:
1. Lipinski, C. A. et al. Adv. Drug Deliv. Rev. 1997,23, 3–25.
2. Veber, D. F. et al. J. Med. Chem. 2002, 45,2615-2623.

来源:药事纵横


