您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-08 17:54
包装系统研究主要有包装系统基本信息获取、包装系统的选择及匹配性、包材性能的对比以及包材相容性四个部分组成,在2022年03月23日药事纵横发布的《注射剂包装系统研究重点关注什么,申报资料该如何撰写?》一文中已对前三部分进行了探讨,本文将着重对包装系统研究之包材相容性研究进行讨论。
一、研究思路及撰写要点:
参考《化学药品注射剂与药用玻璃包装相容性研究技术指导原则(试行)》、《化学药品与弹性体密封件相容性研究技术指导原则(试行)》相关内容,对直接接触药液的包装材料与药物进行系统的相容性研究,以确保所选包材与产品质量合格,从而顺利申报上市。包材相容性研究主要包括提取试验、模拟试验、迁移试验以及吸附试验。
二、举例如下:
2.1 提取试验(胶塞)
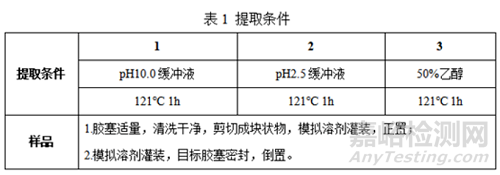
①提取样品制备
②目标化合物分析
胶塞的来源厂家需要提供给申报方胶塞配方组成、添加剂信息及安全性测试分析报告,申报方需以附件的形式附加在申报资料当中,且申报方还需根据厂家信息确定自制产品提取的目标化合物,大致分为以下几类:
1.抗氧剂:抗氧剂1010、抗氧剂BHT、抗氧剂1076;
2.多环芳烃类:苯并噻唑、萘、蒽、菲等;
3.邻苯二甲酸酯类:DMT、DBT、DEHP、十二烷基邻苯二甲酸酯等;
4.N-亚硝基类:N-亚硝基二甲胺、N-亚硝基二乙胺、N-亚硝基吡咯烷等;
5.元素杂质:铝、硅、钙、镁、锌等元素;
6.其他:抗氧剂降解杂质、二苯胺、苯胺、硫、四氯乙烯、四氯乙烷等。
备注:以上种类需根据产品实际提取物质种类一一罗列。
③限度计算与分析方法
根据该产品临床用法用量显示,本品规格10ml,最大日剂量60ml,则每日最大接触胶塞为6个,根据最大日剂量以及样品规格,对可提取物进行限度计算。
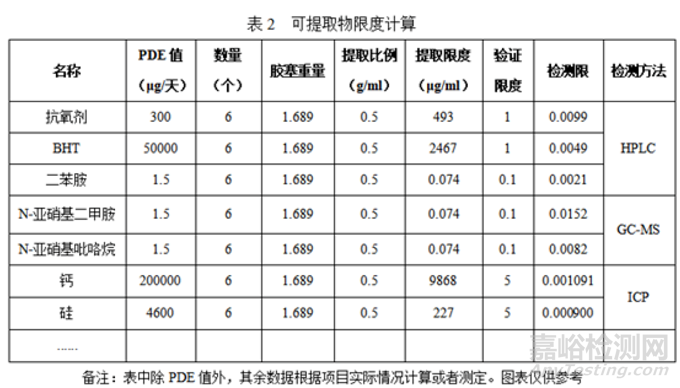
胶塞可提取物研究分别采用HPLC、GC、ICP检测方法,且进行了系统的方法学验证,提取物检测方法具有准确性、专属性及灵敏度。
④胶塞提取结果
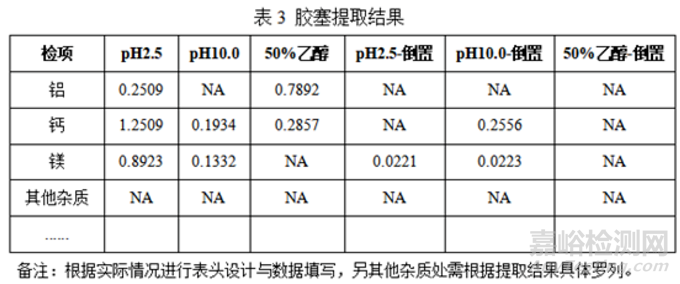
结论:将覆膜胶塞通过模拟溶剂破坏后进行可提取物研究,主要提取物有抗氧剂1076、钙、镁、铝(根据结果全部罗列),与厂家提取结果基本一致。邻苯二甲酸酯、亚硝酸胺等强毒性物质纳入未知可提取物研究,结果显示各提取条件下杂质均未检出,另厂家提供的安全性测试分析报告中对上述强毒性物质也进行了系统性研究,结果也显示均未检出。后续模拟实验与迁移试验重点关注抗氧剂1076、钙、镁、铝(实际情况填写)在药物中的迁移情况。
2.2 模拟与迁移试验
①样品制备
模拟试验:选用一批中试规模以上样品,高温60℃条件下放置(正放、倒置)一个月,定点取样检测,模拟高温条件下药液与包材相互作用情况,选择安全限度较低且增长趋势明显的的物质作为迁移试验检查项目指标。
迁移试验:迁移试验的目的在于判断产品在长期放置过程中,包材有关物质是否迁移到药液中,从而影响产品质量。试验方法是结合加速试验及长期试验(正放、倒置),定点取样检测指标物质。
②目标化合物分析
根据胶塞提取结果,模拟试验与迁移试验需重点关注抗氧剂1076、钙、镁、铝(实际情况填写)在药物中的迁移情况。为同时考察原辅包、生产设备和塑料组件相容性引入的元素杂质,综合确定模拟与迁移重点关注的浸出物包括:抗氧剂1076、镁、铁、锌、锂等(实际情况一一罗列)。根据各浸出物的性质与PDE值,抗氧剂1076、BHT等采用HPLC进行方法建立;镁、铁、锌等采用ICP-OES进行方法建立;铝、汞、铬等采用ICP-MS进行方法建立,并进行了系统性验证,确保方法的准确性、专属性以及灵敏度。
③模拟试验结果
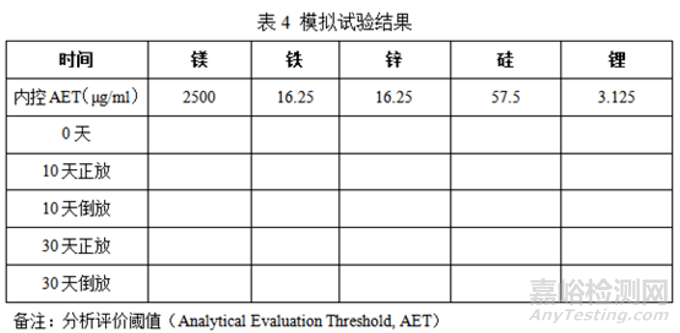
试验结果表明:本品0天以及高温条件下样品均未检测出抗氧剂迁移至样品中,各元素杂质迁移量均低于内控AET的30%,迁移风险在控制范围内。
④迁移试验结果
采用经过方法学验证的检测方法测定样品杂质迁移量。
试验结果表明:本品稳定性6月样品均未检出相关杂质,各元素杂质迁移量均低于内控AET的30%,迁移风险在控制范围内。
⑤安全性评估
根据迁移结果,各被测物采用内控AET的30%作为检出量进行安全性评估,判断注射剂与包材是否相容。
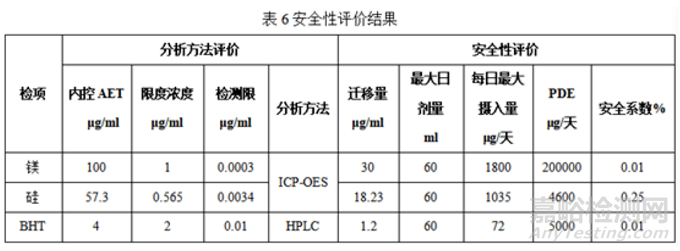
备注:安全性评价结果表格检项仅供参考,检项需根据迁移结果进行安全性评价
结论:包材相容性迁移实验采用HPLC、ICP-OES、ICP-MS分析方法,各方法均经过系统的方法学验证。三批工艺验证样品稳定性稳定性6个月迁移量均低于内控限度,通过最大日剂量计算各物质的每日最大摄入量,均小于每日最大暴露量(PDE),安全系数均小于1%,包材杂质迁移至产品安全风险可控。
2.3 吸附试验
思路:结合验证或者中试批稳定性试验,检测样品含量是否有显著性变化趋势,证明包材对样品主成分无吸附作用。
三、模拟运输验证
验证批样品或者商业批次还应进行极端条件下的模拟运输验证,以证明产品质量在极端运输过程中得到良好的保证,该部分内容可外委有资质的公司进行验证。

来源:药事纵横


