您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-30 00:53
摘 要 长效注射剂因可长时间控制药物释放,减少给药次数而显著改善了用药顺应性,在药物制剂研究领域中占据重要地位。本文以注射微球、原位凝胶植入剂两种类型的长效注射剂上市产品为切入点,剖析了此类长效制剂处方及工艺中为实现长时间释药所采用的策略与技术。同时就此类制剂普遍存在的突释现象,综述了现阶段研究中控制突释的相关策略,为此类长效制剂的设计、研发与优化提供参考。
长效注射剂(long-acting injectables,LAIs)属于复杂注射剂,一般包括微球、脂质体、纳米混悬剂、胶束、原位凝胶植入剂等,可通过常规注射器和针头注射给药[1]。长效注射剂与其他注射剂型一样,必须是无菌、生物相容和非免疫原性的,因在注射部位存在时间长,这些特性对长效注射剂而言更为重要。上市产品多为多肽与蛋白质药物,常用于慢性疾病、精神类疾病与眼部疾病的治疗。多肽和蛋白质类药物因胃肠道和肝脏中酶及 pH 介导的快速降解导致口服生物利用度低[2],通常以注射剂或其他替代给药途径(如吸入、颊、鼻内、直肠与透皮)给药[3-4],而在慢性病与精神疾病患者的治疗中,频繁注射对依从性的负面影响尤为明显。长效注射剂在实现长时间平稳释药的基础上,减少了给药次数与血药浓度波动引起的全身性不良反应,显著提高患者的生活质量。由于此类制剂普遍存在显著的突释效应,短时间内释放的大量药物可能对用药安全性带来不良影响[5],控制突释是此类制剂研究和优化的重点与难点。本文将对微球与原位凝胶植入剂两类长效注射剂的背景进行介绍并分析上市产品为实现长效所采用的策略,同时对现阶段控制突释的研究进展进行综述。
1、微球
微球(microspheres)是一种用高分子材料包载药物的微小球状聚合物,通常粒径范围为1 ~ 250μm[6],理想情况下10 ~ 125μm可减少注射后巨噬细胞的吞噬作用和局部组织炎症[7]。药物通过吸附于聚合物表面或包入和嵌入聚合物内部,在几周或几个月时间内以一定的速率释放药物。注射微球的释药机制可分为两种:药物扩散与聚合物降解或溶蚀[8],前者药物通过聚合物载体的通道而迁移,后者药物随载体分子分解而迁移[9]。体外释放曲线可分为单相、两相或三相[10],大部分注射微球释药包括最初的突释阶段、大致恒速释放阶段以及最终的快速释放阶段[11]。截至2020年底,FDA批准上市的注射微球相关产品汇总见表 1。

1.1 制备材料
微球的制备材料主要分为天然高分子与合成高分子。天然高分子包括淀粉、明胶、凝集素、海藻酸盐、果胶和壳聚糖等,具有低毒性、生物相容性和可生物降解性,但其纯化困难,批次之间差异大[12]。合成高分子分为不可生物降解聚合物与可生物降解聚合物,前者包括有机硅、醋酸乙烯乙酯(EVA),后者包括聚乳酸(PLA)、聚己内酯(PCL)、聚乙醇酸(PGA)和聚乳酸-羟基乙酸共聚物(PLGA)[13]。与天然高分子相比,合成高分子具有更好的可加工性、机械稳定性以及更慢的生物降解速率[14]。PLA与PLGA因具有良好的生物相容性与降解率,可通过选择相对分子质量、共聚和官能化来调节微球的物理化学与机械性能从而调节药物释放行为[15],在肠胃外长效制剂中应用最为广泛。但由于两者是低玻璃化聚合物,与其他材料(如赋形剂、溶剂、药物)的相互作用易引起固体基质的增塑和退火,对制备和储存稳定性有一定影响[16]。另外,PLA/PLGA微球容易发生高可变性[17],由于复杂的物理化学性质,载肽微球受制造差异的影响相较于小分子药物微球更为显著[18]。
1.2 制备方法
微球制备方法主要分为溶剂挥发法、相分离法、喷雾干燥法等。溶剂挥发法中的双乳液溶剂挥发法(W/O/W 法)因具有操作简便、包封率高的特点,多用于多肽、蛋白等亲水性药物微球的制备。
以武田与雅培联合推出的注射用醋酸亮丙瑞林微球(商品名:Lupron Depot®)为例,制备中先将醋酸亮丙瑞林溶于水中形成内水相,再分散于溶解有PLGA或PLA的有机溶剂二氯甲烷中以形成初乳,加入至含有表面活性剂的水相中形成复乳,挥发除去第一相中的有机溶剂同时固化微球,离心收集微球并冻干即得终产品。此法在制备过程中需要重点关注有机溶剂移除工艺,该过程对微球形态及聚合物释药孔道的形成影响较大,有机溶剂残留超限会引起微球聚集且存在安全隐患[19]。Lupron Depot®目前共有1个月(3.75mg,7.5mg)、3个月(11.25mg)、4个月(22.5mg,30mg)、6个月(45mg)4种释药周期共6种规格的制剂[20],不同规格间通过辅料的适当调整以满足相应释药周期的要求。1个月的长效制剂以PLGA作为基质材料,通过在初乳中加入明胶以及降低内水相形成温度来增加内水相黏度以提高包封率。3、4和6个月的长效制剂基质材料则选择降解速率更慢的PLA,增加了聚合物溶液和W/O 乳液的黏度,也因此无需在内水相中添加明胶[21]。
不同于Lupron Depot®采用的W/O/W法,Debiopharma公司的注射用双羟萘酸曲普瑞林微球(商品名:Trelstar®)采用了Debio PLGA技术[22],该专利技术先将药物与聚合物材料于室温下均质化,经过预压缩与预加热后,于80 ℃ ~ 100 ℃下挤出,随后冷却研磨,再对所需粒径范围的微球进行筛分与收集。通过该法制备的终产品保证了活性物质在聚合物中均匀分散,且因制备过程中未使用有机溶媒,更有利于保护多肽药物的活性。Trelstar®目前共有1个月(3.75mg)、3个月(11.25mg)、6个月(22.5mg)3种释药周期共3种规格的制剂[23]。Debiopharma公司通过调整共聚物中PLGA组成和比例以满足不同释药周期的要求。Skidmore等[24]表征了 Trelstar®不同配方使用的PLGA性质,结果显示 3.75mg与11.25mg 规格分别采用了单一的丙交酯与乙交酯摩尔比为 50∶50和75∶25的PLGA,以对应1个月与3个月的释药要求,而22.5mg规格将 3种丙交酯与乙交酯摩尔比(85∶15、75∶25 和 70∶30)的PLGA混合,使药物释放延长至6个月。
国内方面,丽珠医药、博恩特药业与绿叶制药等企业在微球领域积极布局,目前已分别实现了醋酸亮丙瑞林微球(商品名:贝依®、博恩诺康®)、注射用利培酮微球(商品名:瑞欣妥®)的国产化。
2 原位凝胶植入剂
原位凝胶植入剂(in situ forming gel implant,ISFGI)通过将药物与溶解在有机溶剂中的基质材料混合后注入体内,因注射部位的外界环境刺激而发生固态或半固态的相转变以形成局部药物储库的液体制剂[25-26]。有机溶剂包括水溶性的N-甲基-2-吡咯烷酮(NMP)、2-吡咯烷酮、二甲基亚砜(DMSO)、四氢呋喃与水溶性较差的乙酸乙酯、碳酸丙烯酯与甘油三乙酸酯,NMP 由于其溶剂化能力强,在此类制剂中使用最多[27]。基质材料通常为具有良好生物相容性且水不溶的聚合物如PLA、PLGA、聚乳酸-己内酯共聚物(PCLA)、聚原酸酯、醋酸-异丁酸蔗糖酯 (SAIB) 等[28],刺激因素则包括溶剂的去除、光、温度、pH与离子强度的变化等[29]。原位凝胶植入剂与注射微球相比,具有制备工艺简单、成本低、封装效率高等优势。
但由于使用到的有机溶剂多为NMP与DMSO,存在一定的肌肉毒性[30]。且在形成凝胶之前没有为药物释放提供任何物理屏障,注射入体内需要一定时间固化,故原位凝胶植入剂通常存在比微球更大的初始突释[31]。相关的毒性问题与突释效应限制了原位凝胶植入剂的开发与应用。截至2020年底,FDA批准上市的原位凝胶植入剂相关产品汇总见表 2。
Artix 实验室基于Atrigel®技术开发的注射用醋酸亮丙瑞林混悬液(商品名:Eligard®)是原位凝胶植入剂中具有代表性的产品。Eligard®由两个独立包装的预填充剂组成,分别装有醋酸亮丙瑞林粉末和溶解于NMP中的PLGA。在给药前,将两组分充分混匀以获得均匀悬浮液,通过标准注射器和针头将其注射到皮下组织中,伴随着有机溶剂NMP散布到周围组织,组织中的水分渗透到植入剂中,发生相分离及混合物凝结,从而在原位形成植入剂[32]。Eligard®目前共有1个月(7.5mg)、3个月(22.5mg)、4个月(30mg)、6个月(45mg)4种释药周期共4种规格。各配方通过调整PLGA中丙交酯与乙交酯的摩尔比与端基以满足不同释药周期的需要,1、4 与6个月制剂的DL-丙交酯与带有羧基端的乙交酯的摩尔比分别为50∶50、75∶25、85∶15,3个月制剂的 DL-丙交酯与己二醇化乙交酯的摩尔比为75∶25[33]。与微球制剂相比,Atrigel®递送系统制备简单且具有高封装效率[34],对肽、蛋白质、疫苗的兼容程度更高,并有助于防止体液中蛋白质的变性[35]。使用Atrigel®技术上市的产品还有丁丙诺啡长效注射剂(商品名:Sublocade®)、盐酸多西环素凝胶(商品名:Atridox®)和利培酮皮下注射用长效混悬液(商品名:Perseris®)。
3 控制突释的策略
相关长效注射剂产品的获批表明其总体收益大于潜在风险,但注射微球与原位凝胶植入剂普遍存在着不同程度的突释效应[31],可能导致短暂的高血药浓度并诱导各种不良反应[5]。针对突释成因的研究较多,通常认为突释效应由表层药物快速溶解[36]、内部药物通过疏松孔洞快速释放所引发。制备方法中移除有机溶剂的过程使得部分药物随有机溶剂一起迁移至微球表面或近表面层;或在微球制备与原位凝胶植入剂成型过程中形成了较大孔洞。影响突释效应的因素具体包括微球与植入剂的形态和孔隙度、聚合物相对分子质量、聚合物成分与亲疏水性、聚合物与药物的相互作用、以及药物本身的水溶性与晶型等[37]。控制突释可以避免血药浓度突增带来的风险,减少给药总剂量而不影响产品性能以降低药物制造成本。结合近年来国内外学者控制突释的研究进展,对相关策略进行分类与综述。
3.1 采用复合聚合物材料
通过调整基质材料的性质如采用与无机材料结合的复合材料或嵌段共聚物代替传统的高分子材料,可实现对注射微球与原位凝胶植入剂孔隙率及亲疏水性的控制,进而减少突释量。
Zhou等[38]以罗丹明B(RB)作为水溶性模型药物,采用微流控技术制备了PLGA与介孔二氧化硅纳米颗粒(MSNs)复合微球,将其与PLGA微球在药物释放方面进行了比较。研究表明,PLGA-MSNs复合微球具有更致密的外层 PLGA层和更集中的中空孔,在相似的释放周期中未观察到任何突释现象。
在原位凝胶植入剂方面,Kamali等[39]通过使用PLGA与聚乙二醇(PEG)的三嵌段共聚物(PLGA-PEG-PLGA)代替PLGA制备纳曲酮(NXT)原位凝胶植入剂,考察了三嵌段共聚物中丙交酯与乙交酯摩尔比、PEG的质量分数以及三嵌段共聚物在制剂中的质量分数对释放情况的影响。结果发现,随着丙交酯与乙交酯摩尔比增加至6.5∶1,三嵌段的疏水性增强,吸收更少的水从而减慢了NMP的扩散而减少突释;当PEG的质量分数在20% ~ 30%时,因增加了 NMP分子和PEG之间的氢键数量同样发挥了减少突释的作用;三嵌段共聚物的热敏性质可增强共聚物分子之间的交联,增加水凝胶的曲折度和黏度,当质量分数由30%增至45.4%时,初始突释降低至最小值,随后质量分数的增加对初始突释没有显著影响。除了对纳曲酮的研究外,该研究团队使用以上三嵌段聚合物代替聚乙烯醇作为乳化剂制备利培酮微球,同样减少了利培酮的初始突释[40]。
3.2 加入控释添加剂
微球制备过程中掺入添加剂可达到提高包封率与减少突释的效果,添加剂的加入增加了外水相的渗透压,阻止连续相进入分散相,减少水性通道的形成从而控制突释。常见的添加方法包括:内水相中加入吐温-20、葡聚糖,油相中加入疏水性阻滞剂、甘油[41],外水相中加入氯化钠等。对于原位凝胶植入剂,已提出了多种类型的添加剂,例如羟丙基甲基纤维素(HPMC)、苯甲酸乙酯与聚谷氨酸(PLG)/PEG 嵌段共聚物。添加剂的使用会影响有机溶剂与水分的交换速率以及植入剂的孔隙率及膨胀度,水溶性添加剂可能会在植入剂形成过程中迅速浸出到水释放介质中,促进植入剂膨胀而加速释放[42]。
Wang等[43]研究了棕榈酸加入量对罗替戈汀微球形态及体外释放的影响,发现微球的表面形态随棕榈酸用量的增加,由光滑变为凹陷再变为不光滑,添加质量分数为5%和8%的棕榈酸会显著降低罗替戈汀微球的初始爆发释放药物量。内源性物质因具有无毒且易于代谢的特点在控制突释的添加剂中研究较多。Liu等[44]研究了葡萄糖和CaCl2 对醋酸奥曲肽微球初始突释的影响,两种内源性添加剂物理化学性质相似,均在药物释放阶段增加了渗透压和水的表面张力,但仅葡萄糖发挥了减少突释的作用。原因在于,葡萄糖和聚合物之间形成的氢键导致聚合物快速自我修复和孔封闭,从而抑制药物的突释效应,CaCl2则会破坏部分氢键从而丧失了抑制作用。Kamali等[39]在纳曲酮原位凝胶植入剂中加入质量分数为1% ~ 5%的庚酸乙酯,鉴于其在水中有限的溶解度,可减慢NMP向释放介质扩散,从而减少了初始爆发释放量[39]。
3.3 调整药物亲水性
W/O/W法包封亲水性药物可获得较高的包封率,但药物溶解在内部水相使内水相渗透压增加,对于小分子亲水性药物而言,易由内水相逃逸至外水相而导致包封率低且突释明显,故调整药物的亲水性可减少此类逃逸,有助于控制突释。
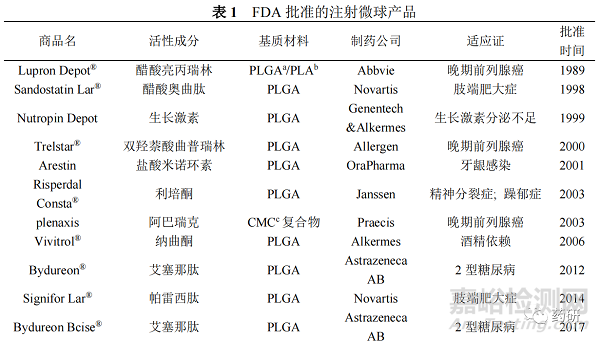
实现药物盐与游离碱形式的转化或形成疏水性复合物,可达到改变药物水溶性的效果。盐酸布比卡因易溶于水,将其通过碱沉淀法制得布比卡因游离碱,降低水溶性从而可采用O/W法制备微球以提高包封率并控制突释[45-46]。Liu等[47]通过将亲水性药物醋酸奥曲肽和硫酸葡聚糖硫酸钠(DSS)形成疏水离子对(HIP)复合物,改变了该药物的高度亲水性。使用S/O/W方法将该疏水复合物封装到微球中,与传统的W/O/W 法相比,药物的封装效率从44%提高到 90%,HIP微球通过“修复”表面孔隙和内腔通道(图1),封闭药物扩散途径将突释降至3.56%,显著减小了微球突释量。
调整药物质子化也是诸多策略中的一种。Chitinart 等[48]通过改变质子化和去质子化阿霉素(Dox)的质量百分比,混合去质子化的Dox 调整药物水溶性,控制了由PLGA(丙交酯与乙交酯摩尔比为70∶30)制成的长效制剂中Dox的突释效应。研究发现,含有100%质子化Dox的制剂在24h内的初始爆发释放量为(86.6 ± 5.3)%。当质子化的Dox比例分别降至98.75%、97.5%、95%、90%和85%时,初始爆发释放量显著降低至(48.5 ± 2.5)%、(41.8± 1.5)%、(35.1 ± 2.4)%、(27.3 ± 2.9)%和(22.0 ± 2.1)%。
3.4 改进制备技术
阻止亲水性药物逃逸可通过以上所述的方法在W/O/W 技术的基础上进行优化,还可采用其他改进的制备技术以减少逃逸通道的形成而控制药物突释。
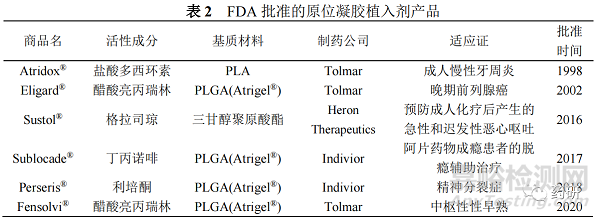
Chen等[49]通过液体/油/油(L/O/O)相分离法制备了负载醋酸曲普瑞林的 PLGA微球,通过确定PLGA浓度、溶剂和非溶剂的比例、固化溶剂的体积以及固化速度等显著影响微球性能的因素后,筛选出的最佳处方具有71.35%的包封率与0.78%的突释量。研究者分析认为醋酸曲普瑞林与PLGA基质在该制备方法下的相互作用可能是微球具有高包封率和低突释的原因。Dong 等[50]采用改进的水包油包固体(S/O/W)乳化法制备了包裹艾塞那肽(Ex)的卵磷脂纳米颗粒的复合PLGA微球(Ex-NPs-PLGA-Ms),与通过常规W/O/W技术制备的ExPLGA-Ms相比,Ex-NPs-PLGA-Ms显示出更均匀的粒径分布。通过研究两者在PBS(pH 7.4)培养基中的体外释放发现,Ex-PLGA-Ms的药物释放曲线显示为三相模式,在24h内观察到明显的突释(27.32 ± 3.21)%;而 Ex-NPs-PLGA-Ms 在24h内持续缓慢释放药物,初始爆发释放量减少至(11.90 ± 1.73)%。研究人员分析,水溶性Ex在制备过程中通过W/O/W方法容易扩散到外水相,导致微球表面分布的药物较多,而复合微球中的纳米颗粒则分布均匀(图2)。卵磷脂可能影响微球聚合物基质的性能,减慢了微球的水解过程并延长药物持续释放的时间。除了改善包封技术外,在溶剂蒸发技术的基础上加入介质研磨工艺,在介质研磨的过程中,吸附在微球表面上的药物被洗脱,也可在一定程度上减少突释[51]。
以上措施可进行组合以更大程度上实现对突释的控制,例如近期研究较多的微球-凝胶给药系统与单独的微球或凝胶相比兼具了释药完全、释放行为易控制、突释少等优点。Zhang等[46]通过将O/W法制备了布比卡因游离碱微球(MS/BUP),再与PLGA-PEG-PLGA溶解在磷酸盐缓冲溶液中,于4 ℃下搅拌24h制得原位注射水凝胶-聚乙二醇微球(Gel/BUP-MS)体系。体外释放结果显示,给药后24h内MS/BUP与Gel-BUP的药物释放量分别是28.42%和35.94%,而Gel-MS/BUP仅为15.3%,药物在Gel-MS/BUP系统中的释放同时受内微球基质和外水凝胶基质的调节。Deng等[52]通过溶剂蒸发结合挤出滚圆技术制备了姜黄素微粒(CURPellets),进一步制备了CUR-微粒/温敏凝胶系统(CUR-Pellets-Gel),采用AUC(0-1 d)/AUC(0- t d)进行体内突释评价,CUR-Pellets-Gel与CUR-Gel和CUR-Pellets相比,该值分别降低96.7%(1.28% vs 39.12%)和87.4%(1.28% vs 10.13%),说明温敏凝胶发挥了限制突释的屏障作用,使得温敏凝胶内部微粒具有更少的突释。
4 总结与展望
长效注射剂可显著减少给药频率提高患者用药顺应性,具备较高的技术壁垒和可观的市场利润,是国内药企在“4+7”背景下寻求转型的热点领域。本文从微球与原位凝胶植入剂的已上市产品入手,剖析具体产品为长时间释药所采用的策略,为此类长效制剂的开发提供参考。因突释问题限制了此类制剂更好地发挥优势作用,掌握控制突释的方法将是开发和生产更具经济效益和临床意义的长效制剂的关键突破口。本文通过列举最新的相关解决措施与技术,为控制突释效应提供理论支持。全球已上市的产品通过延长原有品种的生命周期,大多获得了巨大的成功,目前国内仅实现了亮丙瑞林微球与利培酮微球的国产化,长效注射剂仍存在着非常大的市场潜力和发展空间。

来源:Internet


