您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-22 11:07
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
齐鲁1类抗肿瘤生物药获批临床。齐鲁制药注射用QLS31906获国家药监局临床试验默示许可,拟用于治疗恶性肿瘤。QLS31906也是该公司今年来获批临床的首款1类生物药。据悉,齐鲁制药今年已有3款1类生物药申报临床,包括QL1706注射液、注射用QLS21908和QL1604注射液。近年来国内抗肿瘤药市场持续扩容,2020年中国公立医疗机构终端抗肿瘤药销售额突破1000亿元,同比增长10.69%;2021上半年其销售额超过570亿元,同比增长17.74%。
国内药讯
1.海和MET抑制剂拟纳入优先审评。上海海和与中科院上海药物所联合开发的MET抑制剂谷美替尼(SCC244)的新药上市申请获CDE拟纳入优先审评。临床前研究显示,SCC244能够高效、特异靶向抑制MET激酶酶活,口服具有显著的体内外抗肿瘤活性。在关键II期临床SCC244-108(GLORY)中,谷美替尼在携带MET改变的晚期非小细胞肺癌患者中获得有效性和安全性数据。去年9月,谷美替尼已被CDE纳入突破性治疗品种。
2.荣昌HER2-ADC尿路上皮癌临床积极。荣昌生物在ASCO-GU2022会上公布其自主研发并获批的首个国产ADC药物维迪西妥单抗联合特瑞普利单抗治疗局部晚期或转移性尿路上皮癌的Ib/II期研究(RC48-C014)积极结果。最新数据显示,该药在所有患者中,经证实的研究者评估的客观缓解率(ORR)为75%,在一线转移性尿路上皮癌患者的cORR为80%。而且ORR随HER2或PD-L1高表达而升高,其中在HER2(3+)患者的ORR高达100%。
3.亘喜生物双靶点CAR-T上新临床。亘喜生物BCMA/CD19双靶点自体CAR-T疗法GC012F在国内开展的用于治疗复发/难治性B细胞非霍奇金淋巴瘤(B-NHL)的Ⅰ期临床完成多例患者给药。这是一项由研究者发起的临床研究,评估GC012F治疗复发/难治性B-NHL患者的安全性及有效性。在中国,GC012F正开展多项由临床研究者发起的Ⅰ期临床试验;在美国,GC012F治疗多发性骨髓瘤已获FDA授予的孤儿药资格。
4.华海PD-L1/TGF-β双抗获批临床。华海药业旗下公司华奥泰生物及华博生物联合申报的HB0028注射液的临床试验申请获国家药监局批准,拟临床用于治疗晚期实体瘤。HB0028是一款PD-L1/TGF-β双特异性抗体,由TGF-β II 型受体与抗PD-L1抗体的C端融合,克服同类药物将TGF-β II型受体与抗PD-L1抗体的N端融合容易产生O糖的缺点,同时也进一步增强HB0028的药效。目前尚无同时靶向PD-L1和TGF-β的同类药物上市。
5.凯莱英再签35亿CDMO订单。凯莱英宣布全资子公司吉林凯莱英与客户签订了相关产品新一批的《供货合同》,将持续为某制药公司的一款小分子化学创新药物提供合同定制研发生产(CDMO)服务。本次合同金额折合人民币约35.42亿元,供货时间为2022年。此前,凯莱英已先后与这家美国制药公司达成30亿元、27亿元人民币的CDMO订单。这3个大单中的制药公司预测为辉瑞,产品应为新冠口服药Paxlovid的原料药。
国际药讯
1.默克MET抑制剂在欧盟获批上市。欧盟委员会批准默克靶向抗癌药Tepmetko(tepotinib)上市,用于治疗携带MET外显子14(METex14)跳跃变异的晚期非小细胞肺癌经治患者。一项关键Ⅱ期VISION研究(NCT02864992)数据显示,经合并活检组的独立评估,Tepmetko治疗的缓解率(ORR)达到46%、中位缓解持续时间(DOR)为11.1个月。2020年3月,Tepmetko在日本获批上市,是全球首款获批用于治疗携带MET基因改变的晚期NSCLC患者的口服MET抑制剂。
2.默克/辉瑞PD-L1抑制剂长期疗效积极。默克旗下EMD Serono与辉瑞联合开发的PD-L1抑制剂Bavencio(avelumab),在一线维持治疗尿路上皮癌(UC)的Ⅲ期临床结果积极。在38个月中位随访期时,与最佳支持治疗(BSC)相比,Bavencio与BSC联用使患者中位总生存期(OS)延长8.8个月(中位OS:23.8个月vs15.0个月,HR=0.76;95% CI,0.631至0.915)。接受治疗30个月时,两组的生存率分别为43.7%和33.5%。临床中未发现新的安全性信号。
3.礼来IL-23p19抑制剂Ⅲ期临床积极。礼来IL-23p19抑制剂mirikizumab在ECCO2022大会上首次公布用于治疗中重度溃疡性结肠炎(UC)的Ⅲ期临床【LUCENT-1(NCT03518086)】积极数据。该研究达到主要终点和全部关键次要终点。与安慰剂组相比,mirikizumab治疗组第12周时患者的临床缓解率显著更高(24.2%vs13.3%,p=0.00006)。该新药的总体安全性与已知研究相似。礼来计划在2022年上半年向FDA提交mirikizumab治疗UC的上市申请。
4.克罗恩病并发症细胞疗法RCT研究积极。武田制药同种异体脂肪间充质干细胞产品Alofisel(darvadstrocel)治疗克罗恩病(CD)患者复杂性肛周瘘(CPF)的上市后、开放式入组研究INSPIRE(EUPAS24267)结果积极。第一次6个月中期分析显示,在2个队列中(全部治疗队列和按方案治疗队列),有65%的患者达到临床缓解。这些结果与关键Ⅲ期ADMIRE-CD研究在疗效和安全性方面一致。
5.oivant引进卫材FIC小分子调节剂。oivant公司成立新的子公司Hemavant,并与卫材达成一项许可协议,获得卫材临床期RVT-2001的全球独家权利。RVT-2001是一款靶向剪接因子SF3B1的潜在“first-in-class”小分子调节剂,有潜力治疗低风险骨髓增生异常综合症(MDS)患者的输血依赖性贫血。在Ⅰ/Ⅱ期临床中,RVT-2001已在19例低风险、输血依赖性MDS患者中,让超过30%的患者不依赖血红细胞输注。
6.Ligand剥离与强生合作的抗体平台。Ligand公司宣布,将剥离该公司与强生合作的抗体平台业务OmniAb,并以7000万美元为该公司注资。据悉,来自OmniAb的九种抗体最近已进入了临床阶段,其中一些已获得部分监管机构的认可。在中国,基石药业就凭借OmniAb衍生的非小细胞肺癌抗PD-L1单抗Celjemy获得CDE的批准。强生旗下杨森也于去年12月向FDA提交了针对多发性骨髓瘤的OmniAb衍生双抗teclistamab的监管申请。
医药热点
1.港版“方舱医院”19日起开建。香港特区行政长官林郑月娥日前在新闻发布会上宣布,19日起,香港将在内地团队的协助下开始建设一个临时隔离设施“方舱医院”。香港卫生署卫生防护中心18日报告,香港新增新冠确诊病例3629例,其中3627例为本土病例,新增死亡病例10例。林郑月娥表示,香港已准备全民检测,预计两至三个月稳定疫情,现阶段不考虑“封城”。
2.浙江推动公立医院高质量发展。浙江省政府办公厅发布《浙江省推动公立医院高质量发展实施方案》,提出今后5年浙江省推动公立医院高质量发展的总体要求、重点任务和保障措施。其中《方案》明确,实施优质医疗资源扩容计划,推动县域医共体牵头医院提标扩能,县级公立医院中的三级医院占比达30%、床位占比达60%以上;到2025年,县域就诊率达90%以上,基层就诊率达65%以上。
3.北京:每区都要设安宁疗护中心。北京市卫健委等多部门联合发布《北京市加快推进安宁疗护服务发展实施方案》,力争到2025年,北京市每区至少设立1所安宁疗护中心,床位不少于50张,为有住院治疗需求的安宁疗护患者提供整合安宁疗护服务;全市提供安宁疗护服务的床位不少于1800张。《方案》将支持有条件的二级及以下医院、社区卫生服务中心按要求转型为安宁疗护中心。
4.美国加州将实施地方性流行病防疫政策。当地时间17日,美国加州州长纽瑟姆宣布,该州首次转向以“地方性”流行病来应对新冠疫情。纽瑟姆认为,加州这种“与新冠共存”的防疫计划强调预防和快速反应。该计划还设定具体目标,例如储备7500万个口罩,每天增加20万次疫苗接种和50万次测试,并可在三周内向疫情地区增加3000名医务人员。
评审动态
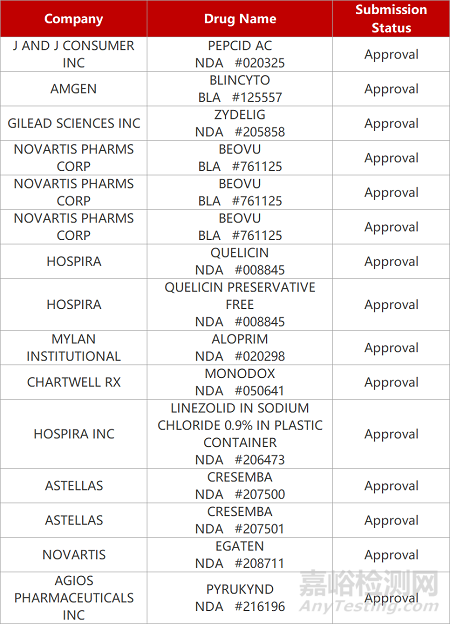
2. FDA新药获批情况(北美02月18日)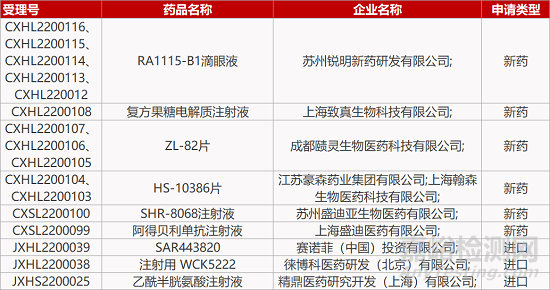

来源:药研发


