您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-26 11:31
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
新型β-内酰胺酶抑制剂报IND。苏州信诺维抗生素新药XNW4107注射液的临床试验申请获CDE受理。XNW4107是一款新一代的β-内酰胺酶抑制剂,现有研究表明其能够有效杀灭革兰氏阴性菌,并且对鲍曼不动杆菌、铜绿假单胞菌、肠杆菌科细菌均有效,抑菌效果优于已上市的同类抗生素,有望为解决抗身素耐药问题提供新选择。在美国,该新药已获得FDA的临床许可。
国内药讯
1.甘李长效GLP-1激动剂获批临床。甘李药业创新型治疗用生物制品GZR18获国家药监局多项临床试验默示许可,拟开发用于肥胖或超重、2型糖尿病等治疗的临床研究。GZR18是一款每周注射一次的胰高血糖素样肽1(GLP-1)受体激动剂类药物。GLP-1通过与GLP-1受体相结合,刺激胰岛素的分泌,并且抑制胰高血糖素的分泌,从而促进葡萄糖的代谢;同时,它还能够能起到延缓胃排空和抑制食欲的效果。
2.和誉FGFR2/3抑制剂在美获批临床。和誉医药口服FGFR2/3抑制剂ABSK061获FDA临床试验许可,即将开展针对实体瘤的首次人体Ⅰ期临床。ABSK061是和誉医药自主研发并拥有其全球知识产权的新一代口服、高活性、高选择性小分子FGFR2/3抑制剂,已在临床前研究中显示出良好的活性、选择性、药代特性、理化特性及安全性,有望在临床上取得更好的安全窗及疗效,以及拓展用于治疗非肿瘤适应症。
3.泽璟PD-1/TIGIT双抗报IND。泽璟制药1类治疗生物制品ZG005粉针剂的临床试验申请获CDE受理,拟开发用于实体瘤的治疗。ZG005是一款重组PD-1/TIGIT双抗,已在临床前研究中显示出显著且长效的抗肿瘤作用,疗效优于单药(PD-1抗体或TIGIT抗体)及联合用药;而且在非人灵长类动物中具有良好的安全性特征。目前全球范围内尚无同类药物获批上市。在国内,信达生物和默沙东2家企业申报了同靶点药物。
4.泛生子与复星医药达成合作。泛生子与上海复星旗下江苏复星医药就泛生子Seq-MRD®(血液肿瘤微小残留病)检测服务签订独家商业化合作协议。Seq-MRD®是一种用于检测和监测特定血液系统肿瘤中微小残留疾病的分子诊断方法。根据协议,两家公司将在中国指定地区的血液病重点医院和诊所,共同销售和联合推广Seq-MRD®,服务于急性淋巴细胞白血病、多发性骨髓瘤、慢性淋巴细胞白血病等淋系血液肿瘤患者。
5.华润双鹤布局新冠口服小分子药物。华润双鹤宣布与美国Ligand公司将利用Ligand公司的BEPro技术,共同开发一款治疗新冠肺炎COVID-19的口服小分子RNA聚合酶抑制剂。BEPro是最新一代前药技术,BEPro技术开发的抗病毒药物具有良好的口服生物利用度和提高肺部药物浓度等特点。根据协议,华润双鹤有权获合作品种在亚洲主要区域的独家开发和商业化权利。
国际药讯
1.Keytruda联合化疗治疗乳腺癌获欧盟批准。欧盟委员会批准默沙东PD-1疗法Keytruda与化疗联用,一线治疗局部复发性不可切除或转移性三阴性乳腺癌成人患者。在一项关键Ⅲ期KEYNOTE-355试验(NCT02819518)中,与单独化疗相比,这一组合疗法显著改善了患者的无进展生存期和总生存期,提高了患者的总体生存率,将死亡风险降低了27%,减缓了疾病进展,并使患者的死亡率降低了34%。
2.IL-13单抗治疗特应性皮炎Ⅲ期临床积极。LEO Pharma全人源化IL-13单抗tralokinumab治疗特应性皮炎青少年患者的Ⅲ期临床达到主要和次要终点。与安慰剂相比,tralokinumab治疗组第16周时达到IGA 0/1应答的患者比例更多(21.4%和17.5%,vs4.3%),达到EASI 75应答的患者比例也更多(28.6%和27.8%,vs6.4%);临床中AE事件多为轻中度,各治疗组间AE的发生率相似。目前tralokinumab已在欧盟获批上市,是首个获批的IL-13单体。
3.Moderna启动巨细胞病毒mRNA疫苗III期临床。Moderna巨细胞病毒(CMV)mRNA疫苗mRNA-1647在美国登记启动一项III期临床。计划招募6900名16-40岁女性健康受试者,评估mRNA-1647的有效性、安全性和免疫原性。受试者将在第1天、第57天和第169天通过肌肉注射(IM)接种mRNA-1647疫苗。在II期临床中,血清阴性和血清阳性受试者在接种第1剂疫苗后中和抗体滴度均呈剂量递增;注射第7个月,疫苗可引发上皮细胞和成纤维细胞有效且持久的中和抗体滴度。
4.ShouTi公司完成新一轮融资。ShouTi公司宣布完成1亿美元的B轮融资。ShouTi首席执行官Raymond Stevens博士是国际著名的结构生物学家,在与糖尿病、肥胖等人类重大疾病相关的GPCR蛋白结构生物学、药物开发等方面拥有丰富经验,领导发现了用于治疗2型糖尿病的Nesina等多种药物。获得资金将用于推进公司的新型GPCR靶向小分子药物发现平台,以及临床阶段管线的发展。
5.Agenus撤回PD-1上市申请。Agenus宣布撤回其PD-1单抗balstilimab单药用于化疗后疾病进展的复发或转移性宫颈癌患者的上市申请。该申请今年6月已获FDA受理并同时获得优先审评资格,PDUFA日期为12月16日。据悉,FDA建议Agenus撤回上市申请,是因为默沙东Keytruda同样单药二线治疗宫颈癌的适应症刚刚被转成完全批准。FDA认为balstilimab的现有数据无法证明比已有疗法更好,不满足加速批准的条件。
6.全球首款上市PDC药物撤市。Oncopeptides公司美法仑氟苯甲酰胺Pepaxto宣布在美国撤回用于治疗复发或难治性多发性骨髓瘤患者的上市资格。Pepaxto为一款抗癌肽偶联药物(PDC)。与ADC相比,PDC具有分子量小、免疫原性低、药代动力学较好等优点,为新兴的肿瘤靶向药研究热点领域。今年3月,FDA批准了首款PDC药物Pepaxto上市。本次撤市基于其不明原因的死亡风险增加。
医药热点
1.北大医学部首个校外合作实体落户泰州。10月23日,北京大学医学部(泰州)医药健康产业创新中心在第十二届中国(泰州)国际医药博览会开幕式上正式揭牌。这也是北大医学部首个校外合作实体机构。该创新中心将通过推动科技平台建设、构建全链条创新体系,旨在将泰州、江苏打造成更具核心竞争力的世界级生物医药产业创新发展新高地。
2.新版三级医院评审标准实施细则发布。10月22日,国家卫健委发布《三级医院评审标准(2020 年版)实施细则》。《实施细则》明确,医疗服务能力与质量安全监测数据分数在整个评审分数的权重占比不低于60%。评审结果判定为甲等的,现场评审得分不能低于90%。评审周期为四年,医院在评审周期内发生一项及以上情形的,延期一年评审。延期期间原等次取消,按照“未定等”管理。
3.中国科学家发现“人体组织液循环网络”。北京医院李宏义教授团队重大原创性科学发现发布会23日在北京举行。该团队首次发现“人体组织液循环网络”解剖学结构,提出在已知的血液循环系统、淋巴循环系统之外,还存在第三种体液循环系统,即“组织液循环网络”系统,并开拓了从组织液循环网络的角度研究经络穴位的新领域。
评审动态
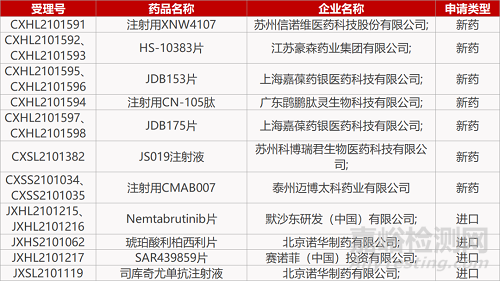
申请临床:
苏州信诺维医药的注射用XNW4107、江苏豪森的HS-10383片(2个规格)、上海嘉葆药银医药的JDB153片(2个规格)和JDB175片(2个规格)、广东鹍鹏肽灵生物的注射用CN-105肽、苏州科博瑞君生物的JS019注射液、默沙东的Nemtabrutinib片(2个规格)、赛诺菲的SAR439859片、诺华的司库奇尤单抗注射液。
申请生产:
泰州迈博太科药业的注射用CMAB007(2个规格)、诺华的琥珀酸利柏西利片
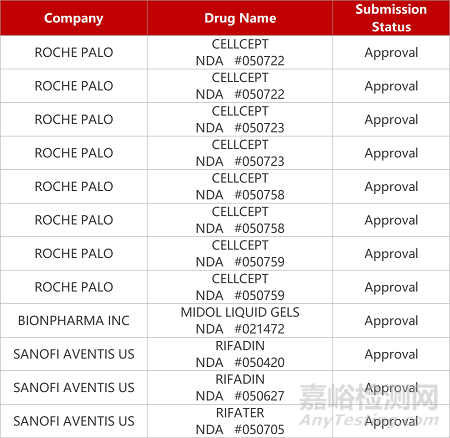
2. FDA新药获批情况(北美10月22日)

来源:药研发


