您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-24 09:53
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
信迪利单抗新适应症报产。信达生物信迪利单抗新适应症上市申请获CDE受理,该项适应症推测为:联合化疗一线治疗食管鳞癌。公布于ESMO 2021会议上的一项Ⅲ期临床ORIENT-15研究显示,信迪利单抗联合化疗一线治疗食管鳞癌显著延长患者的中位总生存期(mOS:16.7个月vs12.5个月,HR为0.628)和中位无进展生存期(mPFS:7.2个月vs5.7个月,HR为0.558),降低死亡风险37.2%。该新药今年上半年销售额超过14亿元。
国内药讯
1.三叶草新冠疫苗对变异株均有效。三叶草生物和流行病防范创新联盟(CEPI)宣布,重组蛋白新冠疫苗SCB-2019(CpG 1018/铝佐剂)在国际关键性Ⅱ/Ⅲ期临床(SPECTRA )中达到主要和次要终点。试验结果分析中观察到的新冠毒株全部(100%)为变异株,SCB-2019对任何毒株引发的任何严重程度的新冠肺炎总体保护效力达到67%。其中,针对Delta、Gamma和Mu变异毒株的保护效力分别为79%、92%和59%。
2.君圣泰HTD1801达Ⅱ期临床终点。君圣泰口服多功能小分子原创新药HTD1801针对非酒精性脂肪性肝炎合并2型糖尿病(NASH + T2DM)的Ⅱ期临床积极数据发布在《自然》子刊Nature Communications上。结果显示,与安慰剂相比,HTD1801治疗组18周后肝脏脂肪含量(LFC)显著降低(4.8%vs2.0%,p=0.011);该项研究同时也达到多个关键次要终点(包括改善肝损伤、血糖控制、心血管代谢等相关生物标志物)。
3.荣昌Claudin18.2-ADC国内获批临床。荣昌生物1类新药注射用RC118获国家药监局临床试验默示许可,拟开发用于Claudin18.2表达阳性的局部晚期不可切除或转移性恶性实体瘤。RC118是一款靶向Claudin18.2的抗体偶联药物(ADC),也是荣昌生物继RC48(维迪西妥单抗)、RC88、RC108之后,开发的第4款ADC疗法。RC118已在澳大利亚获批临床,目前正在Ⅰ期临床中评估用于治疗实体瘤患者的安全性和耐受性。
4.安科抗肿瘤创新药ZG033报IND。安科生物旗下合肥瀚科迈博生物公司抗肿瘤创新药ZG033注射液的临床试验申请获CDE受理。ZG033是一款针对于4-1BB(CD137/TNFRSF9)的人源化单克隆抗体,临床前研究表明ZG033能够通过FcγR促进T细胞与NK细胞的增殖与活化,同时还能提高细胞因子的分泌,具有良好的药效与安全性。目前,全球范围内尚无同靶点药物上市。
5.成都施贝康SBK001报IND。成都施贝康生物1类新药SBK001注射液的临床试验申请获CDE受理,拟用于伴有痰液分泌不正常及排痰功能不良的急性、慢性肺部疾病,例如慢性支气管炎急性加重、喘息型支气管炎、支气管哮喘以及手术后肺部并发症等的祛痰治疗。SBK001具有全新的作用机制,该新药此前已获批开展用于急性肺损伤的预防性治疗的临床试验。
6.信立泰引进GLP-1/GCGR双靶点激动剂。信立泰与韩国D&D Pharmatech达成合作许可协议,获得D&D开发的长效GLP-1R/GCGR双重激动剂DD01在中国大陆地区的独家许可权。DD01目前正在美国开展以患有非酒精性脂肪肝病(NASH)、肥胖型II型糖尿病患者为受试者的I期临床试验。根据协议,D&D公司将获得400万美元首付款,最高不超过2,300万美元的里程碑付款,以及产品的销售分成。
7.云顶新耀联合AbCellera开发新型抗体。云顶新耀与AbCellera公司达成研发合作协议,将利用AbCellera支持多种抗体发现模式的运营体系,针对肿瘤相关10个靶点,共同开发新型治疗性抗体候选药物。根据协议,AbCellera将获得研究费用,基于临床研究、商业里程碑的后期付款,以及产品销售分成;云顶新耀将有权开发和商业化基于合作研发的抗体新药。
国际药讯
1.芦可替尼治疗GVHD获FDA批准。FDA批准Incyte公司JAK抑制剂芦可替尼(Jakafi)扩展适应症,用于治疗慢性移植物抗宿主病(GVHD)经治患者。在一项Ⅲ期临床中,与对照组相比,Jakafi治疗组中激素难治性GVHD患者在24周时的总缓解率(ORR)更高(49.7%vs25.6%,p<0.0001)。研究成果已发表在《新英格兰医学杂志》上。值得一提的是,芦可替尼外用剂型刚刚获得FDA批准,用于治疗轻中度特应性皮炎。
2.Vumerity获CHMP推荐治疗多发性MS。欧盟人用医药产品委员会(CHMP)推荐批准渤健新一代口服富马酸盐Vumerity上市,用于治疗复发缓解型多发性硬化症患者。Vumerity是渤健另一款多发性硬化症(MS)重磅药物Tecfidera的升级产品,目前在美国获批的适应症包括临床孤立综合征、复发-缓解型多发性硬化症和活动性继发性进展性疾病。Vumerity现已超越Tecfidera成为美国多发性MS疗法中第一大处方口服药物。
3.艾伯维IL-23抑制剂新适应症报产。艾伯维IL-23抑制剂Skyrizi(risankizumab-rzaa)向FDA提交了新适应症上市申请,用于治疗16岁以上中/重度克罗恩病患者。IL-23是一种参与炎症过程的细胞因子,与许多慢性免疫介导的疾病有关。2019年4月,Skyrizi获得FDA批准,用于治疗适合接受全身治疗或光疗的成人中/重度斑块状银屑病。目前,Skyrizi正在多项Ⅲ期试验中评估治疗银屑病关节炎和溃疡性结肠炎的潜力。
4.诺华开展Kisqali头对头III期研究。诺华拟联合SOLTI创新癌症研究中心合作开展一项III期研究Harmonia,头对头比较其CDK4/6抑制剂Kisqali和辉瑞Ibrance联合内分泌疗法对于HER2富集型的HR+/HER2-晚期乳腺癌的治疗效果差异。Harmonia研究是首个在RNA水平检测招募特定肿瘤分子亚型患者的前瞻性III期试验,也是首个在HR+/HER2-晚期乳腺癌患者中开展CDK4/6抑制剂头对头比较的临床试验。该项研究计划在2022Q1启动。
5.CAR-M疗法获FDA快速通道资格。FDA授予CARISMA Therapeutics细胞疗法CT-0508快速通道资格。CT-0508是一款靶向HER2的嵌合抗原受体巨噬细胞(CAR-M)疗法,已在治疗HER2阳性转移性卵巢癌的小鼠模型中,成功缩小了动物中的肿瘤并且延长动物的寿命。该疗法目前正在开展Ⅰ期临床,评估用于治疗目前治疗无效的HER2过表达、复发/转移性实体瘤患者的有效性与安全性。
6.TAC-T细胞疗法上临床。Triumvira公司基于T细胞抗原偶联剂(TAC)技术平台开发的TAC-T细胞疗法TAC01-HER2启动临床试验并完成首例患者给药。TAC-T细胞疗法以不同于CAR-T和TCR-T细胞疗法的方式激活天然T细胞功能,它通过与T细胞表面的T细胞受体(TCR)结合,利用TCR的天然调控机制激活T细胞,而且TAC与抗原的结合不依赖主要组织相容性复合体(MHC)呈递抗原,在靶向抗原方面具有灵活性。
医药热点
1.美国新冠疫情或始于2019年9月。中科院预印本平台(ChinaXiv)22日发布的一项基于大数据建模分析的新冠肺炎疫情起源时间研究结果表明,美国新冠疫情较大概率于2019年9月前后已开始流行。研究结果显示,美国东北部12州,新冠疫情首例感染发生概率50%的日期多数位于2019年8月到10月,最早是罗德岛州的2019年4月26日,最晚是特拉华州的2019年11月30日,均早于美国官方公布的全美首例确诊日期2020年1月20日。
2.5位生命科学领域学者获“引文桂冠奖”。论文及期刊索引平台科睿唯安公司公布2021年“引文桂冠奖”得主名单。在16位获奖者中,有5位为生命科学领域学者,他们分别为:发现烟碱型乙酰胆碱受体及其变构特征,为神经受体研究做出重要贡献的法国巴斯德学院荣誉教授Jean-Pierre Changeux、日本大阪大学名誉教授平野俊夫(Toshio Hirano)、日本大阪大学WPI免疫学前沿研究中心免疫调节实验室教授岸本忠三(Tadamitsu Kishimoto)、美国新墨西哥大学名誉教授Karl M. Johnson、韩国首尔高丽大学名誉教授李鎬汪(Ho Wang Lee)。
3.全国科技经费投入统计结果出炉。《2020年全国科技经费投入统计公报》日前发布,2020年中国研究与试验发展(R&D)经费投入总量达到24393.1亿元(人民币,下同),比上年增长10.2%;按R&D人员全时工作量计算的人均经费为46.6万元,比上年增加0.5万元。其中,经费投入超过千亿元的省(市)有8个,分别为广东(3479.9亿元)、江苏(3005.9亿元)、北京(2326.6亿元)、浙江(1859.9亿元)、山东(1681.9亿元)、上海(1615.7亿元)、四川(1055.3亿元)和湖北(1005.3亿元)。
评审动态
申请临床:
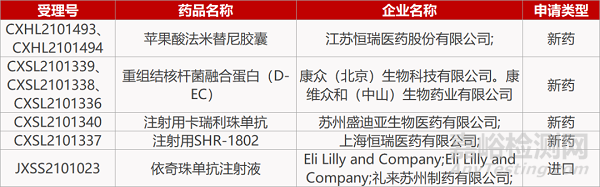
江苏恒瑞的苹果酸法米替尼胶囊(2个规格)、康众(北京)/康维众和的重组结核杆菌融合蛋白(D-EC)(3个规格)、苏州盛迪亚的注射用卡瑞利珠单抗、上海恒瑞的注射用SHR-1802。
申请生产:
礼来的依奇珠单抗注射液。

来源:药研发


