您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-11 11:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
嘉和CDK4/6抑制剂启动Ⅲ期临床。嘉和生物CDK4/6抑制剂Lerociclib片(GB491)登记启动一项III期临床,联合氟维司群治疗既往接受内分泌治疗后疾病进展的HR+/HER2-局部晚期或转移性乳腺癌患者。该研究主要研究者由中国医科院肿瘤医院徐兵河主任医师担任,目标入组人数270人。今年7月Lerociclib还获批开展联合来曲唑一线治疗HR+/HER2-的晚期/转移性乳腺癌的III期临床,目前这项临床尚未启动。
国内药讯
1.卡瑞利珠单抗在美获批III期临床。恒瑞医药PD-1抑制剂注射用卡瑞利珠单抗获FDA批准,即将在美国开展III期临床。该项研究将评估卡瑞利珠单抗联合苹果酸法米替尼胶囊对比多西他赛治疗既往含铂类化疗和免疫检查点抑制剂治疗失败的晚期非小细胞肺癌的效果。卡瑞利珠单抗自2019年在国内上市以来,已获批霍奇金淋巴瘤、肝癌、肺癌、食管鳞癌、二线及以上鼻咽癌、一线鼻咽癌6个适应症,是获批适应症最多的国产PD-1产品。
2.国产皮卡新冠疫苗在新西兰启动临床。依生生物自主研发的皮卡重组蛋白新冠疫苗获新西兰药监部门批准开展Ⅰ期临床。这款疫苗是由皮卡佐剂和重组三聚体SARS-CoV-2 S蛋白亚单位抗原(CHO细胞,S蛋白)组合而成。在临床前研究中,该疫苗针对Alpha, Beta, Gamma和Delta变异株均具有良好的中和能力,有望成为具有预防和治疗双功能的通用型疫苗。该疫苗此前也已在阿拉伯联合酋长国获临床许可。
3.GSK慢性乙肝疗法拟纳入突破性治疗品种。葛兰素史克1类新药GSK3228836注射液获CDE拟纳入突破性治疗品种名单,拟用于慢性乙型肝炎的治疗。GSK3228836是一种反义寡核苷酸,能特异性识别感染乙肝病毒(HBV)的肝脏细胞中用于表达病毒抗原(致病蛋白)的mRNA,通过动员肝脏自身的酶系将病毒mRNA灭活,抑制病毒蛋白HBsAg的水平,以实现功能治愈乙肝的目的。目前,该新药正在全球进行Ⅱ期临床。
4.复星凯特CAR-T新适应症拟纳入突破性疗法。复星凯特阿基仑赛注射液(商品名:奕凯达)获CDE拟纳入突破性治疗品种,用于治疗接受过二线或以上系统治疗后复发或难治性惰性非霍奇金淋巴瘤(r/riNHL),包含滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)。这是该产品在国内申报的第二个适应症。此前,阿基仑赛注射液已获批用于治疗成人复发难治性大B细胞淋巴瘤,是国内首个获批的CAR-T疗法。
5.荣昌生物「维迪西妥单抗」海外授权。荣昌生物宣布与Seagen公司就其HER2-ADC新药维迪西妥单抗达成独家全球许可协议。维迪西妥单抗(RC48,爱地希®)已获NMPA附条件批准上市,用于治疗局部晚期或转移性胃癌。根据协议,Seagen将获得大中华区和亚洲国家(日本、新加坡除外)之外的全球开发和商业化维迪西妥单抗的权益;荣昌生物将获得2亿美元首付款,最高24亿美元里程碑付款以及产品的销售分成。
国际药讯
1.达格列净获欧盟批准治疗慢性肾病。阿斯利康SGLT2抑制剂达格列净(Farxiga)获欧盟委员会批准用于治疗伴或不伴2型糖尿病(T2D)的新发或恶化慢性肾病(CKD)成人患者。Farxiga也是欧盟批准治疗CKD的第一款SGLT2抑制剂。在一项Ⅲ期DAPA-CKD试验中,Farxiga联合标准治疗进一步降低了患者肾功能恶化、终末期肾病发作的相对风险;在Ⅱ-Ⅳ期和尿白蛋白排泄升高的患者中,Forxiga可使患者心血管或肾脏死亡的风险降低39%。
2.IL-17A/F单抗治疗斑块型银屑病临床积极。优时比在AAD2021会议上公布IL-17A/F抑制剂bimekizumab治疗中重度斑块型银屑病患者的Ⅲ期临床BE BRIGHT扩展(OLE)研究数据。接受bimekizumab治疗16周后实现皮损完全清除或几乎完全清除(IGA 0/1)的患者中,通过每4周一次或每8周一次持续维持给药治疗,分别有94.4%和96.2%的患者在OLE试验第48周维持IGA 0/1。这些数据显示bimekizumab在这类患者中能提供皮损完全清除长达2年的潜力。
3.创新CD79b-ADC达Ⅲ期临床主要终点。罗氏“first-in-class”靶向CD79b的抗体偶联药物(ADC)Polivy(polatuzumab vedotin)联合化疗方案R-CHP,在一线治疗弥漫性大B细胞淋巴瘤(DLBCL)患者的关键性Ⅲ期临床POLARIX中获积极结果。与标准治疗R-CHOP相比,这一组合疗法显著改善患者的无进展生存期。详细结果将于医学会议上公布。目前,Polivy在全球60多个国家和地区获批,与苯达莫司汀或利妥昔单抗联用,以治疗复发性或难治性DLBCL患者。
4.阿斯利康/第一三共ADC二线治疗乳腺癌积极。阿斯利康与第一三共联合开发的HER2靶向抗体偶联药物(ADC)Enhertu(trastuzumab deruxtecan),在治疗接受过曲妥珠单抗和紫杉烷初治的HER2阳性不可切除/转移性乳腺癌患者的Ⅲ期临床DESTINY-Breast03中达主要终点。与活性对照组相比,Enhertu显著改善了患者无进展生存期(PFS);总生存期(OS)也观察到改善趋势;Enhertu安全性特征与既往研究一致。详细数据将在医学会议上公布。
5.预测诊断AD的AI软件获突破性医疗器械认定。Altoida公司用于阿尔茨海默病(AD)和痴呆症预测诊断的人工智能软件获FDA授予的突破性医疗器械认定。通过这款非侵入性软件,患者只需在他们的智能手机或平板电脑上完成一套10分钟、类似视频游戏的认知评估,软件就能收集他们个体化的大脑数据并生成一份完整的认知报告。如果获批,这款软件将成为首个可以在症状出现前预测AD发作的数字诊断工具。
6.新一代DNA损伤疗法临床前数据积极。Lantern Pharma公司在研新一代DNA损伤候选药物LP-184在胰腺癌小鼠模型中获积极结果。临床前数据显示,在8周内,LP-184治疗组的肿瘤与基线相比缩小了超过90%,而未接受治疗组肿瘤体积增长11倍。该试验还观察到在同源重组和核苷酸切除修复通路中携带基因变异的胰腺肿瘤,对LP-184的敏感性提高了2倍,Lantern计划在今年晚些时候启动IND申请。
医药热点
1.国务院发文预防新冠救治定点医院院内感染。国务院新冠疫情联防联控机制综合组日前发布《关于进一步加强新型冠状病毒肺炎救治定点医院院内感染预防与控制工作的通知》。其中明确,各地要指定综合能力强、具备重症救治条件、感控管理水平高的医院作为定点医院。在常态化情况下,要将境外输入和本土散发新冠肺炎确诊病例及无症状感染者集中收治于定点医院独立区域的独立病房楼,不得与其他疾病患者同时收治于同一区域或同一病房楼。
2.北京市明确临床试验与医保支付范围。北京市医保局日前发布《关于进一步明确药物临床试验相关医疗费用医保基金支付范围的通知》,在全国范围内率先明确临床研究与医保支付之间的关系。通知强调:基本医保基金不支持试验用药和临床试验相关的医学检查费用;除此之外,参保患者因病就诊产生的其他医疗费用中,符合医保基金支付范围的,医保基金按规定予以支付。
3.湖北简化乙类医用设备配置程序。湖北省卫健委日前向泰康同济(武汉)医院发放了全省首张社会办医疗机构配置乙类大型医用设备备案通知书。社会办医疗机构在设备安装验收后直接申请备案,取得备案通知书后,设备即可投入临床使用。从受理申请到完成备案,相关部门只用了3个工作日。据悉,湖北省也是全国首个在全省范围内将社会办医疗机构配置乙类大型医用设备改为备案制的省份。
审评动向
申请临床:
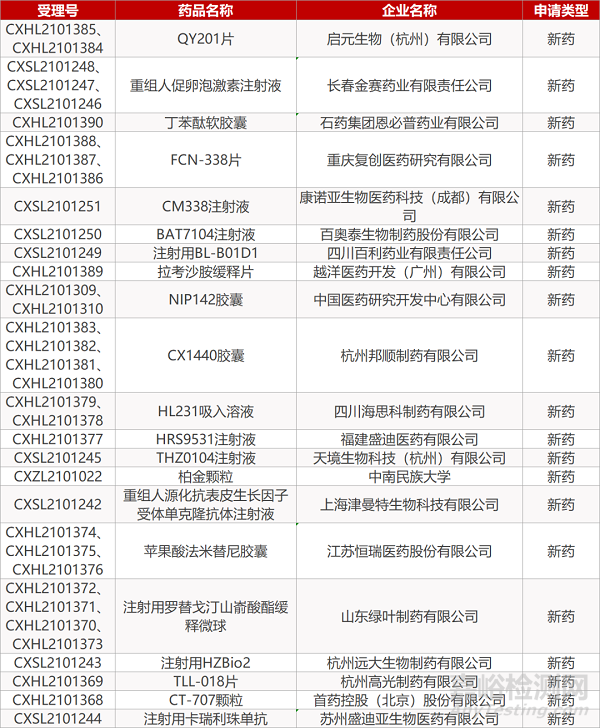
启元生物的QY201片(2个规格)、长春金赛的重组人促卵泡激素注射液(3个规格)、石药集团恩必普药业的丁苯酞软胶囊、重庆复创的FCN-338片(3个规格)、康诺亚生物的CM338注射液、百奥泰的BAT7104注射液、四川百利的注射用BL-B01D1、越洋医药的拉考沙胺缓释片、中国医药研究开发中心的NIP142胶囊(2个规格)、杭州邦顺的CX1440胶囊(4个规格)、四川海思科的HL231吸入溶液(2个规格)、福建盛迪的HRS9531注射液、天境生物的THZ0104注射液、中南民族大学的柏金颗粒、上海津曼特的重组人源化抗表皮生长因子受体单克隆抗体注射液、江苏恒瑞的苹果酸法米替尼胶囊(3个规格)、山东绿叶的注射用罗替戈汀山嵛酸酯缓释微球(4个规格)、杭州远大生物的注射用HZBio2、杭州高光的TLL-018片、首药控股的CT-707颗粒、苏州盛迪亚的注射用卡瑞利珠单抗。
申请生产:

来源:药研发


