您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-02 07:49
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
万春原创新药普那布林获FDA优先审评。万春医药“first-in-class”GEF-H1激活剂普那布林的上市申请获FDA优先审评资格,适应症为:与聚乙二醇化重组人粒细胞刺激因子联用,用于成年非髓性恶性肿瘤患者化疗导致的中性粒细胞减少症(CIN)。在一项Ⅲ期PROTECTIVE-2研究中,在CIN的预防方面,普那布林与培非格司亭的联用显著优于当前的培非格司亭单药标准治疗,该研究在主要和所有关键次要终点方面均达到优效性。该新药已分别获NMPA和FDA授予的突破性疗法认定。
国内药讯
1.贝达药业埃克替尼新适应症即将获批。贝达药业EGFR-TKI靶向1类新药埃克替尼的新适应症申请已进入「在审批」阶段,预计即将获批,单药用于II-IIIA期伴有EGFR基因敏感突变非小细胞肺癌(NSCLC)术后辅助治疗。这将是埃克替尼获批的第三性适应症。此前,埃克替尼在中国已获批用于NSCLC患者的二/三线治疗;以及用于单药一线治疗EGFR基因具有敏感突变的局部晚期或转移性NSCLC患者。
2.康宁杰瑞恩沃利单抗美国Ⅰ期数据发表。康宁杰瑞在医学期刊The Oncologist上发表一项皮下注射PD-L1单抗(恩沃利单抗,KN035)用于晚期实体瘤的美国Ⅰ期临床数据。试验结果显示,KN035耐受性良好,在不同的给药方案下均表现出持久的抗肿瘤活性。所有28例受试者均未出现注射部位反应或输注反应。药代动力学模拟结果支持对300 mg Q3W或400 mg Q4W的固定剂量给药方案进行临床开发。
3.石药新药NBL-015获FDA临床许可。石药集团自主研发的靶向新药NBL-015获FDA临床批件。NBL-015是一种Claudin 18.2单抗药物,拟用于治疗Claudin 18.2阳性表达的晚期实体瘤,包括胰腺癌、胃部、食道或食道胃结合部腺癌。此项I期临床将评估NBL-015对晚期实体瘤患者的安全性、耐受性和药代动力学特性。该新药此前已获FDA颁发针对治疗胰腺癌和胃癌的孤儿药资格。
4.信达联手葆元医药开发ROS1/NTRK抑制剂。葆元医药与信达生物就葆元医药拟用于非小细胞肺癌的下一代ROS1/NTRK抑制剂taletrectinib达成研发合作,两家公司将在大中华区共同开发和商业化taletrectinib。根据协议,葆元医药将获得总额可达1.89亿美元的先期付款及开发费用资助和潜在里程碑付款,以及产品销售分成;信达生物有权在中国香港、澳门和台湾地区共同开发taletrectinib和负责注册报批,葆元医药将继续负责中国大陆的taletrectinib的临床开发和注册报批,和大中华地区的临床生产和商业化生产。
5.创响生物完成C轮融资。创响生物宣布完成1亿美元的C轮融资,由弘晖资本和现有股东瑞伏医疗创投基金共同领投,鼎珮资产管理、前海勤智、益普资本等新投资人,以及其他现有股东中南创投、昆仑资本等参投。创响专注于免疫相关疾病领域的创新药研发,该公司正在打造包括近20个产品的强大管线,其最成熟产品IMG-020即将在美国、中国和欧洲针对多个适应症进入Ⅱ期或Ⅲ期临床试验。
国际药讯
1.英国NICE批准杨森IL-23抑制剂治疗PsA。杨森IL-23抑制剂Tremfya获英国国家健康与护理卓越研究所(NICE)纳入英国医保体系NHS,用于治疗活动性银屑病关节炎(PsA)患者。在两项III期DISCOVER-1和DISCOVER-2研究中,Tremfya显示出有利的风险收益特征,与安慰剂相比,在疾病活动、关节和皮肤症状、功能能力和健康相关的生活质量方面,Tremfya都显示出统计学上的显著收益。此前,NICE已推荐Tremfya用于治疗中重度斑块状银屑病患者。
2.TG新型CD20抗体组合在美报BLA。FDA受理TG Therapeutics公司新型糖工程化CD20单抗ublituximab的生物制品许可申请(BLA),与Ukoniq(umbralisib)联用治疗慢性淋巴细胞白血病(CLL)和小细胞淋巴瘤(SLL)患者。PDUFA目标日期为2022年3月25日。如果获批,这一组合将为初治、以及经治的CLL/SLL患者提供一种新的、无化疗方案。Ukoniq是一种口服、每日一次的、新一代PI3Kδ抑制剂,可独特地抑制CK1-ε,这可能使其克服第一代PI3Kδ抑制剂相关的某些耐受性问题。
3.艾伯维JAK抑制剂国际Ⅲ期结果公布。艾伯维在《柳叶刀》上以两篇独立的文章发表JAK抑制剂乌帕替尼治疗中重度特应性皮炎的关键性国际Ⅲ期研究(Measure Up 1、Measure Up 2和AD Up)积极结果。与安慰剂相比,乌帕替尼在成人和青少年患者中表现出显著改善的皮损清除率和瘙痒减轻;乌帕替尼在3项研究中均达到主要和次要终点;乌帕替尼的安全性与已知研究一致,未观察到新的安全性风险。在中国,该新药上述适应症已被纳入优先审评。
4.新冠病毒感染产生的免疫力持续至少一年。JAMA子刊上发表的一项来自意大利2020年2月到2021年2月期间的新冠核酸检测阳性患者的分析数据。新冠首次感染和二次感染病例积累曲线的分析显示,二次感染仍然是非常罕见的现象。研究人员认为,受到新冠病毒感染后康复的患者,体内产生的免疫保护力可能持续至少一年。不过,目前尚不清楚自然感染带来的免疫力对新冠突变病毒的保护力情况。
5.FDA限制奥贝胆酸治疗晚期肝硬化。FDA日前在Intercept公司肝病药物Ocaliva(obeticholic acid,OCA,奥贝胆酸)的处方信息增加一项黑框警告。Ocaliva是一款FXR激动剂,是FDA近20年来批准治疗原发性胆汁性胆管炎(PBC)的首个新药。在提交给FDA不良事件报告系统的病例以及发表于医学文献中的病例中,接受Ocaliva治疗的PBC伴肝硬化患者发生了肝脏恶化或肝衰竭。FDA禁止Ocaliva用于伴失代偿肝硬化、或有既往失代偿事件或有门脉高压证据的代偿性肝硬化的PBC患者。
6.诺华VEGF品种终止Ⅲ期MERLIN研究。诺华公布VEGF单抗Beovu(brolucizumab)治疗湿性年龄相关性黄斑变性(wet-AMG)的Ⅲ期MERLIN研究最新结果。该研究达主要终点,Beovu与阿柏西普(aflibercept)相比在最佳矫正视力(BCVA)从基线检查的变化方面显示出非劣效性。但Beovu治疗组患者的眼内炎症(IOI)发生率更高(IOI:9.3%vs4.5%);因各种原因导致的总视力丧失率(15个字母或以上)也更高(4.8%vs1.7%)。目前,诺华已终止MERLIN等研究,并更新临床项目。
医药热点
1.印度新冠灭活疫苗存在生产缺陷。印度巴拉特公司生产的新冠灭活疫苗Covaxin在巴西被查出“跳过了确保疫苗中的SARS-COV-2病毒被完全杀死或无法在人体内繁殖的关键步骤”。接种没有完全灭活的Covaxin疫苗相当于被直接注射了新冠病毒本身,非但无法预防新冠病毒,还将造成新冠病毒感染的风险。目前,巴西已暂停了从巴拉特订购的2000万剂疫苗。
2.WHO使用希腊字母命名新冠病毒变异株。当地时间31日,世卫组织(WHO)宣布使用希腊字母命名新冠病毒变异株。这一方法简单且易于使用和记忆。为避免污名化和歧视性的新冠病毒变异株名称,WHO在多个潜在的命名系统中选择了希腊字母,该命名法不会取代病毒原有的科学名称。WHO已为“需关注的变异株”和“待观察的变异株”命名,如在英国首先发现的B.1.1.7变异株被命名为“Alpha”。
3.国家老年医学中心获世卫组织大奖。北京时间5月28日,在第74届世界卫生大会颁奖仪式上,中国国家老年医学中心荣获世卫组织科威特国健康促进基金老年人卫生健康和健康促进研究奖,这也是中国机构首次获得该奖项。国家老年医学中心于2018年5月挂牌,聚焦开展我国老年相关疾病疑难危重症的诊断与治疗;开展高层次老年医学人才培养;承担全国老年医学临床转化研究等。
审评动向
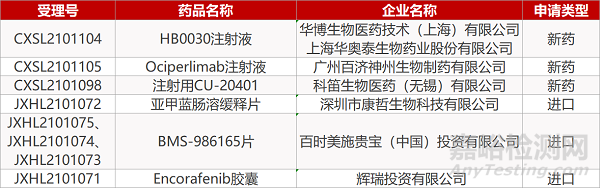
1. CDE新药受理情况(06月01日)
申请临床:
华博生物/上海华奥泰的HB0030注射液、百济神州的Ociperlimab注射液、科笛生物的注射用CU-20401、康哲生物的亚甲蓝肠溶缓释片、百时美施贵宝的BMS-986165片(3个规格) 、 辉瑞的Encorafenib胶囊。
申请生产:
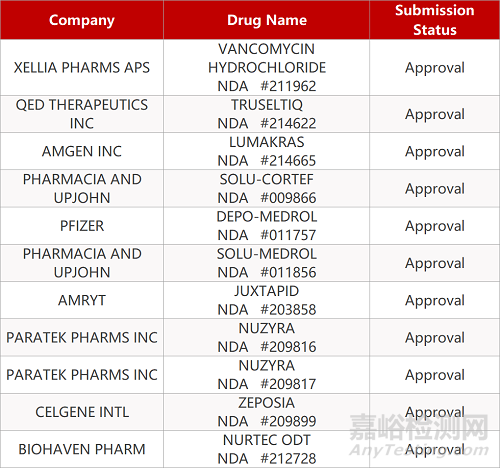
2. FDA新药获批情况(北美05月28日)

来源:药研发


